-
1 实训项目
-
2 微课
-
3 实训报告
-
4 维生素类药物的分析
项目六:维生素C 注射液的含量测定
一、 目的要求:
1 、掌握碘量法测定维生素 C 注射液的基本原理及操作方法,并能进行有关 计算。
2 、了解排除注射剂中常用附加剂干扰的操作。
二、试剂与器材
1 、实验仪器:分析天平、滴定管、刻度吸管、容量瓶、锥形瓶、烧杯、量筒等;
2 、药品:维生素 C 注射液(规格 2 m1:0.5g);
3 、试剂:
(1)稀醋酸:取冰醋酸 60 ml ,加水稀释至 1000 ml ,即得。
(2)淀粉指示液:取可溶性淀粉 0.5g ,加水 5 m1 搅匀后,缓缓倾入 100 ml
沸水中,随加随搅拌,继续煮沸 2 分钟,放冷,倾取上层清液,即得。本液应临 用新制。
(3)碘滴定液(0.05mol/L):取碘 13.0 g,加碘化钾 36g 与水 50 m1 溶解后,加盐酸
3 滴与水适量使成 1000m1,摇匀,用垂熔玻璃滤器滤过。 (注:在定量分析中, 滴定液应进行标定,由于碘滴定液在标定中用到的基准物为三氧化二砷,是毒品, 需通过严格的审批手续才能购买,而且要上锁防盗保管,不方便处理,这里就省 去标定过程。)
(4)其它:丙酮。
三、原理:
维生素 C 分子结构中的连二烯醇基具有较强的还原性,在酸性溶液中,被 碘定量地氧化,因此,可以用碘量法测定其含量。
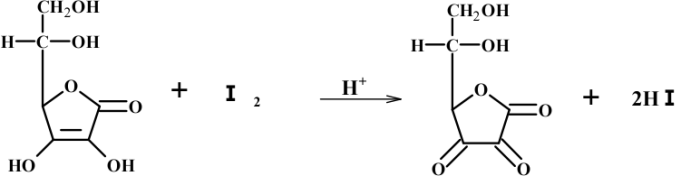
焦亚硫酸钠、亚硫酸氢钠或亚硫酸钠等抗氧剂,可与丙酮或甲醛反应生成加成物,从而排除抗氧剂对测定的干扰。
四、操作步骤
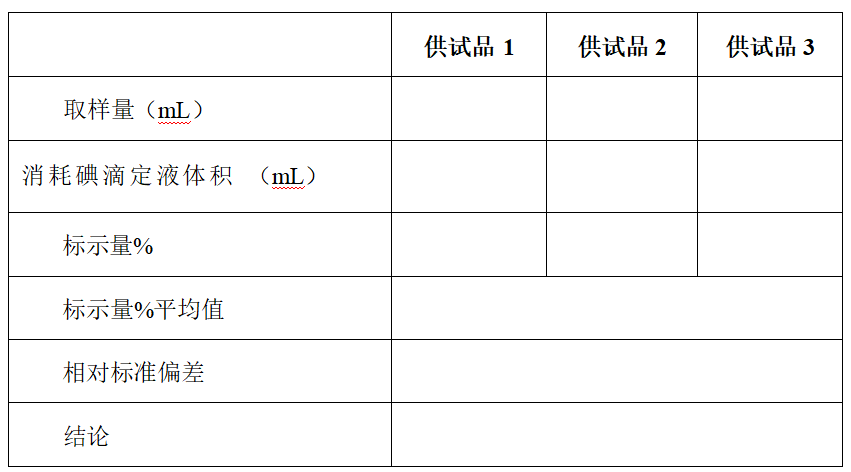
精密量取本品适量(约相当于维生素 C 0.2g)(取维生素 C 注射液 0.8ml), 加水 15 m1 与丙酮 2ml ,摇匀,放置 5 分钟,加稀醋酸 4ml 与淀粉指示液 lml , 用碘滴定液(0.05mol/L)滴定,至溶液显蓝色并持续 30 秒钟不褪。每 1ml 碘滴定 液(0.05 mol/L)相当于 8.806mg 的 C6H8O6 。《中国药典》2010 年版规定本品含 维生素 C(C6H8O6)应为标示量的 90.0%~110.0%。
五、计算:
标示量 % = 取样量× 标示量× 100%
V 为消耗碘滴定液的体积,ml;
T 为滴定度,即每 lml 碘滴定液相当于 8.806mg 的 C6H8O6 ,mg/ml: F 为碘滴定液的浓度校正系数;
W 为供试品取样量,ml。
六、注意点:
l 、测定中加入稀醋酸,是使滴定在酸性溶液中进行,在酸性介质中维生素 C 受 空气中氧的氧化速度减慢,但样品溶于稀酸后仍需立即进行滴定。
2 、应以重新煮沸冷却的水作为溶媒, 目的是减少水中溶解氧对测定的干扰。
3 、测定中加入丙酮,是为了消除注射液中的抗氧剂焦亚硫酸钠(或亚硫酸氢钠) 的干扰。