-
1 微视频
-
2 教学录像
-
3 电子课件
-
4 电子教材
-
5 扩展阅读
-
6 生理与临床
心室肌细胞动作电位
窦房结P细胞动作电位
第一节 心脏的生物电活动
心脏的四个肌泵分别为左右心房和心室,心房和心室不停地进行有顺序的协调的收缩和舒张交替的活动,是心脏实现泵血功能、推动血液循环的必要条件,而心肌细胞的动作电位则是触发心肌收缩和泵血的动因。因此,掌握心脏的生物电活动的规律,对于理解心肌的电生理和机械特性有重要意义。
心脏主要由心肌细胞组成。根据其形态特点、电生理特性及功能特征,心肌细胞可分为两类:一类是自律细胞(autorhythmic cell),包括窦房结(sinoatrial node)P细胞(pacemaker cell)和浦肯野细胞(Purkinje cell),具有自律性(autorhythmicity)、兴奋性及传导性,是心脏活动的起搏点。这类细胞含肌原纤维甚少或缺乏,故几乎无收缩功能。另一类是非自律细胞(non-autorhythmic cell)包括心房肌细胞(atrial muscle)和心室肌细胞(ventricular muscle),具有兴奋性(excitability)、传导性(conductivity)和收缩性(contractility),执行心的泵血(或射血)功能,故又称为工作细胞(working cell)。心脏的泵血功能是通过这两类细胞相互配合和协调的工作来实现的。自律细胞是特殊分化了的心肌细胞,组成心脏的特殊传导系统,是心内发生兴奋和传导兴奋的组织,控制心脏自动而有节律的活动,该系统的活动决定了心脏活动的节律和频率;非自律细胞(心室和心房肌)则在自律细胞发出和传导的兴奋作用下,进行有节律性的收缩和舒张活动,该类细胞的活动决定了心脏的射血能力,二者协同作用使心输出量与整体的生化代谢和生理功能保持平衡。
一、心肌细胞的跨膜电位
心肌细胞的跨膜电位(transmembrane potential)变化涉及多种离子运动,其波形和形成机制比神经和骨骼肌的复杂。而且,不同类型心肌细胞的跨膜电位也不尽相同。同前述的生物电基本知识一样,心肌细胞的跨膜电位变化也是由于细胞内外存在着离子浓度梯度和细胞膜在不同状态下对离子的通透性不同引起的。
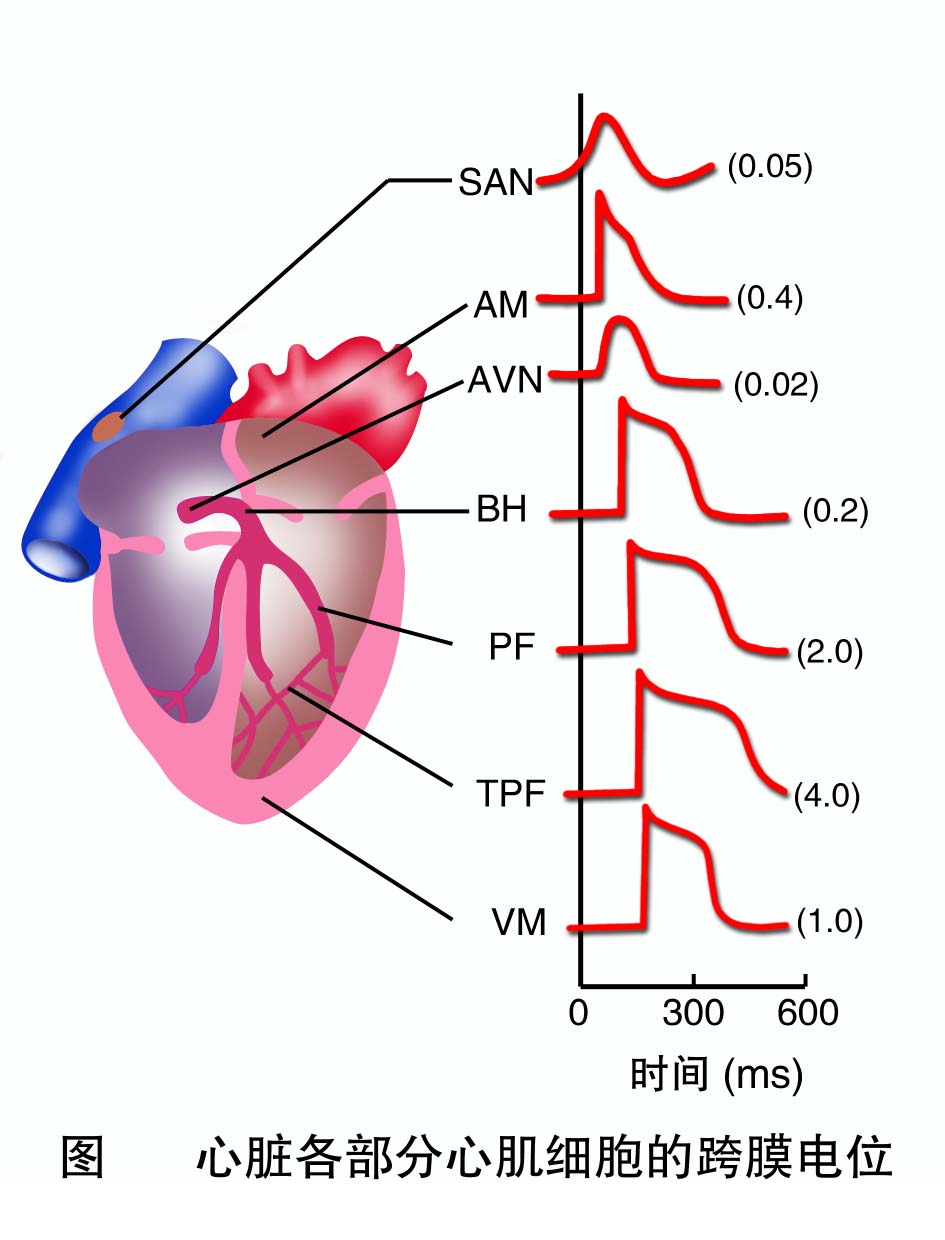
(一)非自律细胞的跨膜电位及形成机制
下面以心室肌细胞为例叙述非自律细胞跨膜电位及形成机制。
1.静息电位 人和哺乳动物心室肌细胞的静息电位约为-90mV,其形成机制与神经元、骨骼肌细胞基本相同。静息时,心室肌细胞膜IK1通道开放,K+顺浓度梯度外流,但在静息时心肌细胞膜对Na+也有一定的通透性,有少量Na+内流;此外,膜上的生电性Na+-K+泵的活动对静息电位产生一定的影响。所以,心室肌细胞实际测得的静息电位的数值是K+平衡电位、少量内流和生电性Na+-K+泵活动的综合结果。
2.动作电位 心室肌细胞的动作电位与骨骼肌和神经纤维的比较,具有明显不同的特点。骨骼肌细胞动作电位时程很短,复极化速度和去极化速度相近,记录曲线呈升支和降支基本对称的尖锋状。心室肌细胞动作电位特点是复极过程复杂,持续时间长,升降支不对称。它可分为去极化和复极化两个过程,并可进一步分为0、1、2、3、4五个时期。
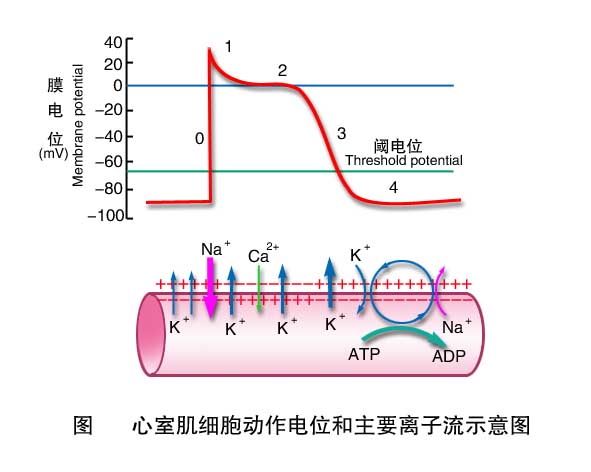
0期(去极化过程) 静息状态时,心室肌细胞膜在传来的兴奋激发下,部分钠通道激活开放,少量Na+内流,膜电位从-90mV局部去极化达-70mV的阈电位,引起钠通道开放概率和开放数量明显增加,大量Na+顺浓度梯度和电位梯度快速流入细胞(0mV以上的膜内正电位转化为Na+内流的阻力),直至接近约+30mV的钠平衡电位,历时1~2ms。钠通道属快通道,它激活开放和失活关闭的速度都很快,在膜去极化达-50~-60mV时被激活,开往时间约1ms;在膜去极化到0mV左右时开始失活。可被河豚毒(tetrodotoxin)选择性阻断。它激活快,失活也快,故开放时间很短。
1期(快速复极初期) 此时快钠通道失活,而负载K+的一过性外向电流(transient outward current, Ito)通道开放,引发瞬时性K+外流,膜内电位从+30mV迅速降至0mV左右,历时10ms。Ito通道在膜去极化到-40mV时被激活约开放5~-10ms。 0期和1期合称锋电位。
2期(平台期) 在2期末膜内电位达0mV左右后,复极化过程就变得非常缓慢,动作电位图形比较平坦,称为平台期(plateau)。平台期历时100~150ms,是心室肌细胞动作电位持续时间较长的主要原因,也是心室肌细胞动作电位区别于神经和骨骼肌细胞动作电位的主要特征。平台期膜离子流既有外向电流(K+外流)又有内向电流(主要为Ca2+内流),开始时外向电流和内向电流趋于平衡状态,在平台期后期,内向电流减弱,外向电流增强,导致膜电位的复极化速度加快。
心室肌细胞膜存在一种L型Ca2+通道(long-lasting calcium channel),当膜去极至-30~-40mV时,L型Ca2+通道被激活,0期后表现为持续开放,细胞外的Ca2+在浓度梯度驱使下缓慢内流,使膜去极化。并伴有少量Na+内流。L型Ca2+通道可被Mn2+和多种Ca2+通道阻断剂如维拉帕米等阻断。
在平台期,K+通过延迟整流钾通道(delaye rectifier K channel, I K通道 )外流。I K在膜电位去极化至-40mV时激活,但开放速率缓慢,在平台期K+外流逐步增加。Ca2+内流和K+外流形成的电流平衡使膜内电位在0mV左右滞留约而构成平台期。
另外一种钾通道,即内向整流钾通道(I K1通道)与较长的平台期形成有关,I K1通道对K+的通透性因膜的去极化而降低,这一现象称内向整流(inward rectification)。I K1通道在心室肌细胞膜静息状态时开放,0期去极化中迅速关闭,K+外流大大减少。在平台期I K1电流几乎为零,使膜电位不能迅速复极化。
3期(快速复极末期) 在2期末,钙通道失活,Ca2+内流停止;而I K1及I K通道加速开放,K+再生性外流。膜内电位从0mV左右较快地下降至-90mV,完成复极过程,占时约100~150ms。
从0期去极开始至3期复极完毕的这段时间即为动作电位时程(action potential duration)。心室肌细胞动作电位时程约200~300ms。
4期 该期是心室肌细胞膜电位恢复并稳定于静息电位水平(-90mV)的时期。此期离子的跨膜转动仍然活跃,细胞需要排出去极化期和复极化时进入胞内的Na+、Ca2+,并摄入去极化期流出的K+。钠泵工作,每次运转可泵出3个Na+并泵入2个K+,因而是生电性的。Ca2+的主动外运主要通过细胞膜的Na+-Ca2+交换体(Na+-Ca2+ exchanger)进行,膜外3个Na+内流可交换膜内1个Ca2+外流,可见Na+-Ca2+交换也是生电性的。进入细胞的Na+再由Na+-Ca2+泵排出细胞。此外,膜上少量的钙泵(calcium pump)也可主动排出Ca2+。
心房肌细胞动作电位的形成机制与心室肌细胞的大致相同,但时程较短,约150ms左右。主要原因是心房肌细胞膜对K+的通透性较大导致2期提前结束所致。
(二)自律细胞的跨膜电位及形成机制
自律细胞与非自律细胞(工作细胞)动作电位的最大区别是在4期。非自律细胞4期膜电位基本稳定,而自律细胞4期膜电位不稳定,当3期复极化达到最大复极电位(maximal repolarization potential)之后,4期即开始自动去极化,一旦去极化达到阈电位水平,就爆发一次新的动作电位。
根据自律细胞动作电位0期去极速度和产生机制不同,可分为快反应自律细胞和慢反应自律细胞。快反应自律细胞的动作电位0期与心室肌细胞相似,去极速度快、幅度高,主要与细胞膜上快Na+通道开放、Na+内流有关。慢反应自律细胞的动作电位0期去极速度慢、幅度低,主要与膜上慢Ca2+通道开放、Ca2+内流有关。快反应自律细胞有房室束及束支和浦肯野细胞等;慢反应自律细胞有窦房结、房结区和结希区的细胞。
快反应细胞和慢反应细胞在特定的条件下可发生相互转化。用快通道阻断剂河豚毒处理浦肯野细胞后,Na+不能经快通道内流,但Ca2+经慢通道内流的缓慢去极作用仍然存在,其结果是原来的快反应电位变为慢反应电位。在心肌缺血缺氧、高血钾或洋地黄中毒时,可使心室肌细胞的静息电位变为-60mV,此时,快反应细胞转变为慢反应细胞,兴奋传导速度减慢易于形成传导阻滞或形成兴奋折返,没有自律性的心室肌细胞表现出自律性,由此导致异位心律。在实验条件下,用氨甲酰胆碱作用于窦房结使其超极化,窦房结细胞也可出现快反应电位,表明窦房结也存在快钠通道,只是在正常情况下钠通道处于失活状态。
以下以浦肯野和窦房结细胞为代表,分别介绍快反应自律细胞和慢反应自律细胞跨膜电位的特征及形成机制。
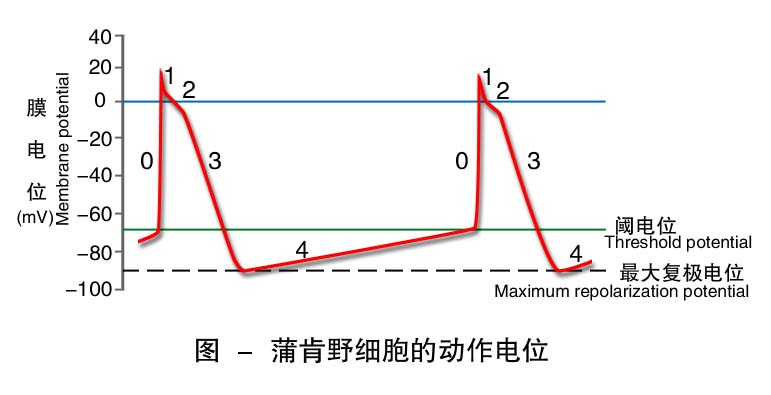
1.浦肯野细胞 浦肯野细胞是一种快反应细胞,其动作电位的波形、幅度及形成机制与心室肌细胞的相似,分为0期、1期、2期、3期和4期。最大差别在于浦肯野细胞4期自动去极化。4期自动去极化的机制包括IK递减和If递增,IK通道在0期去极化时开始开放,3期复极至-60mV左右时,开始关闭,至最大复极电位时接近完全关闭。因此,在浦肯野细胞4期中由于IK衰减引起的外流减少对于自动去极化所起的作用较小,而发挥主要作用的是If。If通道在3期复极达到左右时开放,此后开放数量渐增,使If随时间的推移而增强。因为浦肯野细胞最大复极电位为-90mV,接近If通道的完全激活电位-100mV。故If电流在浦肯野细胞中的作用大于其在P细胞中的作用。
2.窦房结P细胞 窦房结细胞动作电位的幅值小,约70mV,由0期、3期和4期构成,无1期和2期。最大复极电位约为-70mV,0期去极化到0mV左右,无明显超射。其最大特点是4期自动去极化。窦房结4期自动去极的速率较浦肯野细胞的快,达阈电位的时间较之为短,单位时间内的产生兴奋的次数较之为多。
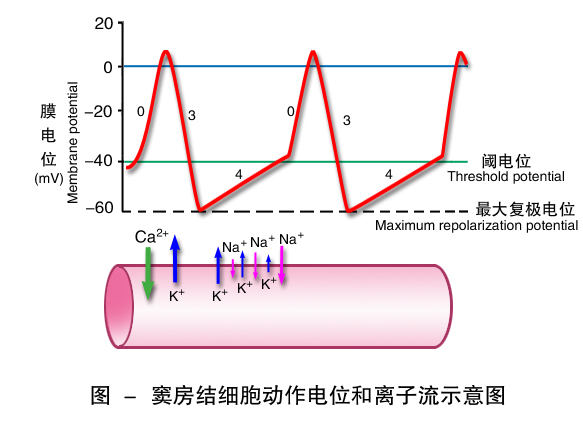
0期 当膜电位由最大复极电位去极化达阈电位(-40mV)时,P细胞膜上的L型Ca2+通道激活,Ca2+内流引起0期去极化。由于L型Ca2+通道激活和失活较缓慢,因此窦房结细胞0期去极化速度较缓慢,持续时间较长(约7ms)。
3期 膜电位去极化达到0mV时,Ca2+通道逐渐失活,Ca2+内流减少。在复极的初期,I K通道开放,K+外流引起3期。因P细胞最大复极电位仅约为-70mV,钠通道处于失活状态,故P细胞的0期无Na+内流参与。
4期 引起窦房结P细胞自动去极化的净内向电流由一种外向电流(I K)和两种内向电流(I f和I Ca-T)构成。最大复极电位时,I K通道逐渐失活而关闭,导致K+外流递减,使内向电流超过外向电流。目前认为K+通道的时间依从性的关闭造成的K+外流进行性衰减是窦房结自动去极化最重要的离子基础。与此同时,If通道部分激活,允许少量Na+呈递增性内流。窦房结还存在另一种通道,即T型Ca2+通道(transient calcium channel),当局部去极化到-50mV时,膜上T型Ca2+通道激活,少量Ca2+内流而参与4期自动去极化后期的形成。
自律细胞4期自动去极化(phase 4 spontaneous depolarization)具有去极速度随时间而递增的特点,是自律细胞产生自动节律性兴奋的基础。自律细胞4期自动去极化是由进行性净内向电流引起的,这种净内向电流的产生可能有三种原因:内向电流逐渐增强、外向电流逐渐减弱或二者兼有。不同类型的自律细胞净内向电流的离子种类和离子流方向不完全相同,如浦肯野细胞4期If起主要作用,Ik的衰减作用很小,而窦房结P细胞以Ik的衰减作用为主,If 和T型Ca2+通道亦有部分作用。
二、心肌的电生理特性
心肌细胞的生理特性包括自律性、兴奋性、传导性和收缩性。其中,前三种属电生理特性,而收缩性为机械特性。
(一)自律性
细胞、组织在无外来刺激的作用下能够自动发生节律性兴奋的特性称为自动节律性(autorhythmicity),简称自律性。具有自律性的细胞或组织称为自律细胞或自律组织。自律性包括自动性和节律性两个方面,前者反映心在单位时间内活动的频率,后者反映心活动的规则程度。自律性高低的衡量指标为自动兴奋的频率。
1.心脏起搏点 自律细胞广泛存在于心脏特殊传导系统。窦房结P细胞、房室交界(结区除外)、房室束、末梢浦肯野细胞的自动兴奋频率分别约为每分钟100、50、40和25次左右。正常情况下,窦房结的自动兴奋频率最高,它产生的节律性兴奋向外扩布,依次激动心房肌,房室交界、房室束、心室内传导组织和心室肌,引起整个心脏的节律性兴奋和收缩。窦房结是主导心脏正常兴奋和跳动的部位,称为正常起搏点(normal pacemaker)。以窦房结为起搏点的心脏节律称为窦性心律(sinus rhythm)。窦房结的功能活动在生理和病理情况下都可发生变化。成人窦性心律的频率超过100次/分,称为窦性心动过速(sinus tachycardia),健康人在饮酒或饮咖啡以及情绪激动时可发生;而心率低于60次/分,则称为窦性心动过缓(sinus bradycardia),常见于健康的青年人,运动员和睡眠状态;缺血和缺氧等原因致窦房结功能受损,可出现窦性心律不齐或窦性静止等改变。
窦房结之外的自律组织在正常情况下不表现本身自律性,称为潜在起搏点(latent pacemaker)。异常情况下,窦房结的兴奋因传导阻滞而不能控制其他自律组织的活动或潜在起搏点的自律性提高,潜在起搏点就可控制部分或整个心脏的活动,成为异位起搏点(ectopic pacemaker)。异位起搏点控制的心脏活动称为异位心律(ectopic rhythm)。窦房结通过两种方式实现对潜在起搏点的控制:①抢先占领 由于窦房结4期自动去极速率较潜在起搏点的快,如窦房结为0.1V/s,浦肯野细胞为0.02V/s,故当潜在起搏点4期自动去极化尚未达到阈电位时,它受自律性最高的窦房结传来的冲动作用而产生动作电位,其自身的自律性不能表现出来。②超速驱动压抑 指当更高频率的外来超速驱动停止后,低频率的自律组织不能立即表现其自律性活动。正常情况下,窦房结、房室交界处和浦肯野细胞在单位时间(分钟)内可发出的冲动频率分别为60~100次、40~50次和15~40次。由于潜在起搏点经常被迫随窦房结的冲动发生节律性兴奋,故自身的起搏能力受到抑制,一旦窦房结发放的冲动停止,会导致全心较长时间的停搏。基于此,在临床对病人行人工起搏时,应逐渐减慢起搏频率后再中断起搏器工作,以避免发生心搏暂停。
2.影响自律性的因素
⑴4期自动去极化的速度 4期自动去极化的速率与膜电位从最大复极电位达到阈电位水平所需的时间密切相关。4期速度快,到达阈电位所需的时间缩短,单位时间内产生兴奋的次数增多,自律性增高,反之,自律性降低。交感神经释放的去甲肾上腺素可增大窦房结细胞膜上的If电流和促进Ca2+通道开放,使Na+和Ca2+内流增多,4期自动去极化速度加快,自律性增高;迷走神经兴奋时末梢释放的乙酰胆碱,在提高膜对K+的通透性,导致4期膜K+外流衰减的同时,还抑制膜上的If电流和Ca2+通道开放,故4期自动去极化速度减慢,自律性降低。
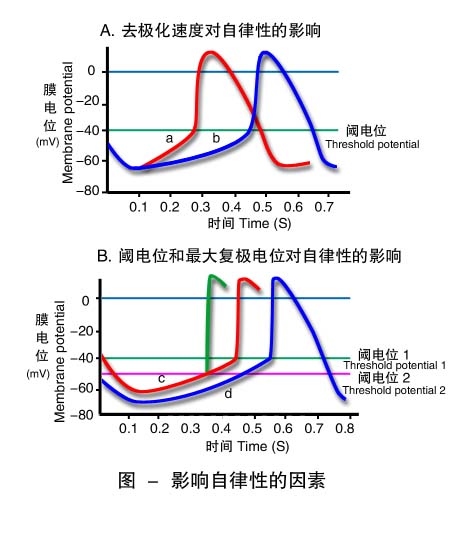
⑵最大复极电位与阈电位之间的差值 最大复极电位下移(绝对值变大)或阈电位上移(绝对值变小),二者之间的差值增大,到达阈电位所需时间延长,自律性降低;反之,自律性增高(图7-4)。迷走神经释放的乙酰胆碱可增加细胞膜对K+的通透性,3期K+外流增多导致最大复极电位更负,故心率(heart rate)减慢。
(二)兴奋性
兴奋性是指组织或细胞对刺激产生动作电位的能力。衡量兴奋性的指标主要用阈值来表示。阈值高表示兴奋性低,反之兴奋性则高。所有心肌细胞都具有兴奋性。
1.影响兴奋性的因素
⑴静息电位与阈电位之间的差值 静息电位(或最大复极电位)绝对值变小,或阈电位绝对值增大,二者之间的差值减小,引起兴奋所需的刺激阈值变小,兴奋性增高。反之,兴奋性降低。
1)静息电位或最大复极电位的水平:如果阈电位水平不变,静息电位(或最大复极电位)绝对值增大时,与阈电位之间的差距加大,引起兴奋所需的刺激强度增大,兴奋性降低。例如乙酰胆碱因增加细胞膜对K+的通透性,K+外流增多,静息电位绝对值增大,兴奋性降低。反之,静息电位(或最大复极电位)绝对值减小时,与阈电位之间的差距缩小,引起兴奋所需的刺激强度减小,兴奋性升高。如轻度血钾升高,细胞膜内外的钾浓度梯度下降,K+外流减少,静息电位绝对值减小,兴奋性增高。但静息电位绝对值显著减小时,由于部分通道失活而使阈电位上移,兴奋性反而降低。
2)阈电位水平:如果静息电位或最大复极电位的水平不变,阈电位水平上移,静息电位(或最大复极电位)与阈电位之间的差距加大,兴奋性降低。奎尼丁可抑制钠通道的激活,使阈电位上移,需要更强的刺激才能引发动作电位,兴奋性下降。反之,如果阈电位下移,则意味着兴奋性升高。
⑵去极化期的离子通道状态 分别引起快反应细胞和慢反应细胞产生0期去极化的钠通道和钙通道均有备用(resting)、激活(activation)和失活(inactivation)三种状态。通道处于何种状态取决于当时膜电位的水平及产生动作电位后的时间进程。在快反应细胞,当膜电位处于静息电位时,钠通道处在关闭的备用状态,随时可被激活而开放。当膜电位局部去极化达阈电位时,钠通道大量开放,处于激活状态,Na+内流。钠通道激活后迅速关闭,进入失活状态,失活过程历时几个毫秒到10ms。任何刺激均不可能引起失活通道再次开放,只有在膜电位恢复到静息电位水平时,钠通道才可复活至备用状态,即恢复产生兴奋的能力。处于静息状态的钠通道数量越多,膜的兴奋性就越高,反之进入失活状态的钠通道数量越多,膜的兴奋性就越低,当全部钠通道由静息状态进入失活状态后,膜的兴奋性为零。钙通道状态的变化过程与钠通道的相似,只是激活、失活及复活的速度较慢,且最大复极电位及激活电位均较小而已。
2.兴奋性的周期性变化
心肌细胞在发生一次兴奋的过程中,伴随膜电位的变化,Na+通道经历激活、失活和复活(备用)等状态的变化,其兴奋性亦发生周期性的变化。
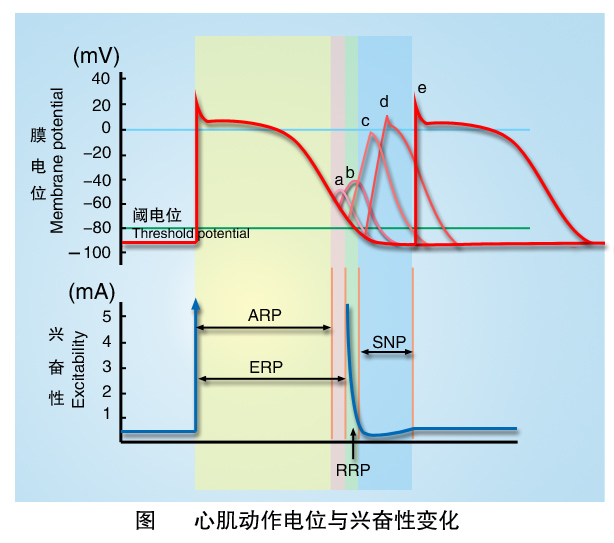
⑴有效不应期 从0期开始到复极达-55mV的时期内,膜兴奋性为零,心肌细胞对任何强度的刺激均无反应,此期称绝对不应期(absolute refractory period)。3期复极过程中,从-55mV复极到-60mV这段时间内,强刺激可引起膜局部去极化,此期称为局部反应期(local response period)。由于从0期开始到复极达-60mV这一段时间内,心肌不能再次产生动作电位,因此将这段时间称为有效不应期(effective refractory period)。此期是因膜电位绝对值过低,钠通道完全失活或复活的数量太少所致。
⑵相对不应期 指3期复极阶段中膜电位从-60mV到-80mV这一时期称为相对不应期(relative refractory period)。在此期内,膜电位已接近于静息电位水平,大部分钠通道逐渐复活,但开放能力尚未恢复正常,所以,心肌兴奋性虽逐渐恢复但仍低于正常,需阈上刺激才能引起新的动作电位。
⑶超常期 膜电位从-80mV复极到-90mV的时期,称为超常期(supranormal period)。由于此期钠通道已基本复活,且膜电位绝对值小于静息电位值,与阈电位的差距较小,兴奋性高于正常,故阈下刺激亦可引起兴奋。
在相对不应期和超常期发生的动作电位,其0期的速度、幅度均低于正常。这是由于钠通道尚未完全复活所致。此时动作电位产生的局部电流较小,故兴奋的传播速度减慢,容易导致心律失常或形成折返。
3.兴奋性的周期性变化与心肌收缩活动的关系
⑴不产生强直收缩 与骨骼肌相比,心肌细胞的有效不应期很长,横跨收缩期并延伸至舒张早期开始后。在此期内任何刺激均不能再次引起动作电位和收缩,故心肌不会发生骨骼肌那样的完全强直收缩。这就确保了心脏必须以收缩和舒张交替的形式进行活动,进而实现泵血功能。
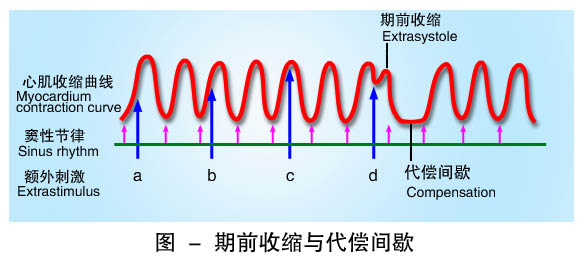
⑵期前收缩与代偿间歇 如果在有效不应期之后、下一次窦房结的兴奋到达之前,心肌受到人工或来自异位起搏点的激动而产生一次提前的兴奋和收缩,称为期前兴奋和期前收缩(premature systole)。期前兴奋也有自己的有效不应期,紧接期前兴奋后的一次窦性兴奋传到心室时,刚好落在期前兴奋的有效不应期内,故不能引起心室再次收缩,收缩曲线上出现一次收缩的“脱失”。因此,在一次期前收缩后往往有一段较长的心室舒张期,称为代偿性间歇(compensatory pause)。在临床上,频繁或多发的房性或室性期前收缩可由心肌炎、心肌缺血、麻醉和手术、以及药物和电解质紊乱等因素引起。
(三)传导性
细胞传导兴奋的能力称为传导性。传导性的高低可用动作电位传播的速度来衡量。同其它可兴奋细胞一样,心肌兴奋也是以局部电流的机制传至邻近未兴奋膜,进而引起邻近膜发生动作电位的。心肌细胞之间的低电阻缝隙连接(gap junction)结构有利于局部电流的通过,使兴奋能在细胞之间迅速传播,从而构成心脏功能性合胞体(functional syncytium),保证两心室的同步性收缩,以产生强大的射血力量。
1. 兴奋在心脏内的传播
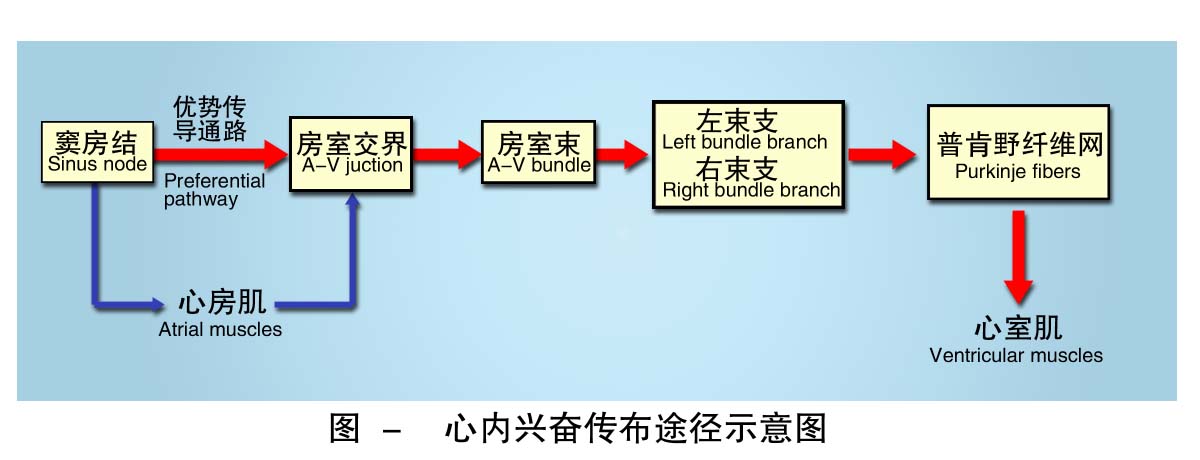
⑴传播途径 窦房结产生的兴奋传至左、右心房肌,同时主要经优势传导通路(preferential pathway)传播到房室交界(atrioventricular node),再经房室束、左右束支、浦肯野纤维网传至心室肌。左、右房室口周围的纤维环将心房、心室隔开,正常情况下,心房的兴奋必须经房室交界才能传入心室。所以,窦房结起搏的动作电位经一定途径先后引起左右心房和左右心室的兴奋。房室交界自上而下分为三个功能小区:房结区、结区和结希区。房室交界具有自律性(结区除外)。房室束(atrioventricular bundle)主要含浦肯野细胞,分为左右束支,最后延伸为浦肯野纤维网,连接心室肌细胞。
⑵传播速度 所有心肌细胞均具有传导性,但不同的心肌细胞其传播兴奋的速度不尽相同。一般心房肌的传导速度约为0.4m/s,优势传导通路的传导速度较快,约为1m/s,心室内末梢浦肯野纤维网的传导速度最快,可达2~4m/s,比心室肌的传导速度(约1m/s)快得多。浦肯野纤维传导速度快,使兴奋能迅速地扩布至两心室,保证两心室同步地进入收缩状态而产生强大的射血力量。但是,在房室交界的传导性很低,尤其是结区的传导速度仅为0.02m/s,主要原因是该处细胞为慢反应细胞,动作电位的0期幅度小、速度慢,产生的局部电流较小;该处细胞的直径小,细胞间缝隙连接数量少,不利于局部电流的传播;细胞内糖原含量少代谢低,兴奋性低,故传导兴奋的能力弱。兴奋在房室交界处的缓慢传播,耗时可长达0.1秒的现象称为房室延搁(atrioventricular delay)。房室延搁使心室收缩在心房收缩完成之后才开始,有利于心室在充分充盈后实现其正常射血功能。但由于传导速度慢,房室交界处较易发生传导阻滞(conduction block)。正常人可因迷走神经的兴奋性增强而引起房室传导时间延长。风湿性心肌炎、冠心病、血钾浓度升高或降低等,均可引起房室传导阻滞。
⑶房室结的过滤作用 房室交界区的细胞传导兴奋的速度缓慢,一次兴奋后的有效不应期持续到复极完毕之后,在心率加快时,不应期缩短也不明显。因此,对高频率的兴奋具有过滤作用(filtration)。在心房纤颤时,其兴奋的频率可达350次/分或以上,但只有不足1/2的兴奋能下传到心室,心室率一般在100~160次/分,这样就使心室有足够的时间充盈血液以利于完成其射血的功能。
2.影响传导性的因素
⑴心肌细胞的结构 心肌细胞的直径愈大,其内阻愈小,局部电流向前影响的距离愈远,传导速度愈快;反之,传导速度则慢。例如,末梢浦肯野细胞的直径最大(羊的末梢浦肯野细胞的直径约为70μm),传导速度最快;而结区的细胞直径最小(仅3μm),传导速度最慢。另外,闰盘处缝隙连接的数量和功能状态对传导速度也有明显的影响。在窦房结和房室交界处,缝隙连接数量少,传导速度较慢。心肌细胞受损或细胞内H+浓度过高可导致细胞间通道关闭,传导速度减慢。
⑵0期的速度和幅度 0期去极化引起局部电流的产生。去极化速度愈快及幅度愈大,产生的局部电流也就愈大,传播距离愈远,达到阈电位的速度也愈快,导致传导速度加快;反之,传导减慢。静息电位绝对值较大可使钠通道开放的速度增快及开放数量增多,从而提高传导性。例如,代谢障碍或强心苷中毒时,Na+泵活动重度抑制,使细胞外K+浓度升高,二者均可导致静息电位绝对值减小,0期去极速度减慢,传导性降低。此外,快反应细胞与慢反应细胞的传导速度差异也是由于0期去极化的速度和幅度不同引起的。
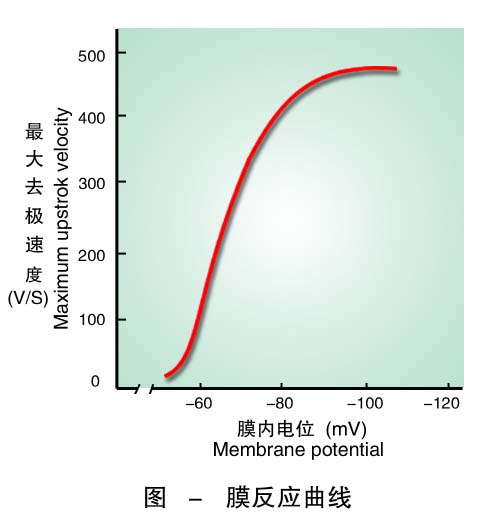
⑶邻近未兴奋部位膜的兴奋性 兴奋的传导是因局部电流从已兴奋膜传至未兴奋膜而引起的。因此,邻近未兴奋部位膜的兴奋性必然影响兴奋的传导。如前所述,兴奋性与钠通道所处的状态、静息电位和阈电位的差值等有关。静息电位和阈电位的差值增大,兴奋性降低,传导速度减慢;反之,传导速度加快。钠通道若处在备用状态,传导速度快;若处于失活状态,则传导受阻。
(四)收缩性
心肌的收缩性是指由参与收缩的心肌细胞共同表现出的一种内在的能力或特性。在收缩的过程中产生的张力大、缩短的速度快和程度大,表明收缩力强,如在支配心的交感神经传出冲动增多时;反之,则表示收缩力减弱,如支配心的迷走神经兴奋时。
心脏工作细胞的收缩机制与骨骼肌的相似。当心肌细胞胞浆Ca2+浓度升高时,肌纤维收缩;Ca2+浓度降低,心肌舒张。但由于心肌细胞的结构及电生理特性与骨骼肌的不完全相同,心肌收缩时表现有自己的特点:
1.对细胞外内流的Ca2+的依赖性较大 心肌细胞收缩时对细胞外Ca2+依赖性大,这是因为心肌细胞的肌质网不如骨骼肌的发达,贮Ca2+量少。在心肌动作电位的平台期,细胞外的Ca2+通过L型Ca2+通道流入,使胞质内Ca2+浓度升高,Ca2+浓度升高再触发肌质网释放大量的Ca2+,使胞质内的Ca2+浓度升高约100倍,从而引起心肌收缩。这种由少量Ca2+内流引起细胞内Ca2+库释放大量Ca2+的过程,称为钙触发钙释放(calcium-induced calcium release)。当胞浆内Ca2+浓度升高时,Ca2+与肌钙蛋白结合,触发粗肌丝上的横桥与细肌丝的肌纤蛋白结合并发生扭曲和摆动,从而导致心肌细胞收缩。如去除细胞外Ca2+,将发生“兴奋-收缩脱耦联”(excitation-contraction uncoupling)现象,即可见动作电位的产生但无心肌收缩的表现。
心肌细胞收缩对外Ca2+的依赖性是由Ringer发现的。Fielder是Ringer请的科研助手,负责用蒸馏水配制用于蛙心收缩实验的溶液,同时也做一些实验观察。有一天,蒸馏水用完了,Fielder就用自来水配制溶液,他发现心脏在其中比在用蒸馏水配制的溶液中跳得更有力且活动更持久。他把这个结果告诉了Ringer。Ringer随之进一步研究和分析,发现是自来水中存在Ca2+的缘故。Ringer发现Ca2+增强心收缩力的作用,为其后对Ca2+的其他生理作用以及Ca2+的病理和药理等作用的研究奠定了基础,因此被誉为生命科学研究中的伟大发现。
2.“全或无”式收缩 闰盘缝隙连接使兴奋在心肌细胞之间迅速直接传播,导致全部心房或心室肌细胞几乎同步参与收缩,表现为功能合胞体的活动。而骨骼肌收缩时参与活动的肌纤维数目可因兴奋的神经纤维数目而异。
3.不发生完全强直收缩 心室肌细胞动作电位2期(平台期)持续时间长,可达100~150ms,是其有效不应期长的主要原因。心室肌有效不应期从收缩期开始持续至舒张的早期,因此,必须待舒张开始后才可能接受刺激而产生再次收缩,故不会发生强直性收缩,而是收缩和舒张交替地进行,以保证心脏射血功能的实现。
三、体表心电图
在一个心动周期中,由窦房结产生的兴奋,按一定的途径和时程,依次传向心房和心室,引起心脏发生一系列的生物电变化。由于人体是一个导电性能良好的容积导体,心脏的生物电活动可传播到机体的任何部位。若将引导电极安置在体表的特定部位,借助于心电图机就能记录到心脏电活动的波形,即体表心电图(electrocardiogram,ECG,图7-7)。心电图是整个心脏的心肌从兴奋的产生、传导到恢复过程的综合向量变化。
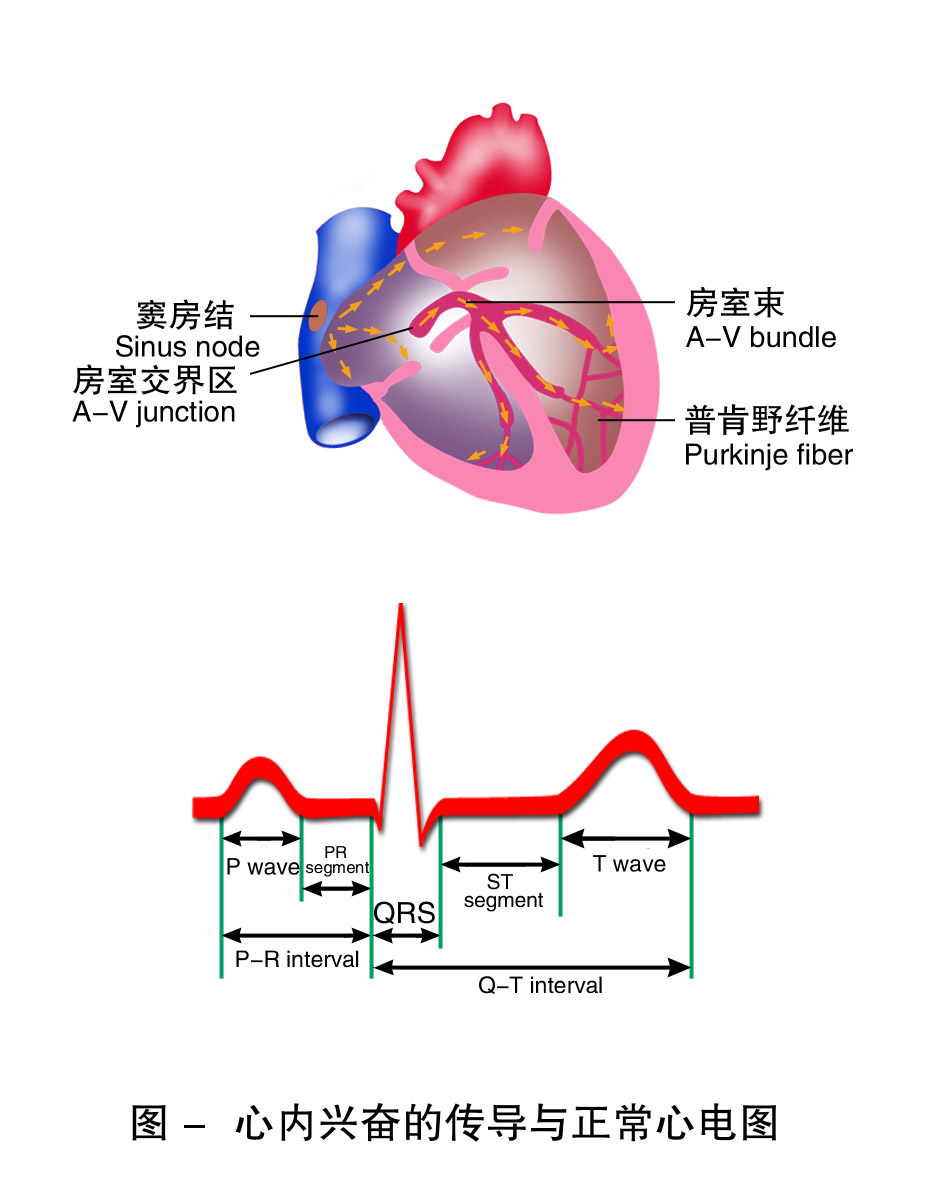
心电图各波是由Einthoven命名的,分别由P波、QRS波群和T波构成,偶尔可见U波。因所用导联方式的不同,心电图各波的形态、幅度亦有所不同。
P波代表左右两心房的去极化过程,其时程反映去极化在整个心房传播所需的时间。
P波波形小而圆钝,历时0.08~0.11ms,波幅不超过0.25mV。QRS波群代表左右两心室的去极化过程。它包括三个顺序相连的电位波动:第一个向下的Q波,随后向上的R波和最后向下的S波。正常的QRS波群历时约0.06~0.10s,代表兴奋在心室肌扩布所需的时间。QRS各波在不同导联中差异较大。T波反映心室复极化(3期)过程中的电位变化,其方向与QRS波群主波的方向一致。历时0.05~0.25s,波幅为0.1~0.8mV。U波见于T波之后,小而低宽,方向一般与T波一致,成因及意义不明。PR间期(或PQ间期)是指从P波起点到QRS波起点的时程,代表去极化从窦房结产生并传到心室肌所需的时间,一般为0.12~0.20s。房室传导阻滞时,PR间期延长。PR段指从P波终点到QRS波起点之间的线段,反映去极化通过房室交界、房室束、左右束支及浦肯野纤维网需要的时间,因此时综合电位很小,难以记录,表现为基线水平。QT间期是指QRS波起点到T波终点的时程,代表心室开始兴奋到完全复极的时间。QT间期的长短与心率成反变关系,心率愈快,QT间期愈短。ST段是指从QRS波终点到T波起点的线段,代表心室各部均处于去极化状态,相当于平台期的时程。正常心电图上ST段与基线平齐。
案例
患者男性,43岁,连日加夜班工作后,感觉心悸、头晕和乏力。曾有类似病史。检查发现第一心音强度变化不定、心室律极不规则;正常P波消失,代以大小不等、形态各异的颤动波(f波),心房活动频率约450~600次/min,心室率为150~250次/min。医生用维拉帕米(钙通道阻滞剂)为患者治疗。
诊断:心房颤动。
问题与思考
1.房室结在兴奋传导过程中有何作用?2.患者为何出现心音、心室率和心电图的改变?3.心房纤颤对心室射血有何影响?4.维拉帕米在治疗心房颤动中起何作用?
提示
1.房室结是心脏传导系统中传导速度最慢的部位,有“房室延搁”作用,保证心房收缩时心室得以舒张。除兴奋传导速度缓慢外,房室结的有效不应期较长,在心率加快时,不应期缩短也不明显。因此,对高频率的兴奋具有过滤作用。
2.心房颤动是临床上最常见的心律失常之一,其发生机制可能是心房肌的异位自律性增高或多个小折返激动所致。患者心房率约350~600次/min,而心室率只有150~250次/min,这是因为大部分心房异位点兴奋在下传心室的过程中,由于房室结的过滤而不能传至心室,使心房纤颤时的心室率能保持相对较慢。
3.心房颤动对心室射血的影响主要表现在两个方面:①使心室率过快。尽管有房室结的滤过作用,但因心室率明显快于窦性频率,心动周期缩短使心舒张期缩短,心室充盈量减少,心搏出量急剧减少。②心房不丧失了初级泵功能,使心室充盈量减少30%(本章第二节),亦使心搏出量减少。由于心搏出量减少成为矛盾的主要方面,故患者的心输出量减少,不能满足整体代谢的需要而出现头昏和乏力。
4.心房颤动最初的治疗目的是减慢快速的心室率,恢复窦性频率。房室结是慢反应自律细胞,0期去极化是由于L型Ca2+通道开放,钙内流引起的。维拉帕米能阻滞钙内流,使0期去极化速度减慢和幅度减小,增强房室结的滤过作用,使更多的心房异位点兴奋不能传导至心室,由此使心室率减慢。
心电图的发展历史
心电图(electrocardiogram, ECG)的发明对心脏学领域有着不可估量的影响。它使人们 能观察健康和疾病心脏的结构和功能。ECG 已经是心脏疾病的有力诊断工具,特别是对心 律失常和急性心肌梗死的检查。使用 ECG 已成为心脏护理的标准,并且使用这项技术的新 进展还在不断出现。 心脏电活动的发现可以追朔到 19 世纪 40 年代。在 1842 年,意大利物理学家 Carlo Matteucci 首先报道每次心跳都伴随有电流。很快,德国生理学家 Emil DuBois-Reymond 第 一个描述了伴随肌肉收缩的动作电位。另外,Rudolph yon Koelliker 和 Heinrich Miller 使用 电流计于 1856 年首次记录了心肌动作电位。 接着,Gabriel Lippmann在19世纪70年代早期发明的毛细管电位计引导出了由Augustus D. Waller 记录到的第一个人的心电图。毛细管电位计是一个薄玻璃管,内含置于硫酸上的 水银柱。随着电位变化,水银凸面移动,这可通过显微镜观察到。使用这种毛细管电位计, Waller 第一个观察到心脏的电活动先于机械收缩出现。他也是第一个指出了心脏电活动可通 过将电极放在双手或一只手和一只脚上观察到,这也是肢导联的首次描述。有趣的是,Waller 经常和他的狗 Jimmy 一起公开示范这一结果,在记录心电图时 Jimmy 需要站在装有盐水的 瓶中。 心电图学的下一个主要突破是 Willem Einthoven 在 1901 年发明的弦线电流计。次年, 他报道了使用他的弦线电流计记录的第一个心电图。Einthoven 的弦线电流计是由一个巨大 的电磁铁和穿过其中的一根薄的、镀银的弦线所组成。通过弦线的电流使它可以从电磁铁产 生的磁场的一边移动到另一边。弦线的振荡可提供信息以记录电流的强度和方向。弦线的偏 转通过投影显微镜放大并被一个活动照相板记录下来。几年前,通过使用毛细管电位计记录 到的结果,Einthoven 也是第一个将心脏电活动标记为 P、Q、R、S 和 T 段的人。 1912 年,Einthoven 为电生理领域做出的又一重大贡献是推导出三个肢导联记录的波的 方向和大小之间的数学关系。这一假说被称为 Einthoven 三角。在 Frank Wilson 使用单电极 导联和胸导联之前,Einthoven 的标准 3 种肢导联被使用了 30 多年。现在使用的 12 导联 ECG 形式包括 Einthoven 的标准肢导联和基于 Wilson 的成果的单电极导联和胸导联。 在 Einthoven 发明弦线电流计之后,心电图迅速成为生理学家和心脏病学家的研究手段。 很多目前关于心律失常的知识是通过使用 ECG 发展起来的。1906 年,Einthoven 首先发表 了狗的房颤、房扑、室性早搏,室性二联律,心房扩大和诱导的心脏传导阻滞的 ECG 结果。 因为他的工作和发明,Einthoven 获得了 1924 年的诺贝尔奖。 Thomas Lewis 是先驱心脏病学家之一,他应用 ECG 推动了心率失常的科学知识。他的 发现被总结在他 1911 和 1912 出版的《心跳机制及其临床疾病》一书中。他还发表了超过 100 篇研究论文。而且,Lewis 还是第一个使用窦房结、起搏点、期前收缩,阵发性心动过 速和心房纤颤等名词的人。 心肌梗死和心绞痛也用弦线电流计装置通过 ECG 得到广泛研究。很多临床研究者在人 和动物身上发现了 ECG 信号的改变和心肌梗死发作有关。到 20 世纪 30 年代,心肌梗死的 特征性心电图诊断指征已被确定。随后,心绞痛和冠状动脉闭塞之间的联系也被确定。在研究心绞痛的心电图改变的时候,Francis Wood 和 Charles Wolferth 第一个使用了运动心电图 压力测试,并对病人生理状态下发生心绞痛的 ECG 进行分析,得到了有价值的数据。由于 当时此项技术被视为非常危险而未常规使用,但随着方法和技术的成熟,心电图已经逐渐成 为内科医生的常用诊断工具。
NO 的发现历程
NO 的发现历程颇为曲折有趣,最初是从看起来与 NO 毫不相干的血管活性物质——乙 酰胆碱对血管的舒缩作用而逐渐深入的。 1953 年 Furchgott 等发表了首篇乙酰胆碱(acetylcholine, ACh)和组胺致兔离体血管条 收缩的论文。当时公认的观点是 ACh 可使血管舒张,因此他的观点颇受争议。ACh 究竟是 引发血管舒张还是收缩?这一问题在当时悬而未决。直到 1978 年,一次偶然的事件才使这 一问题得到澄清。Furchgott 的实验室技术员 David 在进行血管条实验时,由于粗心大意, 他没有按照实验要求制备螺旋血管条,而制备的是主动脉环,结果他发现,ACh 不但不使 主动脉环收缩,反而诱发其舒张。Furchgott 注意到了这一实验现象,并仔细检查了 David 的各项实验步骤,推测螺旋血管条和主动脉环这两种标本制备方法的不同可能是造成血管反 应性差异的原因。于是他把对 ACh 呈舒张反应的主动脉环取出,重新制作成螺旋血管条, 此时他注意到,在标本制备的过程中,血管内膜面受摩擦很少的血管条往往对 ACh 呈明显 舒张反应,而受摩擦较多的血管条对 ACh 无舒张或呈收缩反应。随后,他们在标本制备时 尽量使血管内膜保持完好,结果发现,血管条对 ACh 呈良好的舒张反应。这一现象提示, 内膜的损害与否可能导致血管对 ACh 的反应性不同。采用组织染色的方法,Furchgott 进一 步发现对 ACh 无舒张或呈收缩反应的血管条不含血管内皮细胞,而对 ACh 呈舒张反应的血 管条则具备有血管内皮细胞。这些结果表明,血管条对 ACh 舒张与否的关键是血管内皮细 胞的有无。那么,内皮细胞诱导血管舒张的可能机制是什么呢? Furchgott 设计了精妙的实验,来解决上述问题。先将去除内皮的横向血管条与保留内 皮的纵向血管条并列挂在同一浴槽中,使其内膜面相对靠近,在加用 ACh 后立即移除保留 内皮的纵向血管条,去除内皮的血管条也会出现舒张。实验结果提示,ACh 刺激血管内皮 细胞释放某种物质,导致血管舒张。他将这个物质命名为内皮细胞舒张因子 (endothelium-derived relaxing factor, EDRF)。他的发现引起众多研究者的关注,他们开始致 力于探讨 EDRF 的本质。
Murad 于 1977 年发现,硝酸甘油类物质舒张血管的作用是通过释放 NO 来实现的。NO 可激活平滑肌细胞上的鸟苷酸环化酶,进而产生 cGMP,后者使肌凝蛋白轻链去磷酸化,引 起血管平滑肌舒张。1986 年,Ignarro 收集了 ACh 刺激主动脉血管环后所保存下来的培养液 (内含 EDRF),观察发现该培养液可活化 GC,当在培养液中加入各种氧化、还原及抗氧化 剂时,可影响其对腺苷酸环化酶的活化程度。其结果与 Murad 的理论相符,他进一步测量 了培养液中的NO含量,发现NO的产生量与GC的活化程度成正比,因此他大胆推测,EDRF 就是 NO。 Moncada 以“瀑布式淋浴”的方法在 1987 年证实 EDRF 的化学本质为 NO。在该实验 中,他们将培养的血管内皮细胞铺附于微载体上,然后将微载体装柱并以 Krebs 液洗脱,流 出液瀑布式淋浴去内皮细胞的兔胸主动脉血管条,同时检测流出液中 NO 的含量,并将流出 液与硝酸甘油的药理作用做定量对比,结果发现,由缓激肽诱导的血管内皮细胞释放的 EDRF 与 NO 在生物活性、半衰期等生物学特性上完全一致。现已证实,多种刺激均可促进 内皮细胞合成和释放 NO,促进血管舒张。 《Science》杂志在 1992 年将 NO 评为年度明星分子,并 发表一篇被冠以有趣标题“NO NEWS IS GOOD NEWS”的专论,以强调这一研究领域的重要性和新颖性。Robert F. Furchgott,Ferid Murad 和 Louis J Ignarro 因在 NO 的发现中所做的贡献在 1998 年共同获得 诺贝尔生理学和医学奖。目前国际上有关 NO 的研究跨入一个迅猛的阶段,已渗入到众多学 科,成为生物医学领域研究的热点和前沿之一。
特殊环境中的心血管系统的生理变化
一、高 原
低氧是高原病的主要致病因素。急性低氧可强烈兴奋交感神经,抑制副交感神经。自主 神经系统可感受低氧,并通过心率加快,通气量和心输出量增大,以及儿茶酚胺水平增加等 对急性低氧产生反应。在急性低压低氧时,机体最初的代偿活动是通过血液浓缩和心输出量 增加,以提高组织的氧含量。 通过血液浓缩可增加每单位血液中血红蛋白含量,增加携O2能力。低氧时血液浓缩主 要的机制有:低氧的利尿反应、低氧诱导促红细胞生成和过度换气引起的不感性水分流失。
通过心输出量增加以应对急性低压低氧。其机制是血液浓缩增加了血液中儿茶酚胺水 平,导致心率增加。假如适应的时间足够长,心率的增加足以克服由血液浓缩和肺小动脉收 缩所致的血管阻力增加所诱发的每搏输出量的降低。 低氧时肺小动脉收缩可能是一种适应机制,在心输出量增加时,通过肺小动脉收缩避免 压力和血流量增高以保护肺血管;但它也可能在不良适应时,在高原肺水肿发展中发挥了重 要的作用。
二、潜 水
从实验及观察中发现,人在进行屏气潜水(breath-hold diving)活动时,当面部开始浸 在水中时,心跳便开始减慢;在水中进行潜水活动时,心跳减慢将更明显。可能原因是由于 外部压力增大,机体尤其是下肢静脉血液大部分回流到胸腔中而引起的。但即使不在潜水时, 如在潜水减压病治疗过程中,复压舱(recompression chamber)内病患者同样也会出现心跳 减慢,可能与N2分压过高刺激迷走神经有关。 潜水活动时身体浸在水中,由于有水压的关系,加上身体穿着有弹性的保护胶衣,会使 躯干及下肢的大部分静脉血液回流向心脏,偏低的水温也会刺激血管收缩。这些因素会引发 利尿作用、产生血液浓缩等反应,甚至会引起血液过度浓缩或者出现脱水。如果长期进行高 氧潜水运动,过高O2分压会抑制血液红细胞生成。
三、失 重
心血管功能改变。失重时人体的流体静水压丧失,血液和其他体液不像重力条件下那样 惯常地流向下身。相反,下身的血液回流到胸腔、头部,航天员面部浮肿,头胀,颈部静脉 曲张,身体质量重心上移。人体的感受器感到体液增加,机体通过体液调节系统减少体液, 出现体液转移反射性多尿,导致水盐从尿中排出,血容量减少;出现心血管功能降低征候群, 如心输出量减少、立位耐力降低等,返回地面后短时对重力不适应。 随着航天的时间延长,心血管功能可在新的水平上达到新的平衡,心率、血压、运动耐 力恢复到飞行前水平。失重引起血容量减少的同时可出现血红细胞、血红蛋白量的减少,这 些随着航天时间的延长逐渐恢复正常。
教你看懂心电图


