一、静息电位
(一)静息电位的记录和数值
静息电位是指细胞处于安静状态时,存在于细胞膜内外两侧的电位差。使用电生理学仪器测试细胞膜两侧的电压情况,记录到的电位是以膜外为零电位时的膜内电位。测试结果发现膜内的电位较膜外低,由于膜外的电位已经归零,因此记录到的静息电位为负值。不同细胞的静息电位不等,如骨骼肌细胞的静息电位大约-90mV,神经细胞约-70mV,红细胞约-10mV等。上述现象说明静息情况下,细胞膜两侧存在着电位差,即细胞膜外电位高,带正电荷;膜内电位低,带负电荷,一般将这种情况就称为“外正内负”。安静情况下细胞膜内外两侧这种外正内负的电荷不均匀分布状态又被称为“极化”或极化状态。与静息电位相比,如果膜电位减小,例如骨骼肌细胞静息电位从-90mV减小到-80mV,就称为去极化,意味着膜两侧的极化减弱;与静息电位相比,如果膜电位增大,如静息电位从-90mV降低至-100mV,则称为超极化;细胞去极化到达零电位后如进一步变化为“外负内正”,则称为反极化;细胞膜电位发生反极化时,膜内电位高出0mV的部分被称为超射;细胞膜去极化结束后,膜电位向静息电位恢复的过程称为复极化。
(二)静息电位产生的机制
跨膜的静息电位实质上是在膜的内、外各附着着一层电荷。这一现象产生的原因是由于:1. 钠泵的作用。钠泵的主动转运导致细胞膜内外两侧存在着Na+、K+离子的浓度差。哺乳类动物的骨骼肌细胞,膜内K+的浓度约为胞外的30倍;而膜外Na+的浓度约为胞内的12倍左右。2. 安静情况下细胞膜对不同离子的通透性不同。机体内的大多数细胞在安静情况下,主要对于钾离子具有较高的通透性。由于安静情况下细胞膜几乎只对K+具有通透性,K+就会在浓度差的驱动下通过钾通道向膜外扩散,在膜外形成一层正电荷;膜内主要的负离子是蛋白质阴离子,而细胞膜对于膜内带负电荷的蛋白质阴离子几乎不通透。在K+外流后,膜内的蛋白质阴离子相对过剩从而在膜内形成了一层负电荷,故而在膜的两侧出现了电位差。这种由于K+外流形成的电位差会以电场力的方式阻止K+的继续外流,当电位差构成的电场阻力和K+浓度差构成的驱使K+外流的浓度力大小相等时,即K+的电–化学驱动力为零时,K+的净移动为零,膜电位不再改变,此时膜两侧的电位差即为K+平衡电位。
而实际测得的细胞膜静息电位与K+平衡电位接近,但略小,其原因在于细胞膜在安静情况下,除了主要对K+具有通透性之外,其实对于Na+也具有一定的通透性(Na+内流)。
二、动作电位
(一)动作电位的概念
动作电位是指细胞受到适宜的刺激时在静息电位的基础上产生的快速并可传导的电位变化。与静息电位比较,动作电位是膜电位的一个连续变化的过程;而静息电位是细胞膜两侧存在着电位差的一种状态,即极化状态。动作电位一经产生,就会向周围迅速传播。电生理学中,把细胞产生动作电位定义为兴奋或电兴奋,因此,可以把动作电位的产生看做为细胞兴奋的标志。
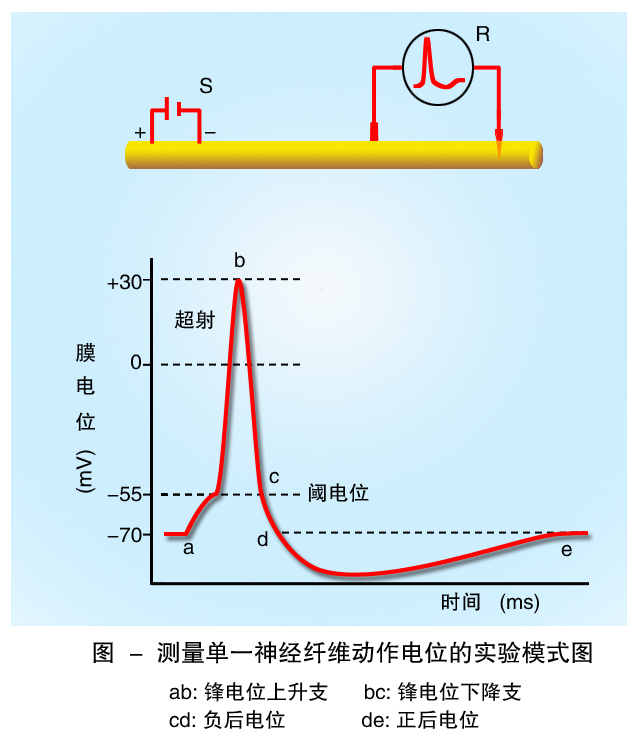
所有活的细胞都有静息电位,但只有神经细胞、肌细胞和腺体细胞可以产生动作电位,称为可兴奋细胞。不同细胞的动作电位形态特征不同,例如神经细胞的动作电位时程很短,而心室肌细胞的动作电位的时程就非常长。如图所示,当神经细胞受到适当刺激时,首先是膜内电位开始快速升高,由-70mV去极化到+30mV,形成动作电位的上升支;随后又迅速复极化到静息电位水平,形成动作电位的下降支。快速除极的上升支和快速复极化的下降支共同形成了外观上尖锋状的电位变化,称为锋电位,锋电位可以作为动作电位产生的标志。锋电位之后膜电位变化速度相对较慢的部分称为后电位。后电位也由两个部分组成,即膜电位尚未完全复极化到静息电位水平的部分,称为后去极化或者负后电位;另一部分是膜电位在复极化过程中,电位水平超过静息电位的电位,称为后超极化或正后电位。位是指细胞受到适宜的刺激时在静息电位的基础上产生的快速并可传导的电位变化。与静息电位比较,动作电位是膜电位的一个连续变化的过程;而静息电位是细胞膜两侧存在着电位差的一种状态,即极化状态。动作电位一经产生,就会向周围迅速传播。电生理学中,把细胞产生动作电位定义为兴奋或电兴奋,因此,可以把动作电位的产生看做为细胞兴奋的标志。
动作电位具有以下三个特征:
1. “全”或“无”特性 即一个可兴奋细胞要么因刺激过弱而不产生动作电位,而一旦刺激达到一定强度即可产生动作电位,此时其产生的动作电位的幅度也就达到最大,不随刺激强度的变化而发生改变。
2. 不衰减的传导 动作电位一旦在细胞膜的某处产生后,就会沿着细胞膜向两侧传播,在传播过程中,动作电位的幅度大小不随传播距离的延长而减小。
3. 脉冲式发生 无论刺激的频率如何改变,动作电位的锋电位部分不会发生重叠的特征。因而细胞接受连续刺激后,连续发生的动作电位各自都具有完整锋电位特征,故呈脉冲样。
(二)动作电位产生的机制
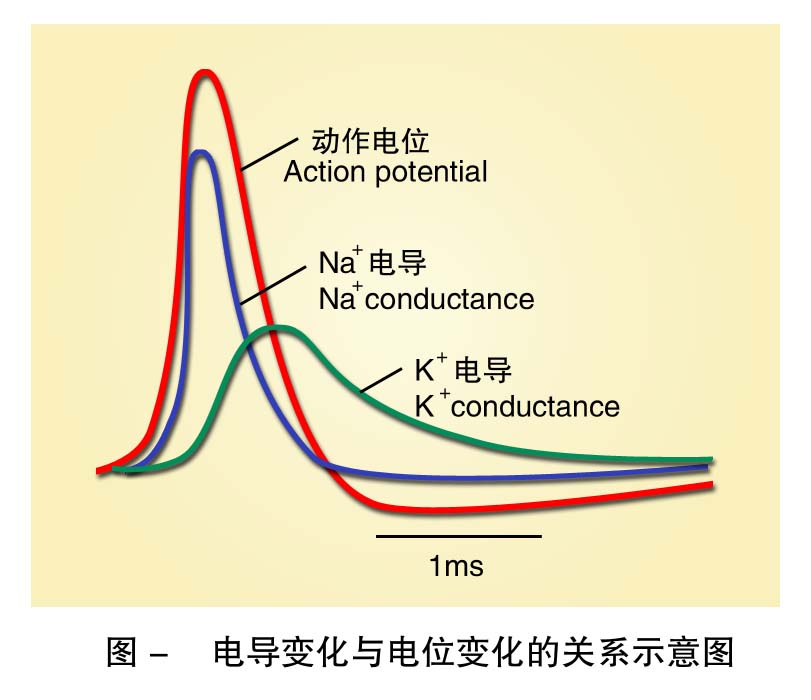
只有能引发细胞膜产生去极化的刺激才可能诱发细胞产生动作电位。膜的去极化可以引起刺激局部细胞膜上钠通道开放,Na+内流。刺激强度越大,其引起细胞膜发生去极化的程度越高,开放的钠通道数目越多,引起的Na+内流也越强。膜进一步去极化,可以导致更多的钠通道开放和Na+内流,膜内正电荷进一步积聚而形成正反馈,最终使刺激部位所有的钠通道全部开放,大量Na+内流而形成一个快速向上的去极化支。这个过程中,刚好可以使膜去极化到某一电位水平,此时,Na+通道大量开放,这一临界的膜电位水平称为阈电位。阈刺激和阈上刺激可使膜去极化至阈电位或以上,故爆发动作电位,阈下刺激不能使膜去极化至阈电位,故只能产生局部电位,正是由于这个原因,动作电位的产生才是“全或无”的。Na+通道是一具有双闸门(激活门和失活门)的通道,去极化引起通道激活开放一定时间后(1ms)后,失活门关闭而开始失活,Na+通透性再次降低,Na+内流停止。此时,因K+通透性再次占据上风,在电化学驱动力驱使下,K+快速外流至恢复静息电位,产生动作电位的复极化支。复极化的晚期复极化变慢,延续为负后电位,达到静息电位后,钠泵的活动短时间处于加强状态,膜发生超极化而为正后电位。
(三)动作电位的传导
动作电位在同一细胞膜的扩布称为动作电位的传导。动作电位一旦在细胞膜的某处产生,即会沿细胞膜向周围不衰减的传导,直到整个细胞膜都兴奋一次。
动作电位在细胞膜上的传导是以局部电流的形式进行的。如在无髓的神经纤维上神经冲动的传导,当某处产生动作电位时,兴奋部位细胞膜的膜电位由静息电位时的外正内负变为了反极化的外负内正状态。于是,在膜外产生了从未兴奋部位向兴奋部位流动的电流,膜内也同样产生了电流,方向正好与膜外相反。电荷流动的结果导致了未兴奋部位细胞膜的膜内电位负值减小,于是发生了去极化(此种过程循环进行,于是动作电位迅速的向周围传播,直到整个细胞兴奋一次。在动作电位传播的过程中,并没有方向的限制。假如神经纤维的外周部分先兴奋,则向中枢方向传播;反之,则同样可以向外周部分传播。由于动作电位的传播是以不断爆发的新的动作电位来传递的,因而是不衰减的,与局部电位不同。
与无髓神经纤维传播的方式不同,在有髓纤维上动作电位的传播,由于髓鞘的绝缘作用,局部电流只能发生在无髓鞘包绕的郎飞氏结处,故动作电位的传播是直接从一个郎飞氏结到下一个的,称为跳跃式传播(图2-9)。和无髓纤维比较,有髓纤维跳跃式传导的速度要快很多。有髓纤维如人体内的A类纤维传导速度可达到70~120m/s,而无髓纤维的传导速度仅0.2~0.6m/s。此外,由于有髓纤维在动作电位的传导过程中,仅在郎飞氏结处产生局部电流,与无髓纤维比较,发生跨膜流动的电荷要少很多,因此动作电位过后需要由钠泵通过主动转运恢复膜两侧离子平衡时消耗的能量就会大大减少,所以,跳跃式传导不仅使得传导速度大大加快,而且极大地减少了能量的消耗。
钠通道基因缺陷与人类疾病
电压门控钠通道的作用是触发细胞产生动作电位的去极相,并由此引起钙通道和钾通道 的开放。Ca2+进入细胞内可引起肌肉收缩、神经递质释放或产生其他调节作用,K+流出细胞 则形成了动作电位的复极化。因此,钠通道在维持细胞兴奋性和正常生理功能上起着重要的 作用。电压门控钠通道由α、β1 和β2 三个亚单位组成,其中α亚单位是形成通道孔道的亚单 位,β1和β2 属于调节亚单位。 α亚单位含有四个结构域,每个结构域含有 6个跨膜α螺旋( S1~ S6)。其中,S4 是通道的电压传感器,可感受膜电位的改变,进而引起通道开放;S5 和S6 之间的胞外环向内折叠构成通道的内壁,与通道开放时选择性通过Na+有关;第Ⅲ和第Ⅳ结 构域之间的胞内环上第 1489 位的苯丙氨酸残基和它两侧的异亮氨酸残基与甲硫氨酸残基是 引起通道失活的关键结构。目前至少已克隆出十多种类型的钠通道,广泛分布于可兴奋细胞 中。例如,中枢和外周神经系统主要是基因SCN1A编码的NaV1.1、SCN2A编码的NaV1.2 和 SCN3A编码的NaV1.3 钠通道;骨骼肌是SCN4A编码的NaV1.4 钠通道;心肌的钠通道则是由 SCN5A编码的NaV1.5。钠通道基因缺陷引起的人类疾病主要有以下几种。
1.遗传性长QT综合征 遗传性长QT综合征(long QT syndrome, LQTS)是因编码离子 通道蛋白的基因突变导致心肌细胞膜离子通道功能障碍而引起的一组临床综合征。LQTS与 钠通道和钾通道基因突变有关。LQTS并不常见,但该病发病突然、猝死率高、多以青少年 受累为多见。心电图上显示QT间期(心肌细胞的动作电位持续时间)延长,易产生室性心 律失常,尤其是尖端扭转性室性心动过速。病人表现为心慌、晕厥、抽搐甚至猝死。遗传性 LQTS被Jervell首先描述于 1957 年。以后证实,多个基因与遗传性LQTS有关。Ⅰ型和Ⅱ型 LQTS是编码钾通道的基因KCNQ1 和KCNH2 突变所致。KCNQ1 基因编码KVLQT1 蛋白,即 缓慢激活的延迟整流钾通道(IKs)的 α亚单位;KCNH2 编码快速激活的延迟整流钾通道(IKr) 的α亚基。 IKs和IKr都参与心肌动作电位的复极化, IKr是心室肌细胞动作电位复极期中的主要 外向电流 。 KCNQ1 和KCNH2 基因突变引起延迟整流钾通道α亚单位功能受损,钾外流显著 减少,从而延长动作电位时间,心电图上表现为QT延长。Ⅲ型LQTS则是由编码钠通道的基 因突变引起的。心肌钠通道α亚基( SCN5A)基因位于第 3 号染色体。已经发现,LQTS的SCN5A 突变数有 50 多个。与Ⅰ型和Ⅱ型LQTS中钾通道基因突变效应不同的是,钠通道SCN5A基因 变异不引起通道功能的缺失和减退,而是功能增加。例如,钠通道基因的一种突变类型是α 亚单位第Ⅲ和第Ⅳ结构域之间的胞内环上 1505~1507 位置上缺失了赖氨酸(K)、脯氨酸( P) 和谷氨酸(Q)三个氨基酸残基(称为△KPQ),这三个氨基酸残基的缺失可使突变的钠通道 失活不完全,以致通道反复开放,而产生所谓的持续或晚Na+电流,这使得心肌动作电位平 台期内向电流持续增加,复极时间和动作电位持续时间(QT间期)延长。心肌细胞内Na+的 增高,可通过Na+-Ca2+交换途径导致细胞内钙超载,从而出现过度的收缩和激活凋亡通路, 引起细胞死亡。
2.癫痫和伴高热的全面发作型癫痫 癫痫与钠通道基因突变有关。电压门控钠通道β1 亚单位的基因SCN1B突变可引起β亚单位上的一个氨基酸发生改变,这使钠通道开关速率变 慢,去极化时间延长,从而导致神经元持久和过度的兴奋,引发癫痫。伴高热的全面发作型 癫痫也在电压门控钠通道的SCN1B和 SCN1A基因上发现有突变。
3.高钾周期性瘫痪和先天性副肌强直 这两种疾病也与钠通道基因突变有关。骨骼肌 电压门控钠通道SCN4A基因位于人类 17 号染色体,SCN4A的突变可引起高钾周期性瘫痪 (hyperkalemic periodic paralysis)(又称遗传性发作性肌无力症)和 先天性副肌强直 (paramyotonia congenita)。其中,高血钾性周期性麻痹可由骨骼肌SCN4A结构域Ⅱ上的S5 和结构域Ⅳ上的S6 上发生的错义突变所引起。该疾病由血钾水平增高所触发,可在剧烈活 动后或摄入富含钾的食物后发生。患者表现为 反复 发作性 肌无力、肌肉松弛性瘫痪、腱 反射消失,补充钾后加重,补钙后常缓解,肌肉对电刺激不起反应。先天性副肌强直 可 由结构域Ⅳ上的S3 和S4 或连接结构域Ⅲ和Ⅳ的细胞内环上的突变所引起,该细胞内环在钠 通道的失活中起重要作用。该疾病可由寒冷引起,发作时肌肉动作电位可重复发放,出现异 常的肌强直。到目前为止,已报道肌肉钠通道存在 20 多种错义突变,影响α亚单位。
钙通道与神经肌肉疾病
钙通道包括细胞膜中的钙进入通道和细胞器膜中的钙释放通道。钙进入通道介导细胞外 Ca2+进入细胞胞质,如电压门钙通道(voltage-gated calcium channels, VGC)、NMDA受体 通道等;钙释放通道使细胞器内储存的Ca2+释放到胞质,如肌细胞的肌质网膜中的ryanodine 受体(RYR)以及三磷酸肌醇受体(IP3R)等。有趣的是,细胞膜中的某些电压门控钙通道 并不介导细胞外Ca2+的内流,如骨骼肌细胞发生兴奋-收缩耦联部位横管膜中的电压门控L型 钙通道,就只是作为一个电压变化的信号传递分子将细胞膜去极化的信息传递给胞质内肌质 网膜中的钙释放通道而发挥作用的,其本身并不作为离子通道产生Ca2+内流,因此骨骼肌的 收缩不依赖于细胞外的Ca2+内流。相反,心肌细胞横管膜中的电压门控L型钙通道在去极化 时有相当数量的Ca2+内流,这些内流的Ca2+可激活胞质内肌质网膜中的钙释放通道,因而心 肌的收缩有赖于细胞外的Ca2+内流。一种发生在小鼠骨骼肌膜中的钙通道突变细胞模型可用 来证实以上理论。这些小鼠的骨骼肌先天性缺乏功能性的钙通道,因而肌肉丧失收缩功能, 出生后的小鼠不久便死于呼吸衰竭。如果在小鼠这些缺乏钙通道的骨骼肌细胞内人为地表达 骨骼肌电压门控L型钙通道(Cav1.1),丧失了收缩功能的细胞便可恢复收缩功能而不依赖 细胞外的Ca2+;如果在这些细胞内表达心肌的电压门控L型钙通道(Cav1.2),则恢复的收 缩功能需要依赖细胞外的Ca2+。钙通道的异常与人类许多遗传缺陷和自身免疫性疾病的发生 有关。
1.家族性低钾性周期性麻痹 家族性低钾性周期性麻痹(familial hypokalemic periodic paralysis, FHypoPP)是一种人类常染色体显性遗传病。FHypoPP 于儿童或成年早期发病, 表现为发作性躯干和肢体无力,通常不累及呼吸肌和心肌。研究发现,FHypoPP 的家族成 员在编码骨骼肌电压门控 L型钙通道(Cav1.1)的 CACNA1S 基因上有一个点突变,位于通 道蛋白结构域Ⅱ的 S4 跨膜段上。这种突变可通过干扰去极化信号传递给肌质网膜中 RYR 而使骨骼肌的兴奋与收缩之间脱耦联。该病发作时常伴血清钾降低,补钾治疗有效,但该病 的发作性和低钾现象尚无法解释。自 1994 年 Ptacek 等发现 FHypoPP 是编码钙离子通道基因 的突变至今,FHypoPP 已成为临床最常见的科学家们公认的骨骼肌离子通道病。
2.家族性 偏瘫 型偏头痛 家族性 偏瘫 型偏头痛(familial hemiplegic migraine, FHM) 是一种显性遗传综合征,表现为严重的头痛,并伴有运动障碍。发作通常始于儿童期或青春 期,典型者为短暂性偏瘫,持续数小时至数天,但有时可呈持续性。研究表明,这种遗传缺 陷是由于编码人类P/Q型电压门控钙通道(Cav2.1)的CACNA1A基因发生多处点突变所致, 突变的位置包括结构域Ⅰ的S4 区,结构域Ⅱ的P区以及结构域Ⅰ和Ⅳ的S6 螺旋。这些突变 可能通过改变电压敏感性、离子选择性或通道失活特性影响通道功能。P/Q型通道功能损害 所致的 5-羟色胺释放减少,可能与偏瘫型偏头痛发病有关。
3.发作性共济失调 2 型 发作性共济失调 2 型(episodic ataxia type 2)是常染色体显 性遗传病,表现为运动共济失调、眼颤和眩晕,可呈进行性。患者常见小脑萎缩。儿童后期 或青春期发病,常因应激、运动或疲劳诱发,持续数小时至数天。本病与 FHM 属于同一基 因 CACNL1A 突变,移码和拼接位点突变可导致过早终止,产生截短和无功能性通道。突变 严重者表现失神发作、严重的共济失调和早亡。
13
4.Lambert-Eaton肌无力综合征 Lambert-Eaton肌无力综合征(Lambert-Eaton myasthenic syndrome, LEMS)是一种累及神经-肌肉接头突触前膜电压门控钙离子通道的 自身免疫性疾病。该病较为罕见,易发人群为中老年,青少年偶有累及,主要表现为进 行性肌无力、腱反射减弱和消失,但通常不累及呼吸肌和面部表情肌。研究证实,LEMS 患者体内存在有抗突触前P/Q型钙通道的自身抗体。P/Q型钙通道是神经肌肉接头处引起神 经末梢释放ACh的主要通道。自身抗体与P/Q型钙通道发生的免疫反应可致神经末梢钙通道 损伤,从而使去极化引起的钙内流减少、神经递质乙酰胆碱释放减少。多数LEMS患者伴有 某些类型的癌症,特别是小细胞 肺癌 。因此,有人分析抗突触前钙通道的自身抗体很可能 原本是针对肿瘤细胞上钙通道决定簇的。LEMS有别于重症肌无力(myasthenia gravis, MG), 后者虽然也是自身免疫性疾病,但其产生的自身抗体不是针对突触前的钙通道,而是特 异性损伤突触后终板膜中的胆碱能受体通道。MG通常会在频繁活动后加重,而LEMS在 频繁活动时常会得到缓解。





