思政元素:锂电池、光伏发电等,引导学生思考科技创新与资源安全。
一、内容分析
本节包括两部分内容:氧化还原反应,氧化剂和还原剂。
教材首先设置了“思考与讨论”,以初中学过的两个化学反应为载体,引导学生从三个方面(①得氧物质、失氧物质及其发生的反应,②反应前后元素化合价的变化情况,③氧化反应或还原反应与元素化合价升降的关系)进行分析,在此基础上,得出氧化还原反应的概念,并将物质发生氧化反应或还原反应与元素化合价升降联系起来。
然后,教材以铁与硫酸铜的反应为例,将氧化还原反应的内涵从得氧、失氧扩展到反应前后有元素化合价发生变化,并说明元素化合价发生变化是氧化还原反应的重要特征。
最后,教材从微观角度引导学生认识氧化还原反应的本质,这是本节的重点内容。教材以钠与氯气、氢气与氯气的反应为例,从原子结构的角度讨论氧化还原反应中电子得失、共用电子对偏移的情况,引导学生认识氧化还原反应中一定的存在着电子转移,从而形成认识氧化还原反应的微观视角。同时,教材给出4种基本类型的反应与氧化还原反应的关系示意图,将依据不同标准对化学反应进行分类有机的联系在一起,起到了帮助学生巩固概念和提高认识的作用。
在认识氧化还原反应本质的基础上,教材从电子转移的角度定义氧化剂和还原剂,并以氧化铜与氢气、钠与氯气的反应为例,说明氧化剂和还原剂的关系,同时介绍了中学化学中常用的氧化剂和还原剂等。随后,教材安排了“思考与讨论”,以汽车尾气系统的催化转化器中发生的化学反应为例,引导学生从科学·技术·社会·环境(STSE)视角感受氧化还原反应的社会价值,形成“绿色化学”的理念,增强社会责任感。
本节内容的特点是概念多、抽象,理论性强。在呈现方式上,教材一方面注意初、高中的衔接,结合具体的化学反应实例,以氧化还原反应概念的发展过程为线索,即“得氧、失氧→元素化合价升降→电子转移”,从宏观视角(元素)到微观视角(电子),由表及里,环环相扣,逐步揭示氧化还原反应的本质,引导学生建构氧化还原反应的认识模型。另一方面,充分发挥氧化还原反应的社会价值,引导学生从化学的视角分析和解决实际问题,体会化学对人类文明和社会发展的促进作用。
二、教学目标
1.教学目标
(1) 通过对化合价的分析,认识氧化还原反应的规律,并对常见化学反应进行分类。
(2) 基于化合价变化与电子转移的相关性,从微观上认识氧化还原反应的本质,能对其进行分析。
(3) 能利用氧化还原反应概念判断物质的氧化性和还原性,归纳常见的氧化剂和还原剂。
2.教学重点和难点
重点:氧化还原反应相关概念。
难点:氧化还原反应相关概念间的联系。
三、教学建议
1. 关注氧化还原反应概念的形成过程,揭示反应分类的意义
对氧化还原反应的认识角度从得氧、失氧转变为化合价升降,这一转变对学生而言“来得并 不那么自然”,只有阐明从化合价角度认识化学反应的意义,才能揭示这一转变的意义:某些反 应如果具有相同特点(例如变价)就会表现出一定的规律,掌握这些规律就能更好理解、把握和
控制这类化学反应。活动建议如下。
活动一 根据化学方程式分析给定化学反应的共同特点,尝试分类。教师需适时引导学生关注反应中元素化合价的变化。
教师提供4类“有意义”的化学反应的化学方程式各2~3个,包括:①学生较熟悉的,②用4个基本反应类型无法归类的,③工业生产中涉及的,④较复杂的,等等。
活动二 根据所给信息,解释几种金属与水反应的差异。
教师提供:①Li、Na、K、Rb 等金属与水反应的实验现象(真实实验或视频),②4种金属原子结构示意图和原子半径数据。
期待结论:①4种金属都具有给出电子的倾向,即还原性;②4种金属还原性的不同可以由
原子结构(半径)解释;③研究物质氧化性、还原性强弱对认识氧化还原反应的规律是有意义的。
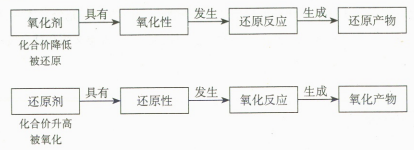
2. 适时归纳氧化还原反应相关概念间的联系
建立氧化还原反应相关概念之间的联系难度较大,可以用框图等方式加以总结,降低学习难度。例如下图所示。
3. 关注对物质氧化性和还原性的认识
物质的氧化性、还原性是比较复杂的问题,教学中应该注意以下几点。
(1)元素处于最高价只具有氧化性,处于最低价只具有还原性,处于中间价态既具有氧化 性,又具有还原性。然而,化合价只能判断氧化性、还原性的有无,无法判断其强弱。
(2)按照物质类别,常见氧化剂有:部分非金属单质(F₂ 、Cl₂ 、Br2 、O₂等),部分含最高 价元素的物质(HNO₃ 、浓硫酸、KMnO₄等),部分中间价态物质 [HClO 、H₂O₂ 、Ca(C1O)₂等]。
常见还原剂有:金属单质(金属活动性顺序),部分非金属单质(C 、S 、P 、H₂ 等),含最 低价元素的物质(HI 、H₂S 、NH₃等),其他(CO 、NO 、H₂O₂ 等)。
(3)决定物质氧化性、还原性强弱的因素是反应过程中电子转移的难易,而非电子转移数的 多少。例如,Na 、Mg 、Al作为还原剂,电子转移数依次增多,但还原性依次减弱。
4. 组织专题性活动
专题性活动可以帮助学生进一步理解概念,在解决综合问题的过程中实现知识的整合与结构 化。可设计开展的活动很多,例如氧化还原反应本质探究,过氧化氢氧化性、还原性的研究,日 常生活中的氧化还原反应等。下例是过氧化氢氧化性、还原性的研究。
题目:过氧化氢氧化性、还原性的研究
(1)氧化性、还原性的预测
(2)实验验证
①还原性的验证
实验目的:验证过氧化氢具有还原性。
实验用品:过氧化氢溶液、高锰酸钾溶液、稀硫酸、稀氢氧化钠溶液;试管、胶头滴管。 实验操作与现象:
1 | 在三支试管中分别加入2mL高锰酸钾溶液 | ||
2 | 向试管①中滴加5滴稀硫酸酸化 | 试管②不做处理 | 向试管③中滴加5滴稀氢氧 化钠溶液碱化 |
3 | 向三支试管中分别滴加5滴过氧化氢溶液,振荡并观察现象 | ||
现象 | |||
结论::
②氧化性的验证
请模仿验证过氧化氢还原性的实验设计,选择合适的试剂设计实验方案。
结论: (3)总结归纳(略)
四、栏目使用建议
【思考与讨论1】
(1)教材中的表格应填写如下。
反应物 | 发生的反应(氧化反应或还原反应) | |
得氧物质 | C CO | 氧化反应 |
失氧物质 | CuO Fe₂O₃ | 还原反应 |
(2)各物质所含元素化合价及其变化过程应标注如下。
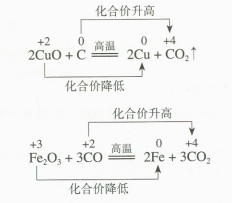
(3)物质发生氧化反应时,相应元素化合价升高;物质发生还原反应时,相应元素化合价降低。
【思考与讨论2]
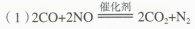
(2)是氧化还原反应,氧化剂为NO, 还原剂为CO。
(3)NO 、CO 均有毒,二者在催化剂作用下发生氧化还原反应,生成的产物N₂和CO₂ 都是无
毒物质,从而减少了汽车尾气排放所造成的空气污染。


