思政元素:科学家精神(屠呦呦与青蒿素的故事)。
一、内容分析
乙醇与乙酸是人类较早发现、制备和应用的有机化合物,在生活和生产中的用途广泛,学生十分熟悉;二者也是醇类和羧酸这两类烃的含氧衍生物的典型代表。教材在第二节介绍了乙烯,反应产物中涉及卤代烃,学生已经初步接触了含有官能团的有机物。本节在此基础上,结合乙醇的实例给出官能团的概念,让学生从结构的角度理解决定有机物分类与化学性质的特征基团,并从官能团转化和物质类别变化的角度认识有机物之间的转化,初步认识有机合成。同时,教材在本节最后结合官能团的作用,从结构和性质的角度对常见有机物进行分类,通过“方法导引”栏目初步总结认识有机物的一般思路,使学生掌握方法,进一步强化有机物的认知模型。
本节教材从化学史实和生活实例引入乙醇,学生容易就此根据经验总结出乙醇的物理性质。然后再通过分析分子结构引入取代基和烃的衍生物概念,指出衍生物的分子中含有官能团,与母体化合物烃的结构不同,因此性质也有所区别,深化学生对“结构决定性质”这一化学基本观念的理解。教材编入乙醇与钠反应的实验,并分析乙醇与乙烷具有不同化学性质的原因,由此引入官能团的概念。这样既介绍了代表性物质的化学性质,又让学生认识到官能团对有机物化学性质的决定作用。
教材中乙醇的氧化反应重点在于催化氧化,其中包含了生物体内酶催化的氧化反应,以及乙醇与高锰酸钾等氧化剂的反应,由此打通了从乙烯到乙醇、乙醛、乙酸的物质转化链。教材在本节和本章最后编入相关习题和“整理与提升”,帮助学生分析这一转化过程中的官能团和物质类别变化,深化其对有机物性质与转化关系的认识。
在介绍乙酸时,教材通过学生熟悉的食醋引入乙酸的物理性质,再通过结构简式引入羧基。基于学生的生活经验和已学过的无机酸的通性,学生容易理解乙酸的酸性。因此教材对这部分内容未作更多介绍,而是通过栏目让学生自行设计实验方案比较酸性,进行知识迁移,培养证据推理与科学探究的学科核心素养。这些内容可与“实验活动9”适当整合,以提高教学效率。酯化反应是重要的有机化学反应,教材用了较多篇幅进行介绍,并结合具体性质与用途附带介绍酯类物质。由于选择性必修模块“有机化学基础”还要继续学习该反应,此处的教材不涉及同位素示踪等与反应机理相关的内容,而是结合该反应的特征复习和应用化学反应速率与限度的知识。
二、教学目标
1.教 学 目 标
(1)通过乙醇的结构及其主要性质与应用,认识有机化合物中羟基与其性质的关系。
(2)通过乙酸的结构及其主要性质与应用,认识有机化合物中羧基与其性质的关系。
(3)通过有机化合物的类别、官能团和典型代表物,从官能团分类的角度辨识各类有机化合物并探析它们的结构和性质。
2.教学重点和难点
重点:乙醇、乙酸的结构和性质。
难点:乙醇的催化氧化,乙酸的酯化反应。
三、教学建议
在初中化学的学习中,学生已经初步认识了乙醇和乙酸是生活中的两种常见有机化合物,因此本节的教学重点是帮助学生从乙醇和乙酸分子结构的视角来认识它们,并从官能团角度建立结构决定性质的学科观念。
1.以分组实验探究的方式认识乙醇的结构和性质
教学设计的重点是让学生在探究乙醇化学性质(与钠的反应、催化氧化反应)的过程中,认识有机化合物中羟基的特点,帮助学生建立有机化合物中官能团决定其化学性质的学科思想。主要教学策略一是在教学设计上层层递进,逐渐深入,先感知,再深入,后运用;二是充分发挥学 生在课堂学习活动中的主体作用,教师创设环境给予学生任务驱动,学生小组合作实验探究,全班交流讨论,激发学生学习的兴趣和解决问题的动力,最终达到促进全体学生素养发展的目标。
驱动性任务问题参考如下:
(1)乙醇在生活中有哪些实际应用?这些应用利用了乙醇的组成和性质上的什么特点?
(2)乙醇分子结构中存在怎样的化学键?什么是羟基?为什么说羟基是乙醇的官能团?
(3)乙醇与钠的反应中,观察到哪些实验现象?这些现象说明乙醇有什么性质,反映了乙醇怎样的分子结构特点?
(4)乙醇的催化氧化反应中,观察到哪些实验现象?这些现象说明乙醇有什么性质,反映了乙醇可通过怎样的反应转化为其他有机化合物?(5)请从化学键变化、官能团变化、物质类别变化和反应类型等角度分析乙醇与钠的反应,以及乙醇的催化氧化反应,认识其反应规律。
2.以演示实验探究的方式认识乙酸的结构和性质
教学设计的重点是让学生在探究乙酸化学性质(重点是酯化反应)的过程中,认识有机化合物中羧基的特点,帮助学生进一步建立有机化合物中官能团决定其化学性质的学科思想。本节中乙酸的酸性不属于有机化学研究的重点内容,不必作为课堂探究活动的重点。酯化反应在有机合成中的应用非常广泛,因此乙酸的酯化反应是教学重点和难点,课堂探究活动应围绕酯化反应展开。
乙酸和乙醇的酯化反应实验涉及浓硫酸的使用和加热操作,有一定的危险性,以教师演示较为适宜。在课堂活动中,实验操作部分由教师完成,但观察实验、发现问题、探究规律的任务由学生完成,因此教师也要设计一系列驱动性问题帮助学生达成学习目标。
驱动性任务问题参考如下:
(1)乙酸在生活中有哪些实际应用?这些应用利用了乙酸的什么性质?
(2)乙酸分子结构中存在怎样的化学键?什么是羧基?为什么说羧基是乙酸的官能团?
(3)从分子结构上看,乙醇和乙酸都含有—OH, 为什么前者没有酸性,后者有弱酸性?
(4)乙酸与乙醇的酯化反应实验中,为什么先加入乙醇,再加入浓硫酸?
(5)乙酸与乙醇的酯化反应实验中,哪些实验现象说明生成了新的有机化合物——乙酸 乙酯?
(6)乙酸乙酯有哪些与乙醇、乙酸不同的物理性质?这反映了它们在结构上的哪些区别?
(7)乙酸与乙醇的酯化反应实验中,有哪些重要的安全措施?
(8)请从化学键变化、官能团变化、物质类别变化和反应类型等角度分析乙酸与乙醇的酯化反应,认识其反应规律。
3.以分析对比、迁移应用的方式认识有机化合物的官能团分类法
首先,分析对比。以乙烯为例分析常见链烃类物质中官能团的组成、结构(化学键类型和极性)与其主要化学性质的关系;以乙醇、乙酸为例对比常见烃的衍生物中官能团的组成、结构与其主要化学性质的关系;通过对比乙醇、乙酸分子结构中羟基的极性不同及其对化学性质的影响,帮助学生认识有机化合物中基团的相互作用(学生接受能力较强时可适当涉及)。
其次,迁移应用。以乙烯的化学性质为模型,让学生分析丙烯等烯烃类物质有哪些化学性质,以此帮助学生深入认识碳碳双键的加成反应、加聚反应的基本规律;以乙醇的化学性质为模型,让学生分析丙醇等醇类物质有哪些化学性质,帮助学生深入认识羟基与钠反应、催化氧化反应和酯化反应的基本规律;以乙酸的化学性质为模型,让学生分析丙酸等羧酸类物质有哪些化学性质,帮助学生深入认识羧基的酸性和酯化反应的基本规律。
最后,综合应用。让学生在认识陌生有机化合物中的官能团及其性质的过程中,进一步辨识、探析各类有机化合物的结构和性质。例如,某有机化合物的结构简式为HOCH₂CH=CHCH₂COOH, 它含有哪些官能团?能发生怎样的化学反应?这些化学反应中,化学键和官能团发生了怎样的变化?
四、栏目使用建议
1.实 验
【实验7-4】
该实验通过乙醇与钠的反应,帮助学生认识乙醇中羟基的活泼性。主要活动内容为:观察实验,记录现象,小组内讨论分析产生现象的原因,然后全班讨论交流。教师要引导学生透过现象看本质,引导学生分析反应中乙醇的官能团和化学键的变化。建议同时做水与钠的反应,通过对比说明问题。实验中,观察到的现象和相关解释如下。
(1)将一小块钠投入适量无水乙醇中,钠先沉入液体底部,这是因为钠的密度比乙醇的大。然后在钠的表面有气泡产生,这是钠与乙醇反应生成的氢气。随后钠会逐渐浮到液面上来,这是因为钠表面的氢气泡产生了浮力。最后钠会逐渐消失,反应终止。
(2)乙醇与钠的反应是放热的,实验中能感觉到试管壁发热。这一点不必强调,但如果有学生观察到这个现象并提出来,教师应给予肯定并引导学生思考其原因。
(3)由于放出的氢气中含有少量乙醇蒸气,而且使用了玻璃尖嘴导管,因此点燃氢气并不能产生淡蓝色火焰,而是火焰呈黄色。同时,氢气与少量乙醇蒸气一起燃烧,可能会影响燃烧产物的检验,如果相关实验出现异常现象,可以进行合理解释。
【实验7-5】
该实验通过乙醇的催化氧化反应,帮助学生认识乙醇的还原性,认识羟基转化为醛基、乙醇转化为乙醛的反应规律。教师要引导学生透过现象看本质,引导学生分析反应的类型、反应中乙醇的官能团和化学键的变化,以及反应中有机物类别的转化。实验中,观察到的现象和相关解释如下。
(1)将下端绕成螺旋状的铜丝在酒精灯火焰(外焰)上灼烧,铜丝表面会生成黑色的氧化铜。反应的化学方程式为:
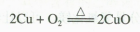
(2)将表面变黑的铜丝灼热后立即插入盛有无水乙醇的试管中,可以看到乙醇沸腾,铜丝表面恢复红亮。由于反应放热,乙醇的沸腾会持续一段时间。注意试管中的无水乙醇不要加得过多,并且要防止试管过热而烫伤手。反应的化学方程式为:

(3)上述实验操作反复几次后,可以闻到乙醛的刺激性气味。上述反应的总的化学方程式为:
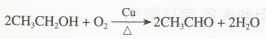
铜参与了反应,但在反应前后其质量不变,因此铜是乙醇氧化反应的催化剂。
【实验7-6】
该实验通过乙酸与乙醇的酯化反应,帮助学生认识羧基与羟基发生酯化反应的规律,认识乙酸、乙醇转化为乙酸乙酯的反应过程。教师要引导学生分析反应的类型、反应中乙醇和乙酸的官能团和化学键的变化,以及反应中有机物类别的转化,还要强调实验中的安全问题。实验操作注
意事项、观察到的现象和相关解释如下。
(1)向一支大试管中加入3 mL 无水乙醇,然后沿试管内壁慢慢加入2 mL 浓硫酸,振荡试管使液体混合均匀。浓硫酸溶于乙醇会明显放热,因此要稍冷却后再加入2 mL冰醋酸,防止因温度过高在没有安装好仪器之前就发生酯化反应,导致乙酸乙酯挥发。
(2)大试管中要放入几片碎瓷片,防止加热时产生暴沸。安装好仪器后开始加热时,先使试管均匀受热,然后再固定加热位置。保持酒精灯小火加热,温度不宜过高,否则浓硫酸会使有机物炭化。
(3)饱和碳酸钠溶液中可加入两滴酚酞溶液,便于观察液面。注意导管口要保持在液面上,以防止倒吸。待收集到约2 mL油状液体时,即可停止加热。根据液体分层,且油状液体在碳酸钠溶液上面,可初步判断乙酸乙酯不溶于水且密度比水的小。
(4)振荡收集乙酸乙酯的试管,可观察到有气泡产生,说明乙酸乙酯中含有乙酸杂质。振荡后静置,液面重新分层,可以闻到上层油状液体有特殊香味。说明乙酸乙酯是不溶于水、密度比 水的小、有香味的液体。
(5)实际上,乙酸乙酯中除含有乙酸外,还含有挥发性比乙酸更强的乙醇,而且乙酸乙酯是微溶于水的,因此饱和碳酸钠溶液主要有以下4点作用:中和乙酸,溶解乙醇,降低乙酸乙酯在水中的溶解度,提高水溶液的密度以加速乙酸乙酯与水溶液的分层。一般只需要学生了解乙酸乙酯的主要物理性质(水溶性、密度、气味)和碳酸钠溶液最主要的作用(中和乙酸)即可。
(6)浓硫酸的作用是催化剂和吸水剂,主要让学生了解其催化作用即可。
(7)酯化反应的机理一般来说是酸脱羟基、醇脱氢原子,教师可以视学生情况简单地提一下,必修阶段不要求学生掌握。
2.思考与讨论
(1)食醋清除水垢是利用了乙酸的酸性,可结合乙酸表现酸的通性的具体反应实例,开展课堂讨论。注意水垢中还含有的一种成分是氢氧化镁。可以让学生在家里的厨房中完成相关的研究性学习活动。
(2)比较乙酸、碳酸、盐酸的酸性强弱,可采用学生小组设计探究实验的方式,画出实验装置图,然后分析比较并讨论。也可以由教师给出装置示意图,学生小组进行讨论、预测现象、分析结论和对实验方案进行评价等活动。


