第二节 氮及其化合物
思政元素:生态文明与可持续发展(单循环失衡与环境污染)。
一 、内容分析
本节内容主要包括:氮及氮的固定、 一氧化氮和二氧化氮、氨和铵盐、硝酸、酸雨及其防 治。教材首先根据氮的原子结构知识,应用前一节掌握的研究非金属单质性质的基本思路预测氮 的化学性质,渗透条件对化学反应的影响,引出氮的固定对人类生存的重要意义。之后,根据物 质类别研究氮的化合物,包括一氧化氮、二氧化氮、硝酸、氨和铵盐的化学性质。以工业合成 氨、工业制硝酸的生产原理为载体,应用氧化还原反应原理,设计含氮化合物的转化,使学生 认识到从一种原料转化成多种产品,路径之一是通过氧化还原反应改变主要元素的化合价,提 升“变化观念”等学科核心素养。教材设置铵根离子的检验、实验室制取氨的实验活动,让学生 根据氨、铵根离子的性质和反应,选择合适的试剂,设计检验或者制取物质的方案,提升其科学 探究的能力。最后,教材编入“酸雨及其防治”内容以及“测定雨水的pH” 的研究与实践活动, 综合运用硫和氮及其化合物的相关知识,寻求证据参与社会性议题的讨论,分析硫酸工业、合成氨工业对社会发展的价值和对环境的影响,有意识地渗透资源合理利用和环境保护的意识。
二 、教学目标
1. 教 学 目 标
(1)通过分析氮的原子结构,推断含氮物质可能的化学特性,理解结构与性质的关系。
(2)通过实验探究,了解一氧化氮与氧气反应、二氧化氮与水反应等性质,感受化学变化的奇妙。
(3)结合化学实验,了解氨与水、酸或氧气的反应,知道氨的催化氧化反应是工业上制取硝酸的基础,知道铵盐是重要的氮肥。
(4)通过对铵盐性质的学习,了解氨的实验室制法,知道铵盐的检验方法,培养学以致用的理念。
(5)结合实验探究,了解硝酸的主要性质——不稳定性和强氧化性,知道硝酸是重要的化工原料。
(6)了解酸雨的概念,知道酸雨形成的主要原因是二氧化硫和二氧化氮进入大气,知道酸雨会严重危害环境,增强环保意识,培养社会责任感。
2. 教学重点和难点
重点:氮及其重要化合物的性质与相互转化,硝酸的不稳定性和强氧化性,酸雨的概念。
难点:二氧化氮的化学性质,硝酸的强氧化性。
三、教学建议
1. 参照非金属元素学习的 一般模式,以元素周期表为依据,完成氮及其化合物
知识体系的建构
氮和硫都是典型的非金属元素,含有它们的无机物一般可分为单质、氢化物、氧化物、氧化 物的水化物(含氧酸)、含氧酸盐等5个大类。根据各物质在生产、生活中的用途不同,教科书 的介绍各有侧重,但5类物质都有出现。如本节中涉及含氮的5类物质有N₂ 、NH₃ 、NO 、NO₂、 HNO₃ 、Cu(NO₃)₂等,教学中要注意它们与硫元素对应的物质(S 、H₂S 、SO₂ 、SO₃ 、H₂SO₄ 、 CuSO₄) 在性质上的异同,感受同类物质性质的相似性和差异性,在比较和分析中增强对知识的理解。
元素周期表是学习元素单质及其化合物的重要工具,教学中要引导学生有意识地用好元素周 期表。如在单元小结时,可以比较C 、N 、O 三种元素的性质差异,体现知识的规律性,提高对元素周期律的认识。
2. 选择适当的素材,设置有效教学情境,提高教学效率
“雷雨发庄稼”可以作为本节开始时设置的情境,在播放情境视频后,可以设问:“空气中性 质稳定的氮气是怎样被氧化的呢?今天我们就一起来研究这个问题,”然后开始新课的进程。但 在教学时要注意,雷雨虽然有益,但雷电灾害却是严重的自然灾害之一,雷击可能毁坏建筑物、 破坏电力设备、引发火灾甚至致人死亡,所以要提醒学生注意安全,远离灾害。
“酸雨的危害”是学习酸雨及其防治时的情境素材,教学中可以先播放相关视频或展示图片, 再提出问题:“什么是酸雨?酸雨是怎样形成的?怎样防止酸雨的形成?”然后指导学生阅读教材,完成学习任务。本节教学中的情境素材还有氮的循环与固定、工业合成氨、工业制硝酸等。
3. 正确把握教材中关于氮气、二氧化氮、氨、硝酸等的教学要求,合理控制知
识的深广度
关于氮气性质的稳定性,可以从结构分析入手,先展示氮分子的结构模型,指出由于断开氮 氮三键需要较多的能量,所以氮气性质稳定。再从原子结构分析,由于氮原子的最外电子层有 5个电子,所以既不太容易失去5个电子形成+5价的阳离子,也不太容易得到3个电子形成-3价
的阴离子。但在高温、放电和有适当催化剂等条件下,氮气也能与一些物质发生反应。
氮的氧化物种类较多,可以告诉学生氮从+1价到+5价的氧化物都有。教材重点介绍了NO
和NO₂, 教学时对氮的其他价态的氧化物不宜作过多的介绍。
氨的学习可以充分利用氨的结构模型和化学实验提供的直观信息。在介绍氨分子的结构时, 可以告诉学生其空间结构是三角锥形。由于学生没有学习极性分子和非极性分子的概念,所以在这里不要涉及分子的极性。氨与水的反应属于可逆反应,可以借此回顾可逆反应的知识。
硝酸的强氧化性是本节教学的难点,要使学生明确:硝酸与铜反应时不需要加热;浓硝酸的 还原产物是NO₂ 且反应较快,稀硝酸的还原产物是NO 且开始时反应较慢;常温下浓硝酸与铁或 铝接触时会发生钝化现象,但加热后则可以持续发生反应。在此基础上,可以让学生写出红热的 木炭与浓硝酸反应的化学方程式,通过练习突破难点。这里不要介绍硝酸被还原为其他价态物质
的反应,以免增加学生的学习负担。
4. 通过对比、归纳、整理等方法,使所学知识系统化、结构化
浓硝酸的强氧化性是难点,可以通过浓硝酸、浓硫酸分别与铜发生反应的比较加深理解,帮
助记忆(表5-2)。
表5-2浓硝酸、浓硫酸分别与铜等物质反应的比较
反应 | 浓硝酸与铜反应 | 浓硫酸与铜反应 |
化学方 程式 | Cu+4HNO₃ (浓)=Cu(NO₃)₂+2NO₂ ↑+ 2H₂O | Cu+2H₂SO₄ (浓)=△CuSO₄+SO₂ ↑+2H₂O |
不同点 | 反应条件:常温 | 反应条件:加热 |
现象:生成红棕色气体,溶液逐渐变蓝 | 现象:生成有刺激性气味的气体,稀释后 溶液变蓝 | |
相同点 | 1.都是含氧酸的中心元素被还原,酸中的氢离子都不被还原; 2.都能与不活泼金属(如铜、汞)以及一些非金属单质等反应; 3.常温下与铁、铝都能发生钝化现象; 4.都是浓度越大,氧化性越强。 | |
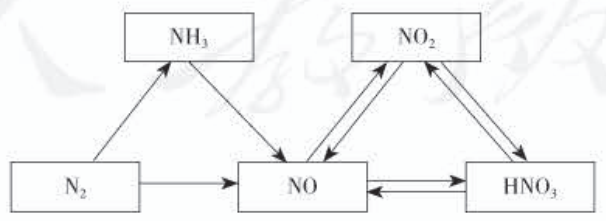
在单元复习时可以将本节的主要物质N₂ 、NH₃ 、NO 、NO₂ 、HNO₃ 、Cu(NO₃)₂间的关系进行 整合,形成简洁直观的“氮三角”(如下图),并按箭头方向写出相关反应的化学方程式,使所学知识结构化。
对重要的物质如氨、硝酸等,可以从物质的组成、结构、性质(物理性质)、变化(化学 性质)、用途、制备、检验等方面全面总结,以便使学生掌握学习元素单质及其化合物的一般思路。
5. 注重实验的趣味性和探究性,激发学生的学习兴趣,提高学习效率
本节教材中氨的喷泉实验、氨与氯化氢反应生成“白烟”的实验等,都具有很强的趣味性, 教师要用好这些实验激发学生的学习兴趣,并引导学生把兴趣转化为学习化学的动力。如在做氨 的喷泉实验时,先提醒学生注意观察实验现象,完成实验后,通过连续提问引导学生分析实验现 象。相关问题有:①同学们看到了什么现象?②出现喷泉现象说明了什么?③喷泉的原理是什 么?④溶液变成红色说明了什么?⑤你知道还有哪些气体可以做喷泉实验?在分析的基础上得出实验结论,并写出氨与水反应(可逆反应)的化学方程式。
四、栏目使用建议
1. 实 验
【实验5-5】
该实验的目的是探究NO₂ 与 NO 的相互转化,巧妙地使用注射器,方便灵活,微型环保,可
以演示也可以分组实验。
实验现象:第一次振荡时,无明显现象;吸入空气后气体变为红棕色;再振荡后气体又变为
无色,同时注射器的活塞向内移动。
实验分析:NO 不溶于水,吸入空气后,NO 与 O₂ 反应生成NO₂, 气体变为红棕色;振荡后,
NO₂ 溶于水生成硝酸和NO, 气体又变为无色,同时气体的总体积有所减小。
注意事项:①操作时要注意控制好吸入气体或液体的体积;②注射器的体积小,为了让学生 看清楚,可以走到学生中间操作或通过实物投影仪放大实验现象;③实验结束时可以吸入过量的
空气,充分振荡后将液体注入烧杯,滴加紫色石蕊溶液,观察现象。
【实验5-6】
该实验是利用氨极易溶于水的性质设计的趣味性实验,喷泉现象是该实验吸引学生的亮点。
本实验操作要求较高,适宜在课堂演示。
实验现象:烧杯里的液体经玻璃管喷入烧瓶,形如喷泉,溶液变成红色。
实验分析:挤压胶头滴管,滴管里少量的水进入烧瓶,氨溶于其中,使烧瓶内气体压强减 小,在大气压作用下,下方烧杯里的水被压入烧瓶;氨几乎全部溶于水中,使烧瓶内气压迅速降 低,烧杯里的水(含酚酞)在大气压作用下被迅速压入烧瓶,形成喷泉;由于氨水显碱性,导致
酚酞溶液显红色。
注意事项:①烧瓶内氨的纯度越高,实验效果越好,可将浓氨水滴加在适量生石灰中制 取氨;②装置的密封性要好;③氨在烧瓶内保存时间不要太长,最好当天制取当天实验;④连 接装置时要迅速,以防空气进入烧瓶,影响实验效果;⑤可将2~3 mL 浓氨水倒入圆底烧瓶, 用酒精灯微热,振荡后迅速塞上带有玻璃管的橡胶塞(注意通风),立即用于喷泉实验,效果
较好。
【实验5-7】
铵盐都能与碱反应生成氨,这是实验室检验铵盐和制取氨的化学原理。
实验现象:加热时有气泡产生,试管口湿润的红色石蕊试纸变蓝。
实验分析:两种溶液混合时发生反应 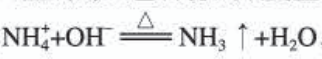 ,氨水显碱性,使湿润的红 色石蕊试纸变蓝。
,氨水显碱性,使湿润的红 色石蕊试纸变蓝。
注意事项:①实验所用溶液的浓度宜大,体积宜小;②氨有刺激性气味,操作时应注意通
风,防止空气污染;③根据这一原理,实验室可用铵盐与碱石灰反应制取氨。
【实验5-8】
浓硝酸和稀硝酸都能与铜反应,但反应速率和产物都不相同,实验时要注意比较其差别。
实验现象:浓硝酸与铜反应时,试管内产生大量红棕色气体,溶液逐渐变绿,铜丝逐渐变 细;稀硝酸与铜反应时,试管内开始产生少量无色气体,反应逐渐加快,气体在试管上部变为红
棕色,溶液逐渐变蓝,铜丝逐渐变细。
实验分析:浓硝酸与铜在常温下能迅速反应,生成红棕色的NO₂, 硝酸铜溶液显蓝色,当溶 液中同时溶有较多NO₂时,其混合溶液显绿色;稀硝酸与铜在常温下能缓慢反应,生成无色的 NO, 随着反应进行,溶液温度升高,反应速率逐渐加快, NO 与 O₂ 在常温下反应生成红棕色的
NO₂, 硝酸铜溶液显蓝色。
注意事项:①硝酸有腐蚀性和挥发性, NO 和NO₂都有毒,实验时要注意防护和通风;②选 用1:2的稀硝酸反应,现象比较明显;③为了便于观察气体的颜色,可以在试管背面用白纸衬
托;④观察时注意比较反应速率大小和生成气体的颜色。
2. 思考与讨论
【思考与讨论1】
在演示NO₂溶于水及NO 与NO₂在注射器中的相互转化实验后,教材设置该栏目,有针对性 地提出了三个问题,其目的是引导学生分析实验现象,然后联系工业生产实际进行思考,体现了
学以致用和节约环保的理念。在该实验中,当O₂过量时, NO 可以完全溶于水生成硝酸。
【思考与讨论2】
在学习了铵盐与碱反应生成氨的性质之后,教材设置了关于氨的实验室制法的思考与讨论, 其目的是要学生利用已经掌握的实验室制取氧气的方法,学习实验室制取氨的方法。教学时可以 要求学生根据化学反应原理,设计合理的操作步骤:①按装置图连接好装置;②检验装置的气密
性;③添加药品;④加热制取气体;⑤用向下排空气法收集气体。
注意:在试管口放置干燥棉花是为了防止氨与空气对流而泄漏。当室内气温较低时,用普通 玻璃试管,加热氯化铵与氢氧化钙制取氨,试管容易破裂。若用硫酸铵与碱石灰反应制取氨,可 以降低试管破裂的可能性。
【思考与讨论3】
在介绍氮及其主要化合物的性质之后,教材设置该栏目的主要目的,是让学生在归纳这些物 质化学性质的基础上,进一步从物质类别和元素价态的视角来认识物质的转化关系。同时,这里
也简单介绍了硝酸在生产中的用途和工业制备硝酸的方法。


