思政元素:科学理论需要几代科学家的努力。
一 、内容分析
本章第一节已经分别讨论了碱金属元素的金属性和卤族元素的非金属性变化规律,构建了同主族元素性质变化的相似性和递变性规律,使学生初步认识了“构”“位”“性”的关系。本节则在此基础上,以第三周期元素为代表,阐述元素性质的周期性变化,揭示同周期元素从金属元素到非金属元素性质的变化规律。学习族和周期元素性质的变化,可以使学生综合认识元素性质的周期性递变规律,从而归纳出元素周期律,了解元素周期表和周期律的应用,对“构”“位”“性”的关系有进一步的认识。
本节教材内容的呈现,仍是以原子结构为基础的。由于第一节已经通过两族元素初步建构了“构”“位”“性”的认识模型,本节应用认识模型,通过“思考与讨论”和“探究”活动,引导学生思考并参与知识的建构。
对于中学阶段重要的理论知识,教材编写体现学科知识的逻辑性,重视推理,借助实验和事实进行分析;应用演绎、归纳的方法,培养学生的逻辑思维能力。教材中核外电子排布、原子半径、化合价的变化规律,是应用归纳的方法由学生讨论得出;元素的金属性、非金属性变化规律,则是在原子结构知识的基础上先演绎,后通过探究归纳得出。
本节教材主要研究第三周期元素的性质变化,重在引导学生从中发现规律,所以一些知识是作为发现规律的载体编排进来的。例如,关于铝的知识,课程标准并无明确要求,教材中是将其作为信息给出,目的是使学生从中发现变化的趋势,总结出规律。
探究“第三周期元素性质的递变”,是应用预测方法模型,通过设计“问题提出一实验(事 实)验证—结论分析”的探究思路,并运用比较、信息处理等方法,引导学生体验探索规律的过程,学习科学研究的方法。
二、教学目标
1.教学目标
(1)结合有关数据和实验事实认识原子核外电子排布、元素最高化合价和最低化合价、原子半径等随元素原子序数递增而呈周期性变化的规律。
(2)以第三周期元素为例,认识同周期元素的金属性、非金属性等随元素原子序数递增而呈周期性变化的规律,建构元素周期律。
(3)基于元素“位置-结构一性质”认识元素性质,基于物质“结构一性质—用途”认识物质性质,基于元素性质递变的本质原因认识物质世界。
(4)加深对分类法、归纳法等科学方法的认识,提高逻辑推理能力、论证能力,从而发展证据推理与模型认知的化学学科核心素养。
2.教学重点和难点
重点:元素周期律的含义和实质;元素性质与原子结构的关系。
难点:元素性质与原子结构的关系。
三 、教学建议
1.明确元素周期律在高中化学学习中的功能与价值
元素周期律是对元素性质呈现周期性变化实质的揭示。通过学习元素周期律,学生可以加深对元素化合物性质的理解和记忆,同时也对元素化合物知识进行拓展和归类。例如,通过学习元素周期律、周期表,学生会在原来学习的一个个零散的单质、化合物知识的基础上,明确同一周期元素及化合物性质的递变性和同一主族元素及化合物性质的相似性,使元素化合物知识得以迁移与拓展。学生通过对已有知识进行概括、综合,实现由感性认识上升到理性认识;同时,也会以新认识来指导后续学习。所以,对于元素周期律的教学不要拘泥于对某一两种元素的性质的挖掘,而应该着眼于启发学生去发现元素的性质随着原子序数的递增而呈现出的规律性变化。
2.注意概念原理教学的逻辑性
元素周期律属于化学概念原理知识,概念原理教学应具有严密的逻辑性。从课堂教学的结构上,应当体现出教学内容本身逻辑系统的要求;要重视理论推理,借助实验和事实分析,应用归纳法和演绎法,培养学生的逻辑思维能力。概念原理的教学可以采用以下模式:个例性质—问题(实验)探究一归纳(抽象)结论一应用概念解决具体问题。教师要充分利用学生的已有知识,引导学生通过对个例的研究,归纳总结出一般规律。针对每一个要学习的知识点,以学生学过的某种元素化合物为模型,设置合适的情境,如问题串、实验等,让学生通过对问题的思考或对实验现象的描述、分析,解答问题,归纳总结得出结论,在此基础上,再给出概念原理定义。这样,学生不仅记住了元素周期律、周期表,还可以感受和体验这一规律性知识的形成过程,学会研究化学概念原理的方法。
元素周期律、周期表的教学如果处理不好会使学生感到乏味,甚至思维混乱,对化学学习失去兴趣。而实验探究或问题探究式的教学均能激发学生的学习兴趣,但一定要注意从学生已有的经验出发,最大程度地调动学生思考问题的积极性,提高学生的逻辑思维水平。
3.建构解决问题的模型——“结构决定性质”
教学中要注意引导学生建构解决问题的模型,即“结构决定性质”,让学生学会从原子结构入手进行分析,从而解释元素的各种性质呈周期性变化的原因。原子结构(核外电子排布)决定元素在周期表中的位置和性质(化合价、半径、金属性和非金属性);元素在周期表中的位置反映了元素的原子结构和元素的性质。在元素周期表和周期律的教学中,要引导学生建构解决问题的模型,使他们能把元素的性质、元素在周期表中的位置与相关的粒子结构联系起来,并能通过对“位置”“结构”“性质”三者关系的分析,提升推理能力及分析、解决问题的能力。
4.基于数据分析的方法论证元素化合价、原子核外电子排布、原子半径的周期性变化
教材中的表4-5中给出了短同期元素的原子核外电子排布、原子半径和主要化合价等丰富的信息。在教学时可以让学生在比较、分析的基础上对所搜集的信息进行加工处理。学生可以通过下列活动得出原子核外的最外层电子数、元素的原子半径、元素的主要化合价的变化规律。
环节1 元素化合价的数据加工与处理
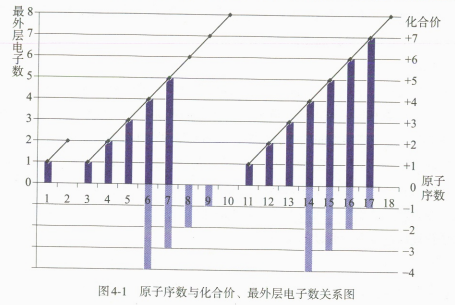
观察教材中的表4-5,以1~18号元素为例,以原子序数为横坐标,原子最外层电子数及化合价(最高正价、最低负价)为纵坐标,制作折线图和柱状图,并观察所得图形。(如图4-1所示)
环节2 原子半径的数据加工与处理
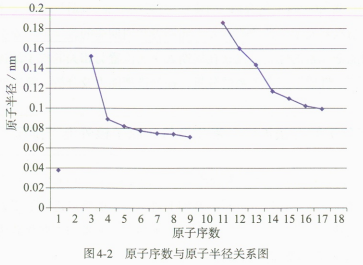
根据教材表4-5中原子半径数据,以原子序数为横坐标,原子半径为纵坐标,绘制折线图如图4-2所示。从点(同主族元素)、线(同周期元素)、面(不同周期的变化趋势)三个层次进行数据分析,归纳规律。
环节3 数据分析与规律预测
预测元素原子核外电子排布规律、原子半径及化合价变化规律,并通过填写“思考与讨论”栏目中的表格,发现规律并“水到渠成”地得出结论:随着原子序数的递增,元素原子的电子层排布、原子半径和化合价都呈现周期性的变化。
环节4 规律解释
再次引导学生分析以下问题:为什么同周期元素的原子半径会随着核电荷数的增加逐渐变小?原因是在电子层数相同的情况下,随着原子序数的增加,原子核对核外电子的电性作用增强,使得最外层电子与原子核之间的距离缩小,从而使得原子半径减小。
上述设计通过4个环节完成数据分析及对元素的原子半径、化合价、核外电子排布递变规律的预测、分析与解释任务,促进学生理解元素的原子半径、核外电子排布、化合价的递变规律,以及“位置”“结构”“性质”之间的关系。上述活动可以促使学生掌握证据收集的方法,提升对物质性质和变化规律进行科学假设的意识。
5.基于实验证据论证元素的金属性和非金属性的周期性变化
关于第三周期元素的金属性和非金属性的递变规律,可结合教材中的探究栏目,通过探究式教学组织教学过程。下列设计思路可供参考。
提出问题(如元素的金属性、非金属性是否随元素原子序数的变化而呈周期性变化?) →实验探究(如钠、镁、铝元素化学性质的比较) →得出结论→提供信息(如硅、磷、硫、氯元素的性质事实)→思考与讨论→概括出元素的金属性、非金属性递变规律→提出新问题:从原子结构角度如何解释元素的金属性、非金属性递变规律?(提示:结构决定性质) →再结合元素在周期表中的位置,总结出元素性质、原子结构与周期表中元素位置的关系→应用。
探究过程的主要环节可设计如下。
环节1 第三周期元素金属性递变规律的探究
回顾碱金属元素金属性强弱的判断标准,从同主族元素迁移到同周期元素,设计实验方案来探究钠、镁、铝元素的金属性强弱,两种方案如下表所示。小组讨论方案可行性和实验中需要控制的变量,最终选择其中一个方案进行实验。

环节2 第三周期元素非金属性递变规律的探究
回顾卤族元素非金属性强弱的判断依据,从同主族元素迁移到同周期元素,设计方案来探究硅、磷、硫、氯元素的非金属性强弱。设计方案如下表所示。

小组讨论方案可行性,通过收集教材中的事实证据和查阅资料(如下表所示信息),分析非金属单质氧化性的强弱及最高价氧化物对应的水化物酸性的强弱,进而归纳、论证元素非金属性的强弱顺序。可以告诉学生,规律不一定非得通过从零开始的实验探究得出,也可通过分析归纳已经存在的科学事实得出。

环节3 规律解释
通过上面两个环节的科学探究活动,学生已经认识到第三周期元素随着原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强。在此,可以通过阅读教材或者直接讲述等方式告诉学生:这个规律不仅存在于第三周期,若对其他同周期元素进行研究,一般情况下也会得出类似的结论。然后再请学生从原子结构角度与原子得失电子能力角度,分析同周期元素的性质呈现出这种递变性的原因。
四、栏目使用建议
1.思考与讨论
本栏目的目的是引导学生对教材表4-5中呈现的数据进行处理,并从中找出元素的原子核外电子排布、原子半径和化合价的变化规律。教学中,除了通过归纳数据填写栏目中的表格外,还可以引导学生采取多样化的数据处理方法,如绘制直方图、折线图等。为了提高课堂效率,教师可以在课前发给学生空白坐标图。
2.探究
【探究】第三周期元素性质的递变
钠、镁、铝的性质实验简单易做,现象比较明显且安全。有条件的学校可将钠、镁、铝的性质实验设计为学生的分组实验,实验方案不做统一规定,要求各小组自行设计实验方案,然后全班进行交流,最后综合总结出最佳方案。活动中要注意培养学生的求异思维能力。
镁与水的反应,看不到产生的氢氧化镁,因此可通过酚酞指示剂的变色去确定氢氧化镁的生成。镁与水反应产生的氢气量较少,不易点燃。为了清楚地看到生成物产生的气泡,而不是加热时由于水沸腾而产生的气泡,应该在停止加热、水不再沸腾时立即观察。也可利用KCl 、NaCl 等有阻止氢氧化镁薄膜在镁条上形成的作用,将水改成食盐水等进行实验。
实验步骤:取一段擦去表面氧化膜的镁条,卷成螺旋状,插入盛有食盐水的试管中,再将试管倒插在盛有食盐水的烧杯中,可以观察到镁持续不断地跟水反应,几分钟后,白色的氢氧化镁沉淀聚积在烧杯底部。
在镁与水反应的基础上,可引导学生分析铝与水是否反应,并联系铝制品可作炊具的生活实际。
注意事项:①食盐水可以用饱和食盐水稀释一倍获得;②提示学生,氢氧化钠溶液与镁盐溶液反应生成氢氧化镁沉淀,但不能用此实验来证明氢氧化钠的碱性比氢氧化镁强。


