思政元素:分析海水提镁的核心反应,展现我国海洋资源开发技术,增强民族自豪感。
一、内容分析
在介绍离子反应之前,需要介绍电解质、电离的概念。因此,本节内容分为两部分:电解质的电离,离子反应。
首先,教材结合生活常识(给电器设备通电时,湿手操作容易发生触电事故)创设情境,以真实、有意义的问题来激发学生的学习兴趣,引发学生思考。然后以实验1-2为基础介绍电解质和电离的概念.
需要说明的是,实验1-2的设计目的有3个::①认识物质的导电性②引入电解质的概念③为学习电解质的概念提供实验证据。
教材基于实验证据提出问题:为什么氯化钠、硝酸钾等电解质,在干燥时不导电,而溶于水或融化后却能导电了呢?随后,教材结合构成氯化钠固体的粒子、氯化钠固体在水中溶解和形成水和离子的过程,以及氯化钠固体受热熔化时粒子运动的变化等,从微观角度对上述问题做出解释。为了帮助学生深入理解,教材辅以相应的微观过程示意图(图1-10、图1-11、图1-12)。在此基础上,介绍电离的概念和电离方程式,并结合电离方程式,引导学生从电离的角度认识酸、碱的本质。
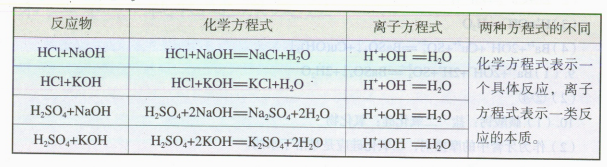
在学习电离和电离方程式的基础上,教材通过实验1-3的现象和分析,得出硫酸钠稀溶液与氯化钡稀溶液反应的微观实质,从而引出离子反应和离子方程式,并介绍离子反应方程式的书写步骤。然后教材以“思考与讨论”的形式,得出中和反应的实质,引导学生深入认识离子反应。最后,教材说明酸、碱、盐在水溶液中发生复分解反应的微观实质,并总结这类离子反应发生的条件等。
本节内容的特点是概念多、抽象,理论性强。在呈现方式上,教材一方面紧密结合实验引入概念,充分发挥实验在化学概念形成中的重要功能,如现象直观、易懂,有利于激发学习兴趣等;另一方面,注重基于实验证据(宏观现象)进行分析和推理,逐步引导学生认识物质导电性及电解质在溶液中反应的本质特征(微观实质),建立电离与离子反应的概念模型,体会模型在解释化学现象、揭示现象的本质中所发挥的重要作用,发展化学学科核心素养。
二、教学目标
1.教学目标
(1) 通过实验、假设、推理等过程,以探究的方式建构电离模型,并以此认识电解质;能用电离方程式表示某些酸、碱、盐的电离过程。
(2)通过分析酸、碱、盐之间的反应事实,认识离子反应,归纳离子反应发生的条件,正确书写这些反应的离子方程式。
(3) 通过实验了解常见离子的检验方法,进一步理解离子反应。
2.教学重点和难点
重点:离子方程式的书写。
难点:电解质概念,离子反应发生的条件。
三 、教学建议
1. 在电离概念建立过程中培养证据推理与模型认知的核心素养
理解电离概念并不难,但由于其微观过程不可见,因此只能在实验事实的基础上通过推理、假设、验证等探究过程,建立微观模型,从而对实验事实作出合理解释。
建议如下。(情境及后续内容略)
环节一 导电性实验:测试①NaCl 固体、②纯水、③NaCl 溶液的导电性。
板书如下图所示。

提出问题:在NaCl 溶于水的过程中究竟发生了什么?(提示:微观角度)
环节二 分组讨论:各抒己见,用语言、文字或图画描述想象的微观过程。
环节三 分享:小组代表阐述本小组意见(不唯一)。如有可能,教师可播放模拟电离过程的动画。
环节四 达成共识:评价以上意见的合理性,形成微观模型——NaCl 在水分子作用下解离成自由移动的Na*和CI-,脱离固体表面,进入水中形成溶液,即发生电离。
2. 提出挑战性问题引发科学探究,实现深度学习
在离子反应概念建立初期,宜使用伴有沉淀生成等明显现象的反应。为了让学生更深入地理解离子反应概念,可以给出更具挑战性的问题,引发科学探究过程。
探究问题:下列反应过程中均产生白色沉淀,表观现象无差异。反应装置如图1-3所示。
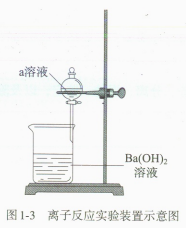
判断下列情况对应的离子方程式是否正确。
反应① a 为硫酸钠时:Ba²*+SO42-?=BaSO₄↓
反应② a 为稀硫酸时: Ba²*+SO42-=BaSO₄↓
问题分析:反应中除Ba²*和SO? 结合生成可见的白色沉淀BaSO₄ 外,还有其他离子吗?它们是否也能结合?有可见的现象吗?如果不可见,可以通过实验来证明吗?怎么证明?
(反应①中还有Na⁴ 、OH-, 反应②中还有H+ 和OH-, 它们能否分别结合决定了溶液中是否仍存在自由移动的离子。二者的差异可以由溶液导电性实验予以外显。)
溶液导电性实验:按图1-4所示装置进行实验。

实验现象:反应①发生时,灯泡亮度变化不大;反应②发生时,灯泡亮度先变小至熄灭,再 变大。
3. 设计评价性活动,引导学生关注社会
可以通过学生活动来评价电离和离子反应知识的学习效果。例如,设计实验方案,除去饮用 水中过多的Ca²* 、Mg* 、SO?-等。
情境设计:水体中含量过高的Ca²、Mg² 既会造成锅炉结垢,也会降低洗涤衣物时肥皂的使 用效率。
问题:如何在不引入新杂质的情况下除去这些离子,使水得到净化?
方案设计:①选择药品(溶液),确定加药顺序和操作顺序;②确保所加药品(应适当过量)在后续反应中被清除。
学生活动:①根据要求分小组设计方案;②实施实验方案,并做好记录;③分享实验结果并作出评价。
此外,离子反应在物质的制备、分离、提纯、鉴定,以及除去水中污染物等方面都有很多应用,可酌情选择合适的材料设计成学生活动。
四、栏目使用建议
1. 实 验
【实验1-2】
(1)NaCl 、KNO₃ 固体一般使用粉末,若能使用体积较大的晶体则可使对电离过程的分析更易理解。
(2)测纯水导电性时应保证蒸馏水较纯,且应强调“在这种情况下测不到水导电”。
(3)做溶液导电性实验时,在纯水导电性实验基础上,向蒸馏水中加入NaCl粉末,展现灯泡逐渐变亮的过程,并引导学生边看边思考溶解的微观过程。
(4)可使用实物投影仪将实验过程和现象放大,支持学生的观察与思考。
【实验1-3】
(1)在完成教材中表格的填写后可做进一步讨论:怎样判断反应中两种离子的结合?能够通过实验现象直接判断其他离子没有结合吗?如何用实验加以证明?
(可以取反应后的滤液加入HNO₃酸化的AgNO₃溶液检验其中的CI- 。)
(2)可对本实验进行深入分析,用导电性对比实验确定反应中哪些离子反应(结合)了,哪些没有。可参考“教学建议”中的第2条。
2. 思考与讨论
【思考与讨论1】
要求学生在书写三种碱的电离方程式时要上下对齐。可在板书或课件上框定三者电离出的共同的离子OH-,如下所示
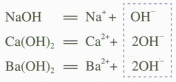
对于学习能力较强的学生,可引导其分析Cu₂ (OH)₂CO₃ 是否属于碱。
【思考与讨论2】