第57-58课时 实验项目8-1 标准缓冲溶液的配制
一、实验目的和要求
1、掌握pH计的测定原理
2、掌握pH计的使用方法和操作技能
二、实验原理
pH计别名酸度计,主要用于精密测量溶液中的氢离子浓度,准确地说是测量氢离子活性,得出溶液是酸性、中性还是碱性的数值,即pH值。在化工、环保、科研、制药、自来水、医疗等领域广泛地使用。

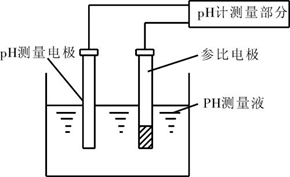
PH计主要由玻璃电极、参比电极和电流计三部分组成。玻璃电极的功能是建立一个对所测量溶液的氢离子活度发生变化作出反应的电位差,参比电极的基本功能是维持一个恒定的电位,作为测量各种偏离电位的对照,电流计能在电阻极大的电路中测量出微小的电位差。
把对pH敏感的电极和参比电极放在同一溶液中,就组成一个原电池,该电池的电位是玻璃电极和参比电极电位的代数和:
E电池=E参比+E玻璃
如果温度恒定,这个溶液和电极所组成的原电池的电位变化,只和玻璃电极的电位有关,而玻璃电极的电位取决于待测溶液的PH值,电位随待测溶液的pH变化而变化。因此,通过对电池电位的变化测量,就可以测出溶液的PH值。因其电动势非常小,测量pH计中的电池产生的电位是困难的。电流计的功能就是将原电池的电位放大若干倍,放大了的信号通过电表显示出。pH电流表的表盘刻有相应的pH数值;而数字式pH计则直接以数字显出pH值。
水溶液pH值的测量传统是用玻璃电极作为指示电极,甘汞电极作为参比电极,当溶液中氢离子浓度(严格说是活度)即溶液的pH值发生变化时,玻璃电极和甘汞电极之间产生的电势也随着发生变化,而电势变化关系符合下列公式:
△E = -0.1983 t △ pH
△E —— 表示电势的变化,以毫伏为单位(mV)
△pH —— 表示溶液pH值的变化
t —— 表示被测溶液的温度(℃)
常用的指示电极有玻璃电极、锑电极、氟电极,银电极等等,其中玻璃电极使用最广。
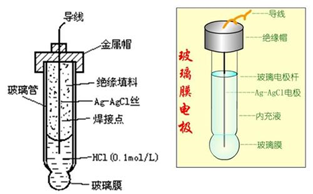
pH玻璃电极头部是由特殊的敏感薄膜制成,它对氢离子有敏感作用,当它插入被测溶液内,其电位随被测液中氢离子的浓度和温度而改变。在溶液温度为25℃时,每变化1个pH,电极电位就改变59.16mV。
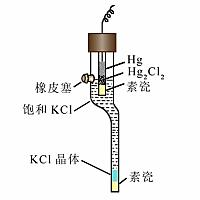
常用的参比电极为甘汞电极,其电位不随被测液中氢离子浓度而改变。pH值测量的实质就是测量两电极间的电位差。
由于测得的玻璃电极电位与溶液的pH成正比,可以通过下列关系式求出pH值:
pH测定值 = pH标准值 - ![]()
用pH计进行测量前,必须先用标准pH溶液校准仪器,然后再进行溶液的pH测定。
通过以上学习,我们认知到pH计一种用于精密测量溶液中的氢离子浓度,即溶液的pH值的仪器,由玻璃电极、参比电极和电流计三部分组成。


