第37-38课时 6.1 认识氧化还原滴定;6.2 氧化还原滴定的原理
一、氧化还原滴定法的基本原理
氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法。与酸碱滴定法和配位滴定法相比较,氧化还原滴定法应用非常广泛,它不仅可用于无机分析,而且可以广泛用于有机分析,许多具有氧化性或还原性的有机化合物都可以用氧化还原滴定法来加以测定。
例如,在酸性溶液中,可以用KMnO4标准溶液定量滴定H2O2,所发生的氧化还原反应是
2 MnO4- + 5 H2O2+ 6H+ = 2Mn2+ + 5O2↑ + 8H2O
上述反应中,KMnO4是氧化剂,在化学反应中得到电子;H2O2是还原剂,在化学反应中失去电子,这样有电子得失的化学反应,属于氧化还原反应。根据滴定消耗的KMnO4标准溶液的体积和浓度,以及H2O2试样的量,计算出H2O2的含量。
又如,测定铁矿石中全铁的含量,可用热浓HCl溶解铁矿石试样,再趁热用SnCl2还原溶液中的Fe3+为Fe2+。然后再用K2Cr2O7标准溶液滴定溶液中的Fe2+,所发生的氧化还原反应是
6 Fe2+ + Cr2O72- + 14 H+ = 6 Fe3+ + 2 Cr3++ 7 H2O
在上述反应中,K2Cr2O7是氧化剂,得到电子;Fe2+是还原剂,失去电子。选用二苯胺磺酸钠做指示剂,滴定终点时,溶液颜色由浅绿色(Fe2+颜色)变为为紫红色。根据滴定反应消耗的K2Cr2O7标准溶液的体积和浓度,以及铁矿石的取样量,就可以计算出铁矿石中全铁的含量。
以上是两个氧化还原滴定分析的应用,从中可以知道,在氧化还原滴定分析中,所发生的化学反应是氧化还原反应,氧化剂在反应中得到电子,还原剂在反应中失去电子;氧化还原滴定需要在一定的条件下进行,氧化还原滴定分析一般也需要用指示剂来确定滴定终点。
二、影响氧化还原反应速率的因素
不同的氧化还原反应,反应速率会有很大的差别。影响氧化还原反应速率的因素,除去参加反应的氧化还原电对本身的性质外,还与反应时外界的条件如反应物的浓度、酸度、温度、催化剂等有关。
(1)反应物的浓度
在氧化还原反应中,由于反应机理比较复杂,所以不能从总的氧化还原反应方程式来判断反应物浓度对反应速率的影响程度。但是一般来说,反应物的浓度越大,反应的速率越快。
例如,在酸性溶液中,K2Cr2O7和KI反应:
Cr2O72- + 6I- + 14H+= 2Cr3+ + 3I2 + 7H2O
增大碘离子浓度或提高溶液的酸度,都可以使反应速率加快。
(2)反应温度
对大多数反应来说,升高溶液的温度,可以提高反应速率。这是由于升高溶液的温度不仅增加了反应物之间的碰撞概率,更重要的是增加了活化分子或活化离子的数目,所以提高了反应速率。通常溶液的温度每升高10℃,反应速率约加快2~3倍。
例如,在酸性溶液中,MnO4- 和C2O42-的反应:
2 MnO4- + 5 C2O42-+ 16 H+ = 2 Mn2+ + 10 CO2↑ + 8 H2O
在室温下,反应速率很慢,加热能加快此反应的进行,但温度不能过高,因为H2C2O4在高温时会分解,通常将溶液加热至75℃~85℃。
值得注意,不是在所有的情况下都允许用升高温度的办法来加快反应速率。有些物质具有挥发性(如I2)或易分解(如H2C2O4),把溶液加热,则会引起挥发或分解而损失;有些物质很容易被空气中的氧所氧化(如Sn2+、Fe2+),如将溶液加热,就会促使它们的氧化,从而引起误差。在这些情况下,如果要提高反应的速率,就只有采用别的方法了。
(3)催化剂
催化剂对氧化还原反应速率有很大的影响,在分析化学里,常常利用催化剂来改变反应速率。催化剂分为正催化剂和负催化剂。正催化剂能加快反应速率,负催化剂能减慢反应速率。负催化剂又称“阻化剂”。
催化反应的历程非常复杂。在催化反应中,由于催化剂的存在,可能新产生了一些不稳定的中间价态的离子、游离基或活泼的中间络合物,从而改变了原来的氧化还原反应历程,或者降低了原来进行反应时所需要的活化能,使反应速率发生变化。
例如,MnO4-和C2O42-的反应在分析化学中应用较多,反应式为
2MnO4- + 5CO42- + 6H+= 2Mn2+ + 10CO2↑+ 8H2O
这个反应的速率较慢,若加入Mn2+,便能催化反应迅速进行。若不加入锰离子而利用MnO4-与C2O42-反应所生成的微量Mn2+作催化剂,反应就可以进行。这种生成物本身就起催化作用的反应叫作自动催化反应。自动催化作用有一个特点,就是开始时的反应速率比较慢,随着生成物逐渐增多,反应速率逐渐加快;经过一个最高点后,随着反应物浓度的减小,反应速率逐渐下降。
(4)溶液酸度
对于有酸参与的氧化还原反应来说,如果氧化还原反应需要消耗一定量的酸,提高溶液的酸度,有利于于提高氧化剂的氧化能力,从而加速氧化还原反应的速率。
三、氧化还原滴定法指示剂
在氧化还原滴定过程中,氧化还原滴定终点的确定方法通常有两种,一种是使用氧化还原指示剂,另一种是用电位法确定终点。最常用的还是可以利用某些物质在氧化还原滴定化学计量点附近时颜色的改变来指示氧化还原滴定的终点,即氧化还原指示剂法确定滴定终点。
1. 指示剂分类
氧化还原滴定法中常用以下几种类型的指示剂。
(1)自身指示剂
在氧化还原滴定中,有些标准溶液或被滴定的物质本身有颜色,如果反应后变为无色或浅色物质,那么氧化还原滴定时就不必另加指示剂。
例如,KMnO4本身显示紫红色,可以用它来滴定无色或浅色的还原剂溶液,在滴定中,MnO4-被还原为无色的Mn2+,滴定到化学计量点时,只要MnO4-稍微过量就可以使溶液显示粉红色,表示已经到达了滴定终点。实验表明,KMnO4的浓度约为2×10-6mol/L,就可以看到溶液呈粉红色。
(2)专属指示剂
在氧化还原滴定中,有的物质本身不具有氧化还原性质,但能与标准溶液或待测定物质作用产生特殊的颜色,从而可以指示滴定终点。
例如,在碘量法中,使用淀粉作指示剂,碘与淀粉可生成深蓝色物质,当滴定到达化学计量点时,若I2完全被还原为I-时,蓝色消失,或稍微过量的I2 (浓度为5×10-6mol/L)即能看到蓝色,反应极灵敏。淀粉是碘量法的专属指示剂。
(3)本身发生氧化还原反应的指示剂
这种指示剂的氧化态和还原态具有不同颜色,在滴定过程中,指示剂由氧化态变为还原态,或由还原态变为氧化态,颜色发生变化可指示终点。
例如,用K2Cr2O7溶液滴定Fe2+,常用二苯胺磺酸钠作指示剂。二苯胺磺酸钠的还原态无色,氧化态为紫红色,故滴定到化学计量点时,稍微过量的K2Cr2O7就能使二苯胺磺酸钠由还原态转变为氧化态,溶液显示紫红色,因此指示终点的到达。
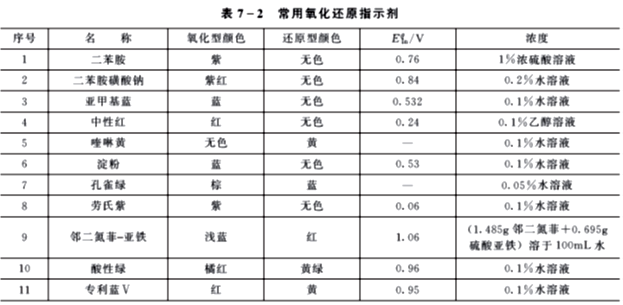
2. 常用氧化还原指示剂
表7-2列出一些重要的氧化还原指示剂。在选择指示剂时,应该使指示剂的条件电势尽量与反应的化学计量点的电势一致,以减小终点误差。
许多氧化还原滴定法的指示剂,尤其是可逆性不太好的指示剂,反应机理较为复杂。例如,常用的二苯胺磺酸盐,它们被氧化后,首先不可逆地形成无色的二苯联苯胺磺酸,接着再进一步被可逆地氧化成紫色的二苯联苯胺磺酸紫。
采用二苯胺类指示剂,常显示出较大的指示剂空白值。这是由二苯胺类指示剂的反应机理的复杂性所引起的。这种指示剂空白值与指示剂用量、滴定剂加入速度、被滴定物浓度及滴定时间等因素有关,故不能单独通过空白试验加以校正。