第31-32课时
5.3 金属指示剂
酸碱滴定中,一般我们都是利用酸碱指示剂颜色的变化来指示滴定终点。那么在配位滴定中,我们利用什么方法来指示滴定终点的到达呢?
配位滴定指示终点的方法与酸碱滴定有类似之处,可用仪器或指示剂两类方法指示终点。其中最重要的是使用金属指示剂指示终点。所谓金属指示剂,是一些结构复杂的有机配位体,它与金属离子形成有色配合物,其颜色与游离指示剂的颜色不同,它能随溶液中金属离子浓度的变化而变色。
配位滴定也需要用指示剂来指示终点。配位滴定中的指示剂是用来指示溶液中金属离子浓度的变化情况,所以称为金属离子指示剂,简称金属指示剂。
金属指示剂是一些有机配位剂,在一定条件下与被滴定金属离子反应,形成一种与其本身颜色不同的配合物:
M + In = MIn
颜色A 颜色B
滴入EDTA时,金属离子逐步被配位,当接近化学计量点时,由于金属离子与指示剂的配合物(MIn)稳定性比金属离子与EDTA 的配合物(MY)稳定性差,已与指示剂配位的金属离子被EDTA夺出,释放出指示剂In,这样就引起溶液的颜色变化:
Min + Y = MY + In
颜色B 颜色A
金属离子显色剂很多,但其中只有一部分能用作金属离子指示剂,一般来说,金属离子指示剂应具备以下条件。
① 在滴定的pH 条件下,显色配合物(MIn)与指示剂(In)的颜色应显著不同。
② 显色反应灵敏、迅速,有良好的变色可逆性。
③ 显色配合物的稳定性要适当。它既要有足够的稳定性,但又要比该金属离子的EDTA配合物的稳定性小。如果稳定性太低,就会提前出现终点,而且变色不敏锐;如果稳定性太高,就会使终点拖后,而且有可能使EDTA 不能夺出其中的金属离子,显色反应失去可逆性,得不到滴定终点。
④ 金属离子指示剂应比较稳定,便于储藏和使用。
除此之外,显色配合物应易溶于水,如果生成胶体溶液或沉淀,则会使变色不明显。
一、金属离子指示剂的选择
与酸碱滴定曲线类似,在化学计量点附近,被滴定金属离子产生“突跃”。因此要求指示剂能在突跃区间内发生颜色变化,并且指示剂变色应尽量与化学计量点的一致,以减小误差。
设被滴定金属离子M 与指示剂形成有色配合物,它在溶液中有下列解离平衡:
MIn + Y = MY + In
考虑到指示剂的酸效应,得到:
K'MIn= [MIn]/([M][In'])
lgK'Min = pM+ [MIn]/[In']
当达到指示剂的变色点时,[Min]=[In'],故此时:
lgK'Min = pM
由于配位滴定中所用的指示剂一般为有机弱酸,存在着酸效应。它与金属离子所形成的有色配合物的条件稳定常数将随着pH 的变化而变化;指示剂的变色点也随pH的变化而变化。因此,金属离子指示剂不可能像酸碱指示剂那样,有一个确定的变色点。
在选择配位指示剂时,必须考虑体系的酸度,使变色点与化学计量点尽量一致,至少应在化学计量点附近的突跃范围内,否则误差太大。如果M也有副反应,则应使二者尽量一致。
虽然选择指示剂可以通过指示剂的有关常数进行理论计算,但是金属离子指示剂的常数尚不齐全,有时无法计算。所以,在实际工作中大多采用实验方法来选择指示剂,即先试验其终点时颜色变化的敏锐程度,然后检查滴定结果是否准确,即可确定该指示剂是否符合要求。
配位滴定中常用的几种指示剂列于表6 3中。
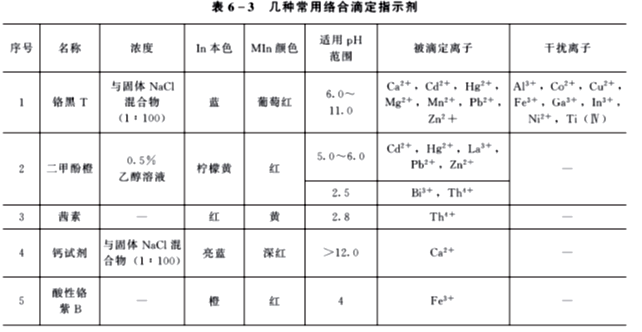
二、指示剂的封闭和僵化
指示剂在化学计量点附近应该有敏锐的颜色变化,但在实际工作中有时发生配合物颜色不变化或变化非常缓慢的现象,前者称指示剂的封闭,后者称指示剂的僵化。
1. 产生指示剂封闭现象的原因
由于溶液中某些离子与指示剂形成的配合物较其与EDTA的配合物更稳定,甚至过量EDTA 也不能夺出MIn中的金属离子使指示剂In释放出来,所以颜色不发生变化,通常可采用适当的掩蔽剂加以消除。例如,Al3+ 、Fe3+、Cu2+、Ni2+、Co2+等离子对铬黑T指示剂和钙指示剂有封闭作用,可用KCN掩蔽Cu2+、Ni2+、Co2+和三乙醇胺掩蔽Al3+、Fe3+。
2. 产生指示剂僵化的原因
由于有些指示剂或MIn配合物在水中的溶解度较小,或因MIn的稳定性稍低于MY的稳定性,使EDTA与MIn之间的置换反应速率缓慢,使终点拖后。此时可加入适当的有机溶剂或加热,来增大MIn配合物的溶解度或加快置换反应速率。如用PAN作指示剂时,加入乙醇或丙酮或加热,可使指示剂颜色变化明显。
除封闭和僵化之外,由于金属指示剂多数是具有共轭双键体系的有机物,容易被日光、空气、氧化剂等分解或氧化;有些指示剂在水中不稳定,日久会分解。所以,常将指示剂配成固体混合物或加入还原性物质,或临用时配制。
5.4 配位滴定法的应用
水的硬度是衡量生活用水和工业用水水质的一项重要指标。如锅炉给水,经常要进行硬度分析,进而为水的处理提供依据,那么如何进行自来水硬度的测定呢?
由于EDTA 能与多种金属离子形成配合物,且具有一定稳定性,所以,使配位滴定法应用非常广泛,自来水硬度的测定就是其中一个典型的应用。
测定水的硬度就是测定水中Ca2+、Mg2+的总含量,在pH=10的NH3-NH4Cl缓冲溶液中,以铬黑T作指示剂,用EDTA标准溶液直接滴定,直至溶液由红色变为蓝色即为终点。
但由于实际测定的分析样品常常是多种离子同时存在,往往互相干扰,所以如何提高配位滴定的选择性是配位滴定中必须解决的重要问题。下面内容中我们将详细学习如何提高配位滴定的选择性及配位滴定法的应用。
一、提高配位滴定选择性的方法
若溶液中同时含有待测金属离子M 和共存离子N,则干扰的情况与两者的K稳及浓度c 有关。一般情况下满足
cMK'MY/cNK'NY ≥105
或
lg(cMK'MY)-lg(cNK'NY)≥5 (即Δlg(cK 稳)≥5)
就有可能通过控制溶液酸度的办法排除干扰。也就是说,在离子M、N共存时,要准确滴定离子M而使离子N不干扰,必须同时满足下列条件:
lg(cMK'MY)≥6
lg(cMK'MY)-lg(cNK'NY)≥5
由以上条件可见,提高配位滴定选择性的主要途径是降低干扰离子N的浓度或配合物NY的稳定性。
(一)控制溶液酸度的方法
由于MY的稳定常数不同,所以滴定时允许的最小pH也不同。溶液中若含有两种或两种以上的金属离子时,可通过控制溶液的酸度,只是其中一种离子形成稳定的配合物,使其他离子不易配位,从而消除了干扰。
值得注意的是,EDTA为多元弱酸,在滴定反应中,无论其存在形式如何,总要释放出H+ ,可用下式表示:
M + HnY = MY + n H (H+的电荷略)
这样,溶液的酸度将随滴定剂的加入而增大,对主反应的进行不利。所以,在配位滴定中酸度的选择非常重要,而酸度的控制也是不可忽视的问题。
此外,配位滴定时溶液的适宜酸度的确定,还应考虑指示剂的颜色变化对pH的要求,以及其他辅助配位体存在的影响等,最后通过实验找出滴定时的最佳酸度条件,并通过加入适当缓冲溶液的办法,来维持滴定过程中所需要的pH条件。
(二)利用掩蔽和解蔽的方法
若被测离子的配合物与干扰离子的配合物的稳定性相差不大,甚至lgK (MY)比lgK(NY)还小,就不能用控制酸度的方法分步滴定M。若加入一种剂试与干扰离子N起反应,则溶液中[N]降低,N对M的干扰作用也就减小,甚至消除,此法称为掩蔽法。按所用反应类型的不同,可分配位掩蔽法、沉淀掩蔽法和氧化还原掩蔽法,其中以配位掩蔽法用得最多。
1. 配位掩蔽法
利用配位反应减低干扰离子的浓度,以消除干扰的方法,称为配位掩蔽法。这是配位滴定中应用最广泛的掩蔽方法。
2. 氧化还原掩蔽法
加入一种氧化剂或还原剂,使之与干扰离子发生氧化还原反应以消除干扰,称为氧化还原掩蔽法。
3. 沉淀掩蔽法
加入能与干扰离子生成沉淀的沉淀剂,并在沉淀存在下直接进行配位滴定,称为沉淀掩蔽法。
由于一些沉淀反应不够完全,特别是过饱和现象使沉淀不易析出;沉淀会吸附被测离子而影响测定的准确度;一些沉淀颜色深、体积较大,也会妨碍终点的观察。故在实际中沉淀掩蔽法应用不多。
二、配合滴定的方法及应用
1. 直接滴定法
直接滴定法是络合滴定中的基本方法。此方法是将试样处理成溶液后,调节至所需要的酸度,加入必要的其他试剂和指示剂,直接用EDTA标准溶液滴定。
采用直接滴定法时,必须符合下列条件:
①被测离子的浓度cM及其EDTA络合物的条件稳定常数K'MY应满足lg(cMK'MY)≥6
的要求,至少应在5以上;
②络合速率应该很快;
③应有变色敏锐的指示剂,且没有封闭现象;
④在选用的滴定条件下,被测离子不发生水解和沉淀反应。
例如:钙含量测定:在水样中加入NaOH至pH≥12,Mg2+ 生成Mg(OH)2,不干扰Ca2+的滴定。再加入少量钙指示剂,溶液中的部分Ca2+与指示剂配位生成配合物,使溶液呈红色。当滴定开始后,不断滴入的EDTA首先与游离的Ca2+配位,至计量点时,则夺取与钙指示剂结合的Ca2+,使指示剂游离出来,溶液由红色变为纯蓝色,从而指示终点的到达。
2. 返滴定法
返滴定法是在试液中先加入已知过量的EDTA 标准溶液,然后用另一种金属盐类的标准溶液滴定过量的EDTA,根据两种标准溶液的浓度和用量,即可求得被测物质的含量。
返滴定剂所生成的络合物应有足够的稳定性,但不宜超过被测离子络合物的稳定性太多,否则在滴定过程中,返滴定剂会置换出被测离子,引起误差,而且终点不敏锐。
返滴定法主要用于下列情况:
①采用直接滴定法时,缺乏符号要求的指示剂,或者被测离子对指示剂有封闭作用;
②被测离子与EDTA的络合速率很慢;
③被测离子发生水解等副反应,影响测定。
例如:由于铝盐与EDTA配位反应较慢,常加入过量的EDTA,然后用Zn2+标准溶液返滴定过量的EDTA。Ba2+的测定也常采用此法。
3. 置换滴定法
利用置换反应,置换出等物质的量的另一种金属离子,或置换出EDTA,然后滴定,这就是置换滴定法。置换滴定法方式灵活多样,通常有以下两种形式。
① 置换出金属离子:M + NL = ML + N
例如,Ag+与EDTA络合物不稳定,不能直接滴定,如果将Ag+加入到Ni(CN)42-溶液中,则
2Ag+ + Ni(CN)42-= 2 Ag(CN)24- + Ni2+ ,在适当条件滴定Ni2+即可求得Ag+的含量。
② 置换出EDTA:MY + L = ML + Y,滴定Y。利用置换滴定法可改善指示剂指示滴定终点的敏锐性。
例如,铬黑T与Ca2+显色不灵敏,但对Mg2+显色较灵敏,在pH=10滴定Ca2+时加入少量MgY,此时发生以下置换反应:
Ca2+ + MgY =CaY(较MgY稳定)+ Mg2+
Mg2+ +EBT =Mg-EBT
滴定时,Y + Ca2+ =CaY;终点时,EDTA + Mg-EBT (显深红色)→MgY + EBT(显蓝色)
4. 间接滴定法
利用间接滴定法可以测定与EDTA络合不稳定的某些金属离子,亦可测定某些非金属离测子。由于间接滴定法操作烦琐,引入误差的机会也较多,故不是一种理想的分析方法。


