第27-28课时
实验项目4-1 容量瓶的使用
4-1-1 容量瓶的试漏与洗涤
在化学分析实验操作中,常常需要用容量瓶来配制标准溶液、稀释溶液、制备待测样品。
容量瓶是为配制准确的一定物质的量浓度的溶液用的精确仪器。它是一种细颈、梨形平底玻璃瓶,由无色或棕色玻璃制成,带有磨口玻璃塞或塑料塞,颈上有刻度,容量瓶也叫量瓶。
当瓶内体积在所指定温度下达到标线处时,其体积即为所标明的容积数,容量瓶常和移液管配合使用,容量瓶上标有:温度、容量、刻度线。
容量瓶有白色容量瓶和棕色容量瓶两种。规格有25mL、50mL、100mL、250mL、500mL、1000mL、2000mL等。

4-1-1 容量瓶的试漏与洗涤
容量瓶在使用前必须进行的洗涤和试漏,如果容量瓶未洗干净或在使用中发生渗水,都会影响实验的结果的准确性。
1、容量瓶的试漏
容量瓶在使用前,必须要进行试漏检查,就是检查容量瓶的瓶塞是否严密、漏液。具体的操作如下:
在容量瓶中加水至标线附近,盖好瓶塞后用滤纸擦干瓶口,然后用左手用食指按住塞子,其余手指拿住瓶颈标线以上部分,右手指尖托住瓶底边缘,将容量瓶倒立180°,保持2min后,不应有液体渗出(可用干滤纸片检查)。


如果不漏液,将容量瓶直立,再把瓶塞转动180°后,盖好瓶塞,再倒立180°,保持2min检查,如果不漏液,方可使用。

为了在使用过程中,容量瓶塞不丢失、不打碎、不与其他容量瓶搞混,避免直接放在实验台面上被玷污,通常用橡皮筋或细绳将瓶塞系在瓶颈上。
2、容量瓶的洗涤
容量瓶是高精度仪器,不能用毛刷刷洗容量瓶的内壁,因为刷洗产生的刮痕会使容量瓶容积增大,影响容量瓶体积计量的精确。
一般先用自来水洗去容量瓶外壁上的可溶性物质、灰尘等污染物,再用毛刷蘸取洗涤液刷洗容量瓶的外壁,然后用洗涤液充分润湿精密玻璃仪器内壁,放置10分钟后,再用自来水将容量瓶内外壁上的洗涤液清洗干净。
将洗净的容量瓶倒置观察1~2分钟,容量瓶内外壁水膜应当分布均匀,不出现收缩现象,不挂水珠。否则,就视为没洗涤干净,重复洗涤过程,直至洗涤干净为止。
最后,用蒸馏水或去离子水润洗仪器2~3次。
如果容量瓶内壁有油污,可以用铬酸洗液泡洗。氧化型杂质就用还原剂去除,碱性氧化物或氢氧化物就用酸去除。
4-1-2 定容操作
1、溶液转移
将引流用的玻璃棒插入容量瓶标线以下接触瓶壁,玻璃棒不能触及瓶口,烧杯嘴靠玻璃棒,让溶液沿着玻璃棒缓缓流下,直到烧杯中的溶液全部转移完毕。用烧杯嘴靠玻璃棒三下,让烧杯中的残留溶液流出入容量瓶,然后将玻璃棒靠三次瓶壁,将玻璃棒移出容量瓶,用烧杯接住玻璃棒。
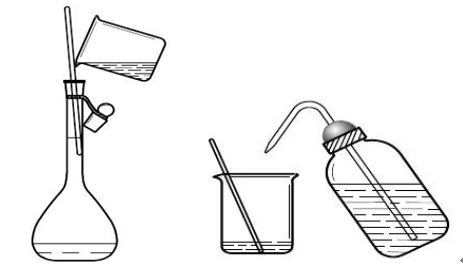
用洗瓶中的纯水冲洗玻璃棒和烧杯内壁,再将溶液引流到容量瓶中,如此反复冲洗玻璃棒和烧杯三次。在转移溶液的过程中不能有溶液溅出,确保溶液都转入容量瓶。
2、稀释溶液
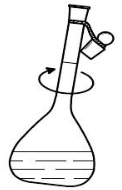
在烧杯中加入足够的纯水,用玻璃棒引流到容量瓶中稀释溶液,直到加入的纯水或蒸馏水稀释到容量瓶2/3或3/4体积时,用右手食指和中指夹住瓶塞的扁头,将容量瓶拿起,按水平方向摇动几次,使溶液初步混匀;继续加纯水或蒸馏水至距离标线约lcm处后,等待1-2min后,让附着瓶颈内壁的溶液流下。
3、定容
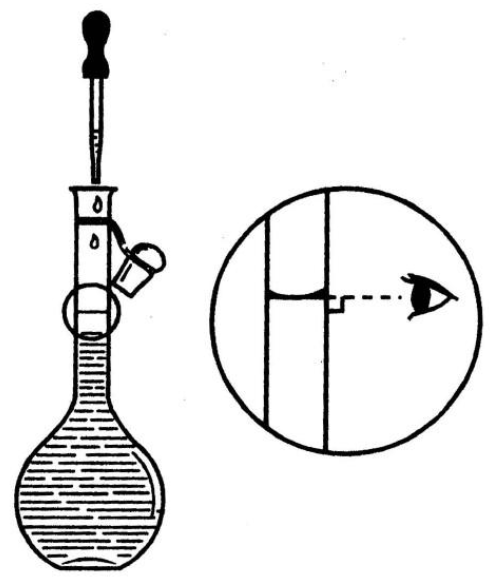
用左手拿起容量瓶瓶颈标线以上部分,保持眼睛视线与刻度线在同一水平线上,用细长的胶头滴管逐滴加水至弯月面下缘恰好与标线相切。
4、摇匀
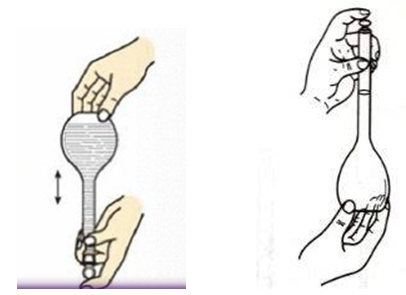
盖上瓶塞,用左手食指按住瓶塞,其余手指拿住瓶颈标线以上部分;用右手的指尖托住容量瓶底边缘,将容量瓶倒立使气泡上升到顶,旋摇容量瓶混匀溶液,然后将容量瓶直立起来,再将容量瓶倒转180°,使气泡上升到顶部,旋摇容量瓶混匀溶液,如此反复操作10次以上。
瓶塞磨口部分的溶液可能还未完全混匀,为此,将瓶塞打开,使瓶塞附近的溶液流下,重新盖好塞子,再倒转旋摇3-5次,让容量瓶内溶液充分混匀。
实验项目4-2 HCl溶液的配制
0.1mol/L HCl溶液的配制步骤:
1、预先在500mL烧杯中倒入100mL左右的纯水或蒸馏水,减小HCl易挥发。
2、用10mL的量筒量取4.2mL的浓盐酸,量筒嘴靠玻璃棒,玻璃棒一端插入到液面以下,一边注入浓盐酸,一边搅拌溶液,直到量筒中所有浓盐酸都加入到烧杯中。
3、用量筒加蒸馏水或纯水释至500mL。
4、用玻棒搅拌均匀,并用玻璃棒引流转入500mL试剂瓶中。
5、摇匀试剂瓶中的HCl溶液。
6、在试剂瓶上贴上试剂标签,注明试剂名称、浓度、配制日期、配制人等信息。


