第25-26课时
5.1 配位滴定概述
配位滴定法,又称络合滴定法,是以生成配合物为基础的滴定分析方法。在配位反应中,作为滴定用的配位剂,可分为无机配位剂和有机配位剂两类。
早在19世纪中叶,无机配位剂就已经应用于滴定分析。例如用AgNO3标准溶液滴定CN-,但是多数无机配合物的稳定常数较小,与金属离子逐级生成MLn 型的多级配合物,此类配合物简单、不稳定,并且由于几种络合物同时存在,无法满足滴定分析的基本条件,无法直接用于定量分析。到20世纪40年代,以氨羧配位剂为代表的有机配位剂开始用于滴定分析,其与金属离子易形成低配位比的螯合物,复杂而稳定,较为常用。
配位滴定法在物质的分离与测定、药物分析、食品检验及环境监测等领域均具有广泛应用。用于配位滴定法的配位反应必须满足以下条件:
① 配位反应必须完全,即配合物的稳定常数要足够大;
② 配位反应有严格的计量关系,产物组成固定;
③ 配位反应速率要快,且有适当的方法指示滴定终点;
④ 配位合反应所形成的配合物最好易溶于水。
因此,尽管能够形成配合物的反应很多,但并非所有的配位反应都适用于配位滴定。
自来水是一种含有一定的钙镁盐类的硬水,有一定的“硬度”,那么我们如何测定自来水中的钙、镁含量呢?胃舒平是一种常用的胃药,药品中的主要化学成分是氢氧化铝,那么如何测定其中铝的含量呢?
自来水硬度和胃舒平中铝含量的测定,都是对样品中金属离子的含量进行测定。测定金属离子最常用的分析方法就是配位滴定法,使金属离子与配位剂形成稳定的配合物,根据配位剂的消耗量计算出金属离子的含量。EDTA作为一种重要的有机配位体,它的性质,它与金属离子形成的配合物有何特点?我们将详细地进行学习。
一、氨羧配位剂
氨羧配位剂是以氨基二乙酸[—N(CH2COOH)2]为基体的配位剂,目前开发的氨羧配位剂有数十种,目前,在配位滴定中广泛应用的氨羧配位剂是乙二胺四乙酸,其缩写为EDTA。
从化学式看EDTA是一种多元酸,常用H4Y表示。但它在水中的溶解度很小,22℃时,100mL水中仅能溶解0.02g,故常用它的钠盐Na2H2Y·2H2O,一般也简称EDTA,它在水溶液中的溶解度较大,22℃时,100mL水中能溶解11.1g,浓度约为0.3mol/L,pH约为4.5。
EDTA在水溶液中,两个羧酸基上的H+可以转移到N原子上,形成双偶极离子。
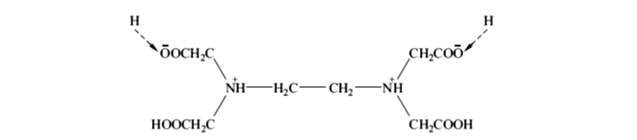
在酸度很高的水溶液中,它的两个羧酸根可以再接受H+ ,形成H6Y2+ ,这样就相当于一个六元酸,有六级解离平衡,Ka为解离常数,各级常数如下:
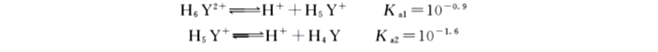
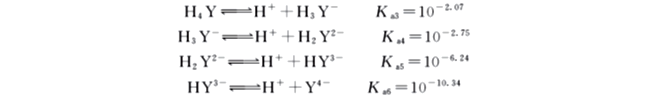
其中Ka1~Ka4分别对应于四个羧基的解离,而Ka5和Ka6则对应于与氨氮结合的两个H+的解离,释出较为困难。由于分步离解,已质子化了的EDTA 在水溶液中总是以7种型体存在:H6Y2+、H5Y+、H4Y、H3Y-、H2Y2-、HY3-、Y4-。其分布系数受pH 的影响,若溶液酸度增大,pH减小,上述平衡向左移动,H6Y2+离子浓度增加;反之,若溶液酸度减小,pH增大,则上述平衡右移,Y4+离子的浓度增加。EDTA 的总浓度c(Y')等于各型体平衡浓度之和,即
c(Y')=c(H6Y2+)+c(H5Y+)+c(H4Y)+c(H3Y-)+c(H2Y2-)+c(HY3-)c(Y4-)
某型体的平衡浓度总浓度的分数,即为该型体的分布分数,以δ表示。当溶液的pH变化时,各型体的分布情况也随着改变,分布分数δ与溶液pH 之间的关系曲线称为分布曲线。如图6-1所示。
从图中可以看出,在不同的pH 时各种型体所占的比例是不同的。pH<1时,EDTA存在的主要型体是H6Y2+;在pH =1~1.6的溶液中,主要以H5Y+形式存在;在pH=1.6~2.0的溶液中,主要以H4Y形式存在;在pH=2.0~2.67的溶液中,主要存在形式是H3Y-;在pH=2.67~6.16的溶液中,主要存在形式是H2Y2- ;在pH=6.16~10.26的溶液中,主要存在形式是HY3-;在pH很大(pH≥12)时,才几乎完全以Y4-型体存在。Y4-的分布分数为
δ(Y4-)=c(Y4-)/c(Y')
EDTA的7种形态中,只有Y4-能与金属形成稳定的1∶1配合物。这是因为多数金属离子的配位数为4或6,而EDTA的分子结构中,具有6个可与金属离子形成配位键的原子,因而EDTA与金属离子配位时能够形成5个五元环结构的螯合物(如图6-2所示),性质非常稳定且易溶于水。
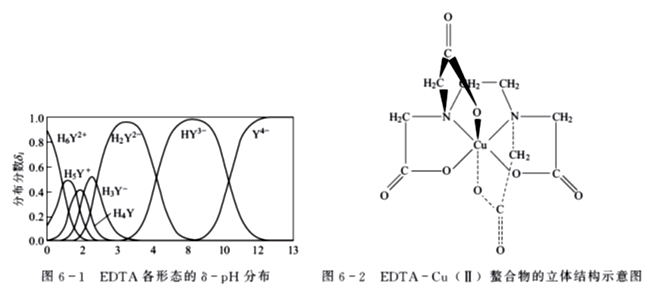
EDTA与金属离子形成的配合物有以下特点:
①EDTA具有广泛配位性,可以和大多数金属离子形成稳定的具有多个五元环螯合物;
②EDTA与大部分金属离子形成配合物的配位一般为1∶1,仅Zr (IV)和Mo (V)与之形成2∶1的络合物;
③EDTA与金属离子形成的配合物大多带电荷,能溶于H2O中,一般配位反应迅速,使滴定能在水溶液中进行;
④EDTA与无色金属离子形成的配合物无色,而与有色金属离子则生成颜色更深的配合物。例如Cu2+显浅蓝色,而CuY2-显深蓝色;Ni2+显浅绿色,而NiY2-显蓝绿色。
二、配合物的平衡常数
1. 稳定常数和不稳定常数
将氨水加到CuSO4溶液中生成深蓝色的[Cu(NH3)4]2+,这类反应称为配位反应。若在[Cu(NH3)4]2+溶液中再加入Na2S溶液,便有黑色的CuS沉淀生成,证明[Cu(NH3)4]2+溶液中还有少量Cu2+存在。这说明Cu2+和NH3配位反应的同时还存在着[Cu(NH3)4]2+的离解反应。配位反应和离解反应的速度相等时,达到了平衡状态,称为配位离解平衡。
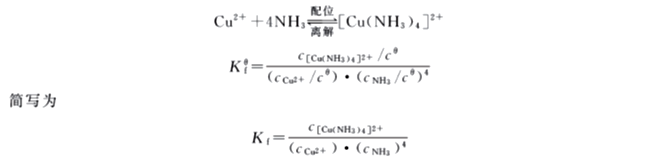
该平衡常数叫作配离子的配位平衡常数。其数值越大,说明生成配位离子的倾向越大,而离解的倾向越小,配离子越稳定,所以常把它称为配离子的稳定常数,一般用Kf表示。不同配离子的Kf值不同。Kf的倒数即为不稳定常数Kd,Kd=1/Kf。同类型的配离子,即配位体数目相同的配离子,不存在其他副反应时,可直接根据Kf值比较配离子稳定性的大小。
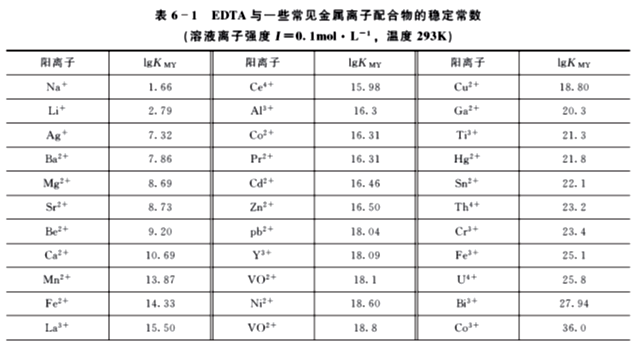
一些金属离子与EDTA形成的配合物的稳定常数如表6-1所示。稳定常数具有以下规律:
①碱金属离子的配合物最不稳定,lg KMY <3;
②碱土金属离子的lg KMY=8~11;
③过渡金属、稀土金属离子和Al3+的lg KMY =15~19;
④三价、四价金属离子及Hg2+的lg KMY >20。
2.逐级稳定常数与累积常数
在溶液中,配离子的生成一般是分步进行的,因此溶液中存在着一系列的配位平衡,每一步都有相应的稳定常数,称为逐级稳定常数。例如:
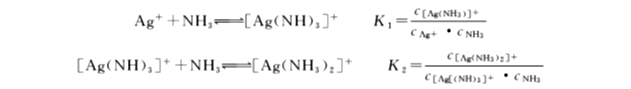
配离子的稳定常数Kf是逐级稳定常数的乘积,即
Kf = K1·K2·K3…Kn
根据化学平衡的原理,利用配离子的稳定常数Kf可以进行有关计算。
3. 溶液中各级配合物的分布
在处理酸碱平衡时,经常要考虑酸度对酸碱各种存在形式的分布的影响。同样,在配位平衡中,也须考虑配体浓度对配合物各级存在形式的分布的影响。
设溶液中M离子的总浓度为cM,配体L的总浓度为cL,M与L发生逐级配位反应如下:
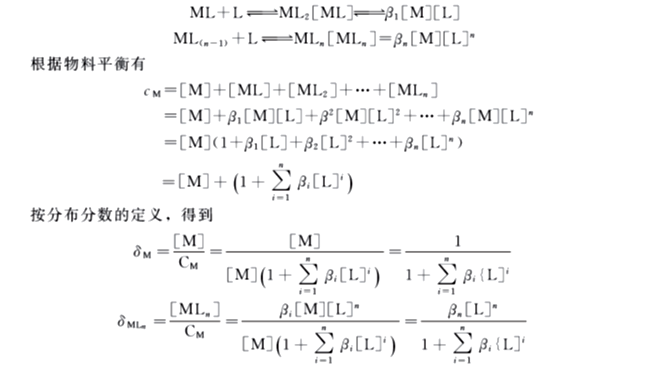
由此可见,δ仅仅是[L]的函数,而与cM无关。
三、配位反应中的副反应系数和条件稳定常数
在配位滴定中,滴定剂Y与金属离子M之间除发生主反应外,M、Y和MY都可能发生副反应,如图6-3所示。
反应物的各种副反应不利于主反应的进行,而生成物的各种副反应则有利于主反应的进行,涉及的各种副反应进行的程度,可由其副反应系数显示出来。
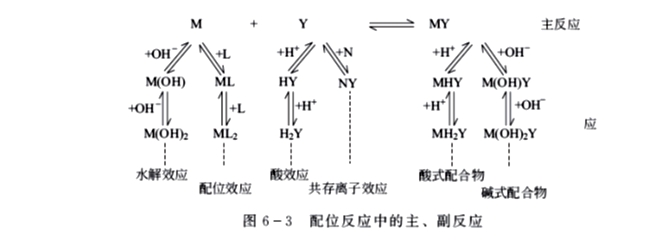
副反应系数表示有副反应发生时,未参加主反应组分M或Y的总浓度[Y']或[M']与平衡浓度[M]或[Y]的比值,用αY或αM来表示。
1.EDTA 的副反应及副反应系数
(1)酸效应及酸效应系数
EDTA在水溶液中不仅以Y4+形式存在,而且随着溶液酸度的增加以各级质子化的形式存在。由于H+与Y之间发生副反应,就使得Y平衡浓度降低,不利于主反应的进行,这种由于H+存在使滴定剂参加主反应能力降低的现象,称为酸效应。H+引起副反应时的副反应系数称为酸效应系数,通常用αY(H)表示。反应通式如下:
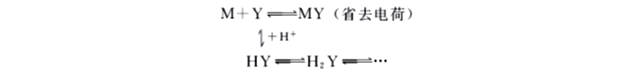
αY(H)表示在一定pH下EDTA的各种存在形式的总浓度[Y']与能参加络合反应的Y4+的平衡浓度[Y]之比:
αY(H)=[Y']/[Y]=1/δY
式中,[Y']=[Y4-]+[HY3- ]+[H2Y2- ]+[H3Y-]+[H4Y]+[H5Y+ ]+[H6Y2+ ]
αY(H)越大,表示Y的平衡浓度越小,其参加主反应的能力降低,即副反应越严重。如果没有发生酸效应,即EDTA全部以Y4+形式存在,则αY(H)=1。
Y的酸效应系数αY(H)仅与溶液的酸度有关,随溶液pH增大而减小,由于αY(H)值的变化范围很大,故取其对数值较为方便。不同pH时的lgαY(H)列于表6-2。
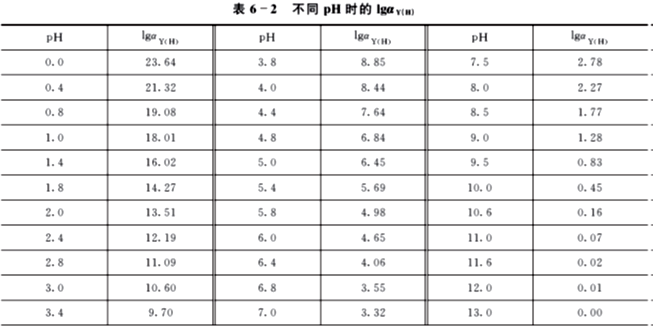
因此,在配位滴定中溶液的pH 不能太低,否则,配位反应就不完全。
(2)Y与共存离子的副反应
若除了金属离子M与络合剂反应外,溶液中共存离子N也能与滴定剂反应,则会降低Y的平衡浓度。共存离子引起的副反应称为共存离子效应,其影响程度的大小用共存离子效应系数αY(N)来衡量。αY(N)定义如下:
αY(N)=[Y']/[Y]=([NY]+[Y])/[Y]=1+KNY[N]
式中,[Y']是NY的平衡浓度与Y的平衡浓度之和,KNY为NY的稳定常数;[N]为N离子的平衡浓度。由上式可知,[N]越大或KNY越大,N 离子对主反应的影响就越严重。
(3)Y的总副反应系数
当反应体系中有共存离子N,又有酸效应时,此时,EDTA的总副反应系数为
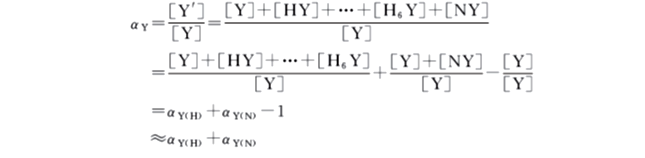
2. 金属离子的副反应及副反应系数
(1)配位效应与配位效应系数
当M与Y反应时,由于其他配位剂L的存在且与M反应,使主反应受到影响,这种由于其他配位剂存在使金属离子参加主反应能力降低的现象,称为配位效应。
配位剂L引起副反应时的副反应系数称为配位效应系数,用αM(L)表示。αM(L)表示没有参加主反应的金属离子总浓度[M']是游离金属离子浓度[M]多少倍,即
αM(L) = [M']/[M] = ([M]+[ML]+[ML2]+… +[MLn])/[M]
αM(L)越大,表示金属离子被配位剂L络合得越完全,即副反应越严重,如果M没有副反应,则αM(L)=1。
(2)金属离子的总副反应系数αM
若溶液中有两种配位剂L和A 同时与金属离子M 发生副反应,则其影响可用M的总副反应系数αM表示为
αM = [M']/[M]
=([M]+[ML]+ … +[MLn])/[M] +([M]+[MA]+…+[MAm])/[M] -[M]/[M]
=αM(L)+αM(A)-1
同理,若溶液中有多种配位剂L1,L2,L3,……,Ln ,同时金属离子M发生副反应,则M的副反应系数αM为
αM =αM(L1)+αM(L2)+…+αM(Ln)-(n-1)
3. 配合物MY的副反应及副反应系数αMY
在较高酸度下,M 除了能与EDTA 生成MY 外,尚能与EDTA 生成酸式配合物MHY,酸式配合物的形成,使EDTA 对M 的总络合能力增强一些,故这种副反应对主反应有利。
在较低酸度下,金属离子还能与EDTA 生成碱式配合物M(OH)Y,碱式配合物的形成,也可以加强EDTA 对M 的络合能力。
形成酸式或碱式EDTA 配合物时的副反应系数为
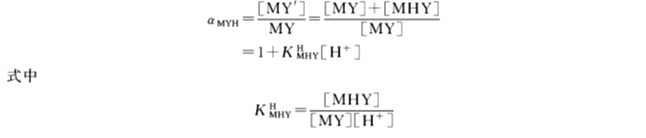
同理得
由于酸式、碱式配合物一般不太稳定,故在多数计算中可忽略不计。
3.条件稳定常数
在没有任何副反应时,金属离子M与EDTA生成MY。若无副反应发生,当达到平衡时KMY是衡量此配位反应进行程度的主要标志。若有副反应发生,将受到M、Y及MY的副反应的影响。
设未参加反应的M 总浓度为[M'],Y的浓度为[Y'],生成的MY、MHY和M(OH)Y的总浓度为[(MY)']。当达到平衡时,可以得到以[M]、[Y]及[(MY)']表示的配合物的稳定常数,即条件稳定常数K'MY:
K'MY= [(MY)]/([M'][Y'])
从以上副反应系数的讨论中可以看出:
[M']=αM[M]
[Y']=αY[Y]
[MY']=αMY[MY]
将这些关系代入上式中,得条件稳定常数的表达式为
K'MY=αMY[(MY)]/(αM[M]αY[Y])= KMYαMY/(αMαY)
取对数,得
lgK'MY = lgK MY - lgαM -lgαY + lgαMY
式中,K'MY表示在有副反应的情况下,配位反应进行的程度。在一定条件下,αM、αY及αMY为
定值,故此K'MY为常数。
在很多条件下,MHY和M(OH)Y可以忽略,故上式可简化为
lgK'MY = lgKMY-lgαM -lgαY(lgαMY可省略)
EDTA能与许多金属离子生成稳定的配合物,它们的KMY一般都很大,有的可高达1030以上,但实际的化学反应中,不可避免地会发生各种副反应,因而条件稳定常数要减小许多。
4.滴定金属离子所允许的最低pH和酸效应曲线
滴定任一金属离子(浓度为0.020 mol/L)的最高酸度(即最低pH)可推导如下:
根据配位滴定的要求,当cM =0.02mol/L 时,lgK'MY≥8 以及只考虑酸效应影响,则
lgK'MY=lgKMY-lgαY(H)
得
lgKMY-lgαY(H)≥8
移项得
lgαY(H)≤lgKMY-8
利用上式可以算出滴定各种金属离子的lgαY(H)值。然后再由表中查出其相应的pH,就是滴定某一金属离子的粗略的最低pH,也就是滴定的最高酸度。
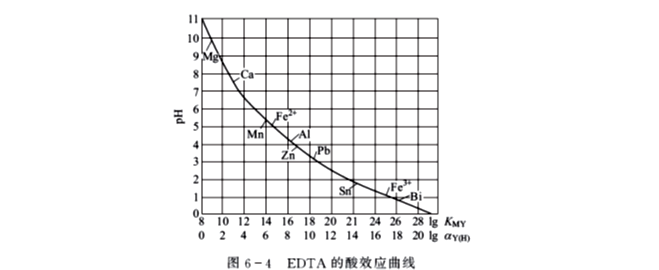
酸效应曲线的用途叙述如下。
(1)确定滴定时所允许的最低pH
从图6-4上可以找出滴定各金属离子所允许的最低pH。如果小于该pH,就不能配位或配位不完全。例如,滴定Fe3+ ,pH必须大于1;滴定Zn2+,pH必须大于4。
实际滴定时所采用的pH要比允许的最低pH高一些,这样可以保证被滴定的金属离子配位更完全。但要注意,过高的pH会引起金属离子的羟基化(或水解),形成羟基化合物(或氢氧化物沉淀)。例如,滴定Mg2+时,pH应大于9.7,但若pH>12,Mg2+ 就会形成Mg(OH)2沉淀而不与EDTA 配位。
(2)判断干扰情况
从图6-4可以判断在一定pH条件下,测定某金属离子时哪些离子有干扰。一般来说,酸效应曲线上位于待测离子下方的离子都干扰测定。
例如,在pH=4时,滴定Zn2+,若溶液中存在Pb2+、Cu2+、Fe3+,则它们都能与EDTA配位而干扰Zn2+ 的测定。
但对于曲线上位于待测离子M上方的离子N,在两者浓度相近时,若lgKMY-lgKNY>5,则可使离子N 不干扰M 的测定。
(3)控制溶液酸度进行连续测定
从图6-4可以看出,通过控制溶液酸度的办法,有可能在同一溶液中连续滴定几种金属离子。一般来说,曲线上相隔较远的离子越容易用控制酸度的方法来进行选择性滴定或连续滴定。
例如,溶液中含有Bi3+、Zn2+、Mg2+,可在pH=1.0时滴定Bi3+,然后调节溶液pH=5.0~6.0时滴定Zn2+,最后在调节溶液pH=10.0~11.0滴定Mg2+。
(4)兼作pH—lgαY(H)表使用
图6-3中第二横坐标是lgαY(H),它与lgKMY相差8个单位,可代替表6-3使用。说明:
①图6-3只适用于金属离子M 和EDTA 的浓度均为0.01mol·L-1的情况。
②酸效应曲线是在一定条件和要求下得出的,它只考虑了酸度对EDTA 的影响,而没有考虑溶液配pH对金属离子M和其所形成的配合物MY的影响,也没有考虑其他配位体存在的影响,所以得出的是较粗略的结果,只供参考。实际分析时应视具体情况灵活运用这些结论。
5.2 配位滴定法的基本原理
配位滴定中,随着滴定剂EDTA的加入,被滴定的金属离子浓度不断减小。与酸碱滴定法类似,在化学计量点附近金属离子的浓度发生突变,表现出量变到质变的突变规律,因此,可根据配位滴定过程中金属离子浓度(以pM = -lg[M]表示)随滴定剂加入量的不同而变化的规律绘制滴定曲线。
一、滴定曲线
1. 示例引入
为了说明滴定过程中被滴定的金属离子浓度值的变化,下面以pH=12.00时,以0.01000 mol/L EDTA 标准溶液滴定20.00mL 0.01000 mol/LCa2+溶液为例,研究滴定过程中pCa的变化情况。滴定过程中除主反应外,只考虑EDTA的酸效应。
已知lgKCaY=10.69,在pH=12.00时,lgαY(H)=0,故
lgK'CaY = lgKCaY-lgαY(H)=10.69
(1)滴定前
pCa2+ 取决于溶液中Ca2+ 的浓度:
[Ca2+] = 0.01000mol/L,pCa = -lg[Ca2+] = 2.00
(2)滴定开始至化学计量点前
pCa2+由未被滴定的[Ca2+]决定。在这一阶段,溶液中未被滴定的Ca2+与反应产物CaY同时存在,由于K'CaY较大,且未被滴定的Ca2+对CaY解离,又起到了抑制作用,故可忽略CaY的解离,用剩余的Ca2+ 浓度代替[Ca2+]。
设加入18.00mL EDTA 标准溶液,则[Ca2+]=5.3×10-4 mol/L,pCa2+=-lg[Ca2+]=5.30
(3)化学计量点
此时,Ca2+ 已全部被配位生成了CaY,溶液中Ca2+ 的浓度可由CaY解离计算:
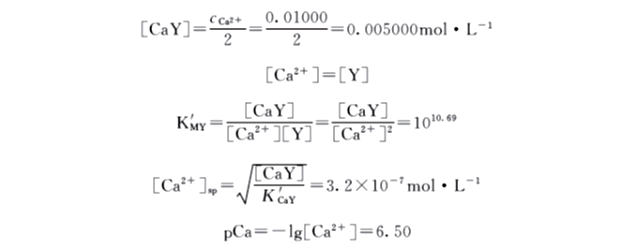
(4)化学计量点后
计量点后,由于溶液中有过量Y存在,抑制了CaY的解离,故
[CaY]=0.005000mol/L
设加入20.02mLEDTA 标准溶液,此时:
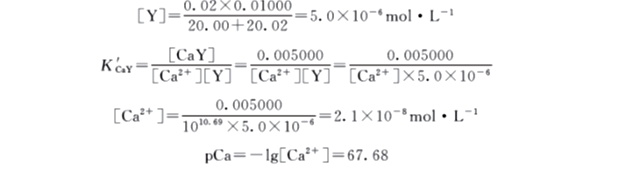
2. 配位滴定曲线
当已知KMY,cM和α值,或已知KMY,cM ,VM和VY时,便可求得[M],以pM对α作图,即得滴定曲线,如图6-5所示。
若M,Y或MY有副反应,则上式中的KMY用K'MY取代, [M]应为[M'];而滴定曲线图上的纵坐标与横坐标分别为pM'及α,设金属离子的初始浓度为0.010mol/L,用0.010 mol/LEDTA滴定,若lgK'MY分别是2,4,6,8,10,12,14,运用配位滴定曲线方程可得到相应的滴定曲线,当lgK'MY=10,cM分别是10-4~10-1mol/L,分别用等浓度的EDTA滴定,所得的滴定曲线如图6-6所示。
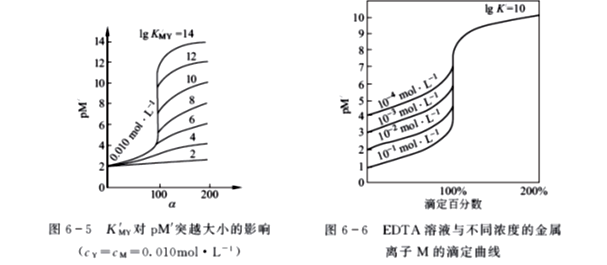
由此可知,影响配位滴定中pM的突跃大小的主要因素是K'MY和cM 。
二、影响配位滴定中pM的突跃大小的主要因素
1. 金属离子浓度对pM'突跃大小的影响
由图6-6可知,cM越大,滴定曲线的起点就越低,pM'突跃就越大,反之,pM'突跃就越小。
2.K'MY对pM'突跃大小的影响
由图6-5可知,K'MY值的大小,是影响pM'突跃的重要因素之一,而值取决于K MY,αM和αY(H)的值,因而:
② KMY值越大,K'MY值相应增大,pM'突跃也大,反之就小;
②滴定体系的酸度越大,pH 越小,αY(H)值越大,K'MY值越小,引起滴定曲线尾部平台下降,使pM'突跃变小。


