第13-14课时 4.1酸碱滴定基本原理;
4.1 酸碱质子理论
酸碱滴定法是利用酸和碱在水中以质子转移反应为基础的滴定分析方法,可用于测定酸、碱和两性物质。其基本反应为
H+ +OH- = H2O
酸碱滴定法也称中和法,是一种利用酸碱反应进行容量分析的方法。用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。
根据标准溶液与被测物质间反应类型的不同,滴定分析法可分为四类:即电解质溶液中的四种反应类型。酸碱滴定法是以酸碱反应为基础的滴定分析方法,是简单、方便、被广泛应用的测定方法之一。那么到底什么样的物质称为酸,什么样的物质是碱呢? 不同酸碱溶液的酸度如何计算呢?
人们对酸碱的认识是经历了一个由表及里,由片面到较全面的过程。即阿仑尼乌斯于19世纪80年代提出的电离理论,布朗斯特于1923年提出的质子理论,后来,路易斯提出的电子理论。在滴定分析中,主要应用酸碱质子理论来定义酸与碱,并进一步应用于酸碱滴定中。下面我们将对酸碱的概念、溶液酸碱度的计算等问题做简要阐述。
一、 酸碱的定义和共轭酸碱对
1. 酸碱电离理论
人们对酸和碱的认识经过了200多年,最初认为能使蓝色石蕊溶液变红的物质是酸;有涩味和滑腻感,能使红色石蕊溶液变蓝的物质是碱。
1884年,瑞典科学家阿仑尼乌斯提出了酸碱的电离理论:
凡是在水溶液中电离产生的阳离子全部是H+的物质叫酸,电离产生的阴离子全部是OH-的物质叫碱。如:
酸: HCl = H+ + Cl-
碱: NaOH = Na+ + OH-
酸碱发生中和反应生成盐和水: NaOH + HCl = NaCl + H2O
反应的实质是:H+ + OH- = H2O
酸碱电离理论提高了人们对酸碱本质的认识,对化学的发展起了很大的作用。根据电离学说,酸碱的强度用电离度α 表示。电离度也称解离度,表示解离的程度,根据解离度的大小把电解质分为强电解质和弱电解质,相应地就有强酸和弱酸,强碱和弱碱之分。强酸和强碱是完全解离的强电解质;弱酸和弱碱是部分解离,属弱电解质。
随着科学的发展,人们认识到酸碱的电离理论也有一定的局限性。首先酸碱电离理论把酸和碱限制在以水为溶剂的系统中,不适用于非水溶液。而近几十年来,科学实验越来越多地使用非水溶剂(如乙醇、苯、丙酮等),电离理论无法说明物质在非水溶剂中的酸碱性。另外电离理论无法说明一些物质的水溶液呈现的酸碱性。例如,无法说明氨水表现碱性这一事实,人们长期错误地认为氨溶于水生成强电解质NH4OH,但实验证明,氨水是一种弱碱。这些事实说明了酸碱理论尚不完善,为此,又产生了其他的酸碱理论,如酸碱质子理论。
2. 酸碱质子理论
1923年是丹麦布朗斯特和英国劳莱共同提出酸碱质子理论。这一理论这样定义酸碱,凡是能给出质子(H+)的物质为酸(包括分子、正离子、负离子);凡能接受质子的物质为碱(包括分子、正离子、负离子)。酸和碱可以相互转化,相互关系表示如下:
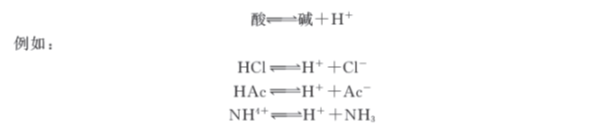
酸和碱之间的这种对应关系称为酸碱的共轭关系。上面式子中左边的酸是右边碱的共轭酸,右边的碱是左边酸的共轭碱。仅相差一个质子的一对酸、碱称为共轭酸碱对,如HCl和Cl-,HAc和Ac-,NH4+和NH3。酸给出质子的倾向愈强,则其共轭碱接受质子的倾向愈弱。即酸愈强,它的共轭碱就愈弱。
以上各个共轭酸碱对的质子得失反应,称为酸碱半反应。由于质子的半径极小,电荷密度极高,它不可能在水溶液中独立存在(或者说只能瞬间存在),因此上述的各种酸碱半反应在溶液中也不能单独进行,而是当一种酸给出质子时,溶液中必定有一种碱来接受质子。例如HAc在水溶液中解离时,溶剂水就是接受质子的碱,它们的反应可以表示如下:
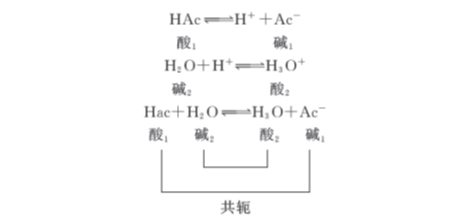
两个共轭酸碱对相互作用而达到平衡。同样,碱在水溶液中接受质子的过程,也必须有溶剂水分子的参与。如:
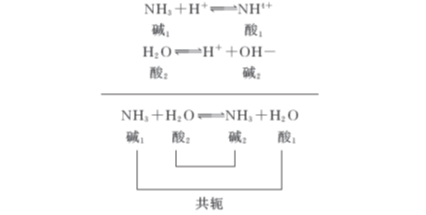
同样也是两个共轭酸碱对相互作用而达到平衡。
二、酸碱反应的实质
根据质子理论,酸和碱的中和反应也是一种质子的传递反应,如:
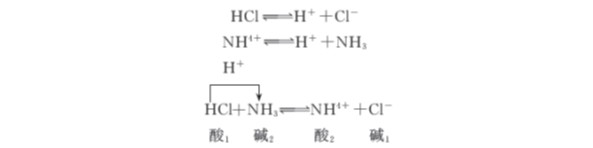
酸碱反应的实质是质子转移,质子传递的最终结果是较强碱夺取较强酸放出的质子而转变为它的共轭酸,较强酸放出质子转变为它的共轭碱。因此,在酸碱质子理论中,没有“盐”这个概念,但由于习惯的原因,以后还要常用到“盐”这个名词。
酸碱反应进行的方向总是由较强的酸与较强的碱作用,并向着生成较弱的酸和较弱的碱的方向进行。酸碱反应进行的程度则取决于两对共轭酸碱给出和接受质子能力的大小。参加反应的酸和碱越强,反应进行得越完全。
酸碱质子理论扩大了酸碱的范围,解释了一些非水溶剂或气体间的酸碱反应,并把水溶液中进行的各种离子反应都归为质子传递的酸碱反应。既阐明了物质的特征,又表现出一定的相对性。另外,质于理论也能应用平衡常数定量地衡量在某溶剂中酸或碱的强度,从而使质子理论得到广泛的应用。但是,质子理论只限于质子的给出和接受,对于无质子参与的酸碱反应仍不能解释,因此,质子理论仍具有一定的局限性。
三、酸碱的强度和溶液的酸碱性
酸碱的强弱取决于物质给出质子或接受质子能力的强弱。给出质子的能力愈强,酸性就愈强;反之就愈弱。同样,接受质子的能力愈强,碱性就愈强;反之就愈弱。也可以这样来描述:酸碱的强度与酸碱在溶剂中解离的完全程度有关,解离程度越大,其酸碱性越强;反之就愈弱。
溶液的酸碱性与溶液的溶质解离后,形成的H+ 或OH-浓度有关,形成的H+ 或OH- 浓度越高,其酸碱性越强;反之就愈弱。
四、水的解离和溶液的pH
1. 水的解离
水在酸碱平衡中起酸或碱的作用,因此水是一种两性物质。
由于水分子的两性作用,一个水分子可从另一个水分子夺取质子而形成H3O+ 和OH- ,即
H2O + H2O = H3O+ + OH-
这种水分子之间的质子传递作用称为质子自递作用。这个作用的平衡常数称为水的质子自递常数,即
Kw = [H3O+ ][OH-]
水合质子H3O+也常常简写作H+ ,因此水的质子自递常数常简写作:
Kw=[H+ ][OH- ] (5-1)
这个常数就是水的离子积,在25℃时等于7×10-14,则pKw=14。
2. 溶液的pH
化学上常用到一些H+浓度很小的溶液,如果直接用H+ 浓度表示溶液的酸碱性,使用和记忆都不方便。为了简便起见,当溶液中[H+ ]或[OH- ]小于1.0mol/L时,常采用pH 值来表示溶液的酸碱性。溶液中H+ 浓度的负对数叫作pH。
pH = -lg[H+] (5-2)
pOH = -lg[OH-] (5-3)
溶液的酸碱性取决于溶液中pH 与pOH 的相对大小。
酸性溶液:[H+]>[OH-],[H+]>1.0×10-7mol/L,则pH<7。
中性溶液:[H+][H-]=1.0×10-7mol/L,则pH=7。
碱性溶液:[H+]<[OH-],[H+ ]<1.0×10-7mol/L,则pH>7。
常温下,在水溶液中,[H+][OH-]=Kw=1.0×10-14,所以pH + pOH = 14.00。
pH 和pOH 一般都在0~14之间,在该范围外,用浓度表示溶液的酸碱性更为方便。
五、溶液的酸碱平衡
1. 解离度和解离常数
(1)解离度
酸碱和其他电解质一样,物质不同在水溶液中的电离程度不同。电离程度的大小可以用解离度(α)来表示。

表5-1是几种常见弱电解质的解离度。
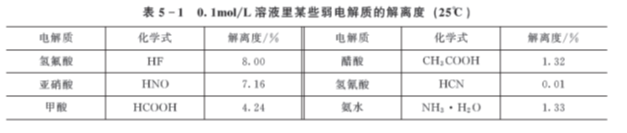
从表5-1可见,在相同条件下,不同弱电解质的解离度不同,这是由弱电解质的相对强弱决定的,一般来说,电解质越弱,解离度越小。
解离度不仅跟电解质的本性有关,还与溶液的浓度、温度等有关。同一弱电解质,通常是溶液越稀,离子相互碰撞而结合成分子的机会越少,解离度就越大。
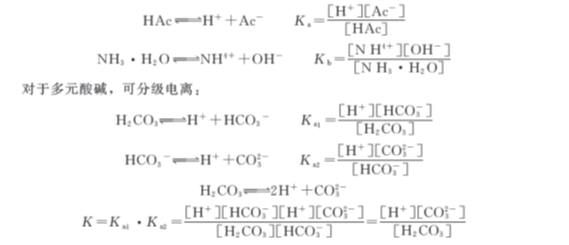
(2)解离常数
解离常数是电解质在溶剂中电离达到平衡时的平衡常数,用K表示。酸的解离常数用Ka表示,碱的解离常数用Kb 表示。例如:
(3)解离度和解离常数的相互关系
解离度和解离常数既有区别又有联系,以醋酸溶液为例:
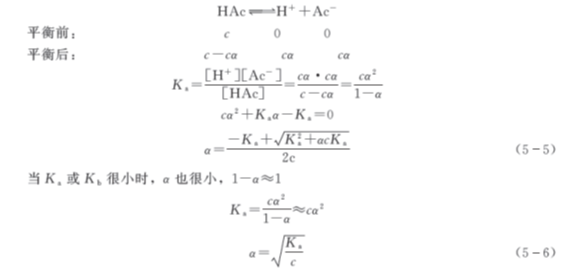
因解离常数是平衡常数,只与温度有关。从上式中可以看出,解离度α和解离常数是正相关的关系;而解离度α与溶液浓度c是负相关的关系,溶液浓度c越小,解离度α越大。
2. 活度与活度系数
对于强酸碱等强电解质,在水溶液中应该完全解离,实验测定时却发现它们的解离度并没有达到100%。这种现象主要是由于带不同电荷离子之间以及离子和溶剂分子之间的相互作用,使得每一个离子的周围都吸引着一定数量带相反电荷的离子,形成了所谓的离子氛。有些阴、阳离子会形成离子对,而影响了离子在溶液中的活动性,降低了离子在化学反应中的作用能力,使得离子参加化学反应的有效浓度要比实际浓度低。这种离子在化学反应中起作用的有效浓度称为活度。一般用下式表示浓度与活度的关系:
α = γ·c (5-10)
式中,α 表示活度,γ 为活度系数,c 是溶液的浓度。
严格地讲,电解质溶液中的离子浓度应该用活度来代替。当溶液中的离子强度<10-4时,离子间牵制作用就降低到极微弱的程度,一般近似认为活度系数γ=1,α=c,所以对于稀溶液(尤其是弱电解质溶液),为了简便起见,通常就用浓度代替活度进行计算。
3. 同离子效应和盐效应
如果在HAc的溶液中加入一些NaAc固体,由于NaAc在溶液中完全电离,使溶液中Ac-离子浓度增加很多,结果使HAc的电离平衡向左移动,从而降低了HAc的解离度。在氨水中加入NH4Cl固体时,情况也与此类似。
我们把这种在弱电解质溶液中加入与弱电解质具有相同离子的强电解质时,使弱电解质的解离度降低的现象,叫同离子效应。
在弱电解质的溶液中加入其他强电解质时,该弱电解质的解离度将会稍稍增大,这种影响称为盐效应。若在0.10mol/L的HAc中加入强电解质NaCl,此时溶液的离子强度I 将增大,γ就不能近似等于1,所以应该用活度进行计算。
盐效应使弱电解质解离度增大并不显著。实际上在HAc溶液中加入NaAc固体除同离子效应外,还有盐效应存在。由于盐效应对电离平衡的影响,在程度上远不如同离子效应,因此可以将盐效应影响忽略,只考虑同离子效应。
4.2 酸碱指示剂
酸碱滴定过程中,一般都是利用酸碱指示剂颜色的突变来指示滴定终点的。那么酸碱指示剂到底是什么物质,又是利用什么原理发生颜色改变而指示终点的呢?
酸碱指示剂一般是有机弱酸或弱碱。当溶液中的pH改变时,指示剂由于结构上的改变而发生颜色的变化,从而会指示滴定终点的到达。
一、酸碱指示剂的变色原理
酸碱指示剂是能随着溶液pH 的变化而改变颜色,从而指示滴定终点的物质,通常是一些结构比较复杂的有机弱酸或弱碱,当溶液中的pH 改变时,指示剂由于结构上的改变而发生颜色的变化。
例如酚酞为无色弱酸,当溶液中的pH 渐渐升高时,酚酞解离并发生结构的改变,成为具有共轭体系醌式结构的红色离子,其解离过程可表示如下:
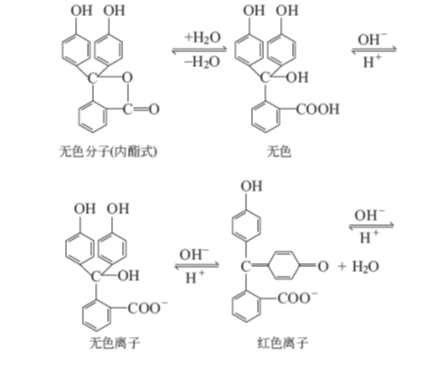
为简便起见,常用HIn表示指示剂的酸式,其颜色称酸式色;In-表示指示剂的碱式,其颜色称为碱式色,在溶液中有下列平衡:
HIn + H2O = H3O+ + In-
酸色 碱色
无色 红色
这个变化过程是可逆的。当H+浓度增大时,平衡向左移动,酚酞主要以酸式结构存在,呈无色;当OH-浓度增大时,平衡向右移动,酚酞主要以碱式结构存在,呈红色。
二、酸碱指示剂的变色范围及影响因素
1. 酸碱指示剂的变色范围
为了进一步说明指示剂颜色变化与酸度的关系,现以弱酸型指示剂酚酞(HIn)为例来说明酸碱指示剂的变色原理。

际观察到的大多数指示剂的变化范围小于2个pH 单位,且指示剂的理论变色点不是变色范围的中间点。这是由于人们对不同颜色的敏感程度的差别造成的。
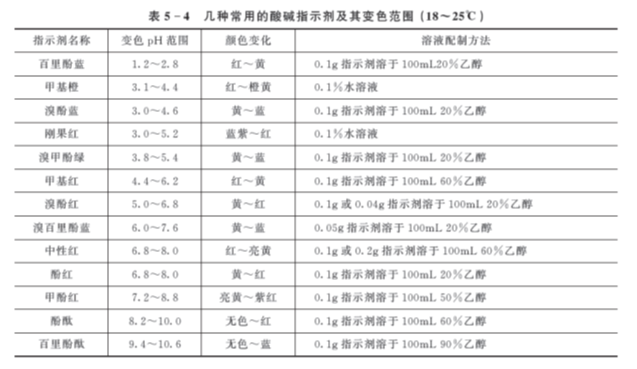
2. 影响指示剂变色范围的因素
(1)指示剂的用量
由于指示剂本身为弱酸或弱碱,用量过多会消耗滴定剂,导致误差增大;另外,指示剂浓度大时将导致终点颜色变化不敏锐。但指示剂也不能太少,否则颜色太浅,不易观察到颜色的变化,通常每10mL溶液加1~2滴指示剂。
(2)温度
温度的变化会引起指示剂解离常数和水的质子自递常数发生变化,因而指示剂的变色范围亦随之改变,对碱性指示剂的影响较酸性指示剂更为明显。例如18℃时,甲基橙的变色范围为3.1~4.4;而100℃时,则为2.5~3.7。
(3)溶剂
不同的溶剂具有不同的介电常数和酸碱性,因而也会影响指示剂的解离常数和变色范围。例如,甲基橙在水溶液中pK HIn=3.4,在甲醇中则为3.8。溶剂不同,必然会引起变色范围的改变。
(4)滴定程序
滴定程序与指示剂的选用也有关系,如果指示剂使用不当,也会影响其变色的敏锐性。例如酚酞由酸式色变为碱式色,颜色变化明显,易于辨别;反之则变色不明显,容易使滴定过量。因此,强酸滴定弱碱时,一般用甲基橙作指示剂为宜。
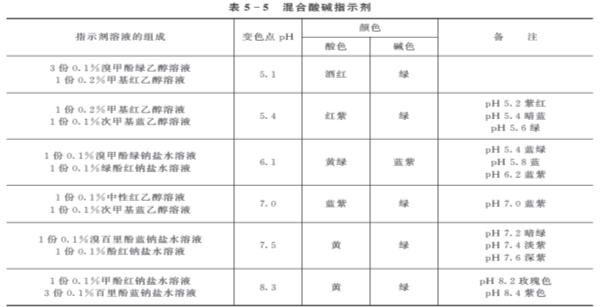
三、混合指示剂
在酸碱滴定中,有时需要将滴定终点控制在很窄的pH范围内,此时可采用混合指示剂。混合指示剂有两类:一类是由两种或两种以上的指示剂混合而成,利用颜色的互补作用,使指示剂变色范围变窄,变色更敏锐,有利于判断终点,减少滴定误差,提高分析的准确度。另一类混合指示剂是在某种指示剂中加入另一种惰性染料配制而成。