第11-12课时 3.3 滴定分析法有关计算
在滴定分析中,要涉及一系列的计算问题,如标准溶液的配制和浓度的标定,标准溶液和被测物质间的计量关系,以及测定结果的计算等。这些都要求我们在计算过程中要做到准确、规范,那么到底应该注意哪些问题呢?
分析化学中要求计算规范、准确,更加突出“量”的概念。“规范”指计算要规范化、程序化(找出化学计量关系,选用合适算式,带入相应数据,按有效数字概念及运算规则计算,结果有单位的,必须写出相应单位)。
设A 为待测组分,B为标准溶液,滴定反应为
aA + bB = cC + dD
则当A 与B按化学计量关系完全反应时,则
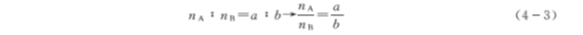
1. 求待测溶液浓度CA
若已知待测溶液的体积VA和标准溶液的浓度CB和体积VB,则

【例4-1】称取0.1258g H2C2O4·2H2O 基准试剂(相对分子质量为126.07),用NaOH 溶液滴定至终点,共消耗19.85mL。计算NaOH浓度。
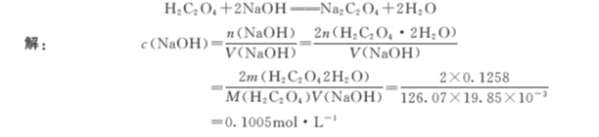
2. 求待测组分的质量mA
从式(4-3)得
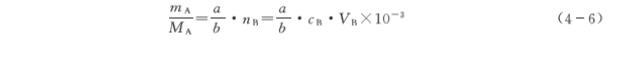

【例4-2】 选用邻苯二甲酸氢钾作基准试剂,标定0.2 mol/L氢氧化钠溶液的准确浓度。今欲把用去的NaOH溶液体积控制为25mL左右,应称取基准试剂多少克? 如改用草酸(H2C2O4·2H2O)作基准试剂,应称取多少克?
解:以邻苯二甲酸氢钾(KHC8H4O4)为基准试剂,其滴定方程式为
KHC8H4O4 + OH- = KC8H4O4- + 2H2O
所以
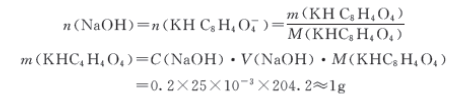
若以H2C2O4·2H2O作基准试剂,滴定反应如下:
H2C2O4 + 2 OH- = C2O24-+ 2H2O
因此 H2C2O4 + 2 OH- = C2O24- + 2H2O
n(NaOH) = 2n(H2C2O4·2H2O)
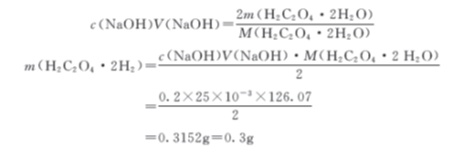
显然,如果选择H2C2O4·2H2O作为基准试剂,称样量少多了,相对来说,称样时的误差就会大些。
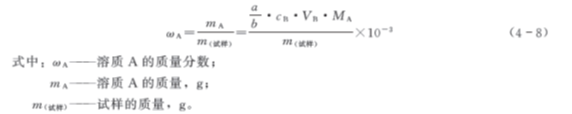
3. 求试样中待测组分的质量分数ωA
溶液中溶质的质量分数是溶质质量与溶液质量之比,计算公式如下:
【例4-3】测定工业用纯碱中Na2CO3的含量时,称取0.2684g试样,用0.1970mol/L盐酸标准溶液滴定,以甲基橙指示终点,用去盐酸标准溶液24.45mL,求纯碱中Na2CO3的质量分数。
解:此滴定方程式为
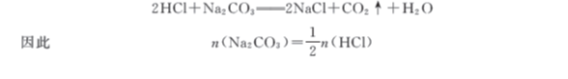

【练习题】
1. 已知浓硝酸的密度为1.42 g/mL,其中含HNO3约为70%,求其浓度。如欲配制1L 0.25mol/LHNO3溶液,应取这种浓硝酸多少毫升?
2. 假如有一邻苯二甲酸氢钾试样,其中邻苯二甲酸氢钾含量约为90%,余为不与碱作用的杂质,今用酸碱滴定法测定其含量。若采用浓度为1.000 mol/L的NaOH 标准溶液滴定之,欲控制滴定时碱溶液体积在25mL左右,则
(1)需称取上述试样多少克?
(2)以浓度为0.0100mol/L的碱溶液代替1.000 mol/L的碱溶液滴定,重复上述计算。
(3)通过上述(1)(2)计算结果,说明为什么在滴定分析中常采用的滴定剂浓度为0.1~0.2mol/L。


