第9-10课时 3.1 滴定分析概述;
3.1滴定分析概述
您一定在电视中看见过这样的镜头:一位身穿白大褂的年轻人端坐在明亮干净的操作台前,左手调控滴定管活塞,右手摇动锥形瓶,全神贯注地盯着溶液,突然间溶液由黄变红,他松了一口气,拿下滴定管,平视滴定管的液面刻度……请问他在做什么?
这就是滴定分析,通过溶液的浓度和体积来计算被测物质含量的一种常用定量分析方法,也是化学分析法中应用广泛的分析类型。在下面的内容中,我们将详细为大家介绍滴定分析的相关知识。
1. 定量分析概述
定量分析是用化学分析方法准确测定物质中各成分(元素或基团)的含量或物质纯度的过程,常用方法可以分为以下几种。
(1)重量分析
重量分析又称重量法,它既可以是将待测组分经分离并灼烧至具有一定组成的物质称重测定,也可以是加入适宜试剂使待测组分成为挥发物质逸去,从失重求得其含量。
(2)容量法
容量法又称滴定分析法,它是以计量标准溶液的体积和浓度来完成测定的方法,即先将待测物质或元素制成溶液,然后向此溶液中逐滴加入与该待测组分有定量反应关系的标准溶液,直至全部待测组分刚好反应完毕(以指示剂指示)为止,从所消耗的标准溶液体积、浓度和试样的取样量,计算该待测组分含量。容量分析包括酸碱滴定、氧化还原滴定、配位滴定和沉淀滴定,以及非水滴定、光度滴定、电位滴定等。
(3)比色法和分光光度法
在含待测组分的试液中,以待测组分本身的颜色,或加入某种试剂使形成一定的有色物质,然后与相应的已知浓度的标准系列比较,进行测定。直接用眼睛观察,或用光电比色计测量颜色深浅,称为比色法。用分光光度计测量时,称为分光光度法。其他方法都是以化学反应为基础的定量分析方法。另外还有一种半定量分析法,其准确性比定量分析稍差,但快速简便,适用于不要求很准确含量测定的情况,或试样少而又无理想的定量分析方法可采用的情况。
2. 滴定分析概述
滴定分析法是定量分析法中最重要的一类分析方法,又称为容量分析法。该方法是将一种已知准确浓度的滴定剂(标准溶液)滴加到被测物质的溶液中,直到所加的滴定剂与被测物质按一定的化学计量关系反应为止,然后依据所消耗标准溶液的浓度和体积,计算被测物质的含量。
滴定分析法具有以下特点:
① 加入标准溶液物质的量与被测物质的量恰好是化学计量关系;
② 适于组分含量在1%以上各种物质的测定;
③ 快速,准确,仪器设备简单,操作简便;
④ 用途广泛。
(1)滴定分析常用术语
滴定:滴加标准溶液的操作过程称为滴定。通常使用滴定管进行滴定。滴定时发生的化学反应称为滴定反应。
化学计量点:滴加标准溶液与被测组分恰好反应完全的点,称为化学计量点。
指示剂:一种能够通过颜色的改变来指示终点到达的试剂称为指示剂。
滴定终点:指示剂刚好发生颜色变化而停止滴定的点称为滴定终点。
终点误差:由于滴定终点和化学计量点不一致所引起的误差称为终点误差或滴定误差。
(2)滴定分析法的类型
根据滴定分析所利用的化学反应类型不同,可将滴定分析法分为酸碱滴定法、配位滴定法、氧化还原滴定法和沉淀滴定法四类。
①酸碱滴定法
这是一类以质子传递反应为基础的滴定分析法。对于一般的酸、碱及能与酸碱直接或间接发生质子转移的物质可用酸碱滴定法测定。
例如:
强酸强碱滴定H+ +OH- = H2O
强酸滴定弱碱H+ + A- = HA
强碱滴定弱酸OH- + HA = A- + H2O
②配位滴定法
这是一类以配位反应为基础的滴定分析法,可用于金属离子的测定。在配位滴定中常用EDTA 为滴定剂,其滴定反应为
Mn+ + Y4-= MY(n-4)+
③氧化还原滴定法
这是一类以氧化还原反应为基础的滴定分析法。常见的氧化还原滴定法有高锰酸钾法、重铬酸钾法、碘量法等。
例如:
2MnO-4 + 5H2C2O4+ 6H+ = 2Mn2+ + 10CO2↑ + 8H2O
Cr2O27- + 6Fe2++ 14H+ = 2Cr3+ + 6Fe3+ + 7H2O
④沉淀滴定法
这是一类以沉淀反应为基础的滴定分析法,可用于Ag+ 、CN- 、SCN- 及卤素等离子的测定。如“银量法”:
Ag+ + X- = AgX
(X- :Cl- 、Br- 、I- 、CN- 、SCN- )
(3)滴定分析要求
滴定分析时,一般是将滴定剂由滴定管逐滴滴加到盛有被测溶液的锥形瓶中,此操作过程称为滴定。当加入的滴定剂的物质的量与被测物的物质的量正好符合化学反应式所表示的化学计量关系时,滴定反应就达到了化学计量点。
为了确定该点,常需借助指示剂颜色的变化来判断。当指示剂在化学计量点附近变色时停止滴定,称为滴定终点。但滴定终点实际测量值与化学计量点(理论值)往往不完全一致,由此而产生的误差称为终点误差(滴定误差)。
为保证滴定分析的准确度,用于滴定分析的反应,须符合下列要求:
① 滴定剂与被测物质必须按照化学反应方程式定量地进行反应,且不发生副反应,通常要求反应的完全程度达99.9%以上;
② 反应必须迅速,要求能瞬间完成,对于反应速率慢的,可通过加热或加催化剂等来加快反应速率;
③ 有简单可靠的方法确定终点,如有合适的指示剂等。
4. 滴定分析方式
①直接滴定法
如果滴定反应能满足滴定分析的要求,就可以采用标准溶液对试样进行直接滴定,称为直接滴定法。此方法是滴定分析中最常用和最基本的滴定方式,如用HCl标准溶液滴定NaOH。
②返滴定法
若滴定反应速率较慢或待测物是固体时反应不能立即完成,或是滴定终点没有合适的指示剂,则不能用直接滴定法,易采用返滴定法,即在被测物中先加入已知过量的第一种滴定剂,待反应完成后,再用第二种滴定剂滴定剩余的第一种滴定剂。
例如,Al3+ 与EDTA 配位反应速率很慢,可向Al3+ 溶液中加入已知过量的EDTA 标准溶液并加热煮沸,待Al3+与EDTA 反应完全后,用标准Zn2+ 或Cu2+ 溶液滴定剩余的EDTA。
③置换滴定法
对于不能确定的反应式,或伴有副反应发生的反应,也不能用直接滴定法,此时可采用间接滴定与该物质反应所生成的另一种物质,此方法称为置换滴定法或取代滴定法。如Ag+ 与EDTA 的反应不稳定,可先将Ag+和Ni(CN)24-反应而定量地转换出能被EDTA滴定的Ni2+ ,然后用EDTA 滴定置换出的Ni2+ ,根据EDTA 的消耗量及Ag+ 和Ni2+的相当量关系即可求出Ag+ 的量。
④间接滴定法
某些被测物质虽然不能直接与滴定剂反应,然而可通过适当的化学反应将其转变成可被滴定的物质,即用间接法滴定。如Ca2+ 并不能用KMnO4标准溶液直接滴定,但将其定量地沉淀为CaC2O4,过滤洗净后,溶于稀H2SO4中,即可用KMnO4溶液滴定C2O24-,从而间接地测定出Ca2+ 的含量。
3.2 滴定分析标准溶液
滴定分析法是一类应用广泛的分析方法,是根据标准溶液浓度和消耗体积来计算被测物质含量的化学分析法。标准溶液浓度的准确与否,会直接影响测定结果的准确性。在实际的测定过程中,我们应该依据什么来确定标准溶液浓度的大小和进行标准溶液的配制呢?
在滴定分析中,我们应当根据试样的成分和性质,对分析结果准确度的要求,滴定终点的敏锐程度等因素来确定标准溶液浓度的大小。根据物质的性质,采用直接法或间接法进行溶液的配制。
1. 标准溶液
(1)标准溶液浓度大小选择的依据如下:
① 滴定终点的敏锐程度;
② 测量标准溶液体积的相对误差;
③ 分析试样的成分和性质;
④ 对分析结果准确度的要求。
(2)配制标准溶液的方法
①直接法
准确称量一定量的基准物质,溶解于适量溶剂后定量转入容量瓶中,定容,然后根据称取基准物质的质量和容量瓶的体积即可算出该标准溶液的准确浓度。
②间接法(标定法)
先配制成近似浓度,然后再用基准物或标准溶液标定。例如:如需配置0.1mol/L的NaOH,先配成约0.1mol/L的溶液,然后再用邻苯二甲酸氢钾(C6H4COOHCOOK)标定。
注意:标定一般要求至少进行3~4次平行测定,相对偏差在0.1%~0.2%之间。
(3)基准物质
基准物质是用于直接配制标准溶液或标定溶液准确溶度的物质,基准物质应满足以下要求。
① 组成恒定:实际组成与化学式符合。若含结晶水,其含量也应与化学式相符。
② 纯度高:一般纯度应在99.9%以上,其杂质含量至少应少到滴定分析所允许的误差限度以下。
③ 性质稳定:保存或称量过程中不分解、不吸湿、不风化、不易被氧化等。
④ 具有较大的摩尔质量:称取量大,称量误差小。
⑤ 使用条件下易溶于水(或稀酸、稀碱)。
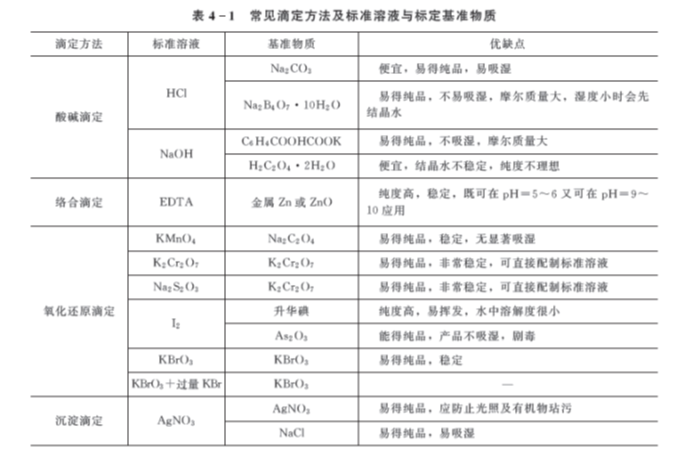
表4-1给出的是常见滴定方法及标准溶液与标定基准物质。
2. 标准溶液浓度表示方法
标准溶液浓度表示方法主要有以下两种。
(1)物质的量浓度
物质的量浓度算式如下:
CB=nB /V (4-1)
式中:CB———B物质的量浓度,mol/L;
nB———B物质的量,mol;
V———溶液的体积,L。
(2)滴定度
滴定度指与每毫升标准溶液相当的被测物质的质量,用T被测物/滴定剂表示。
例如:测定铁含量的KMnO4标准溶液,其滴定度可用TFe/KMnO4表示。
对一个化学反应:aA(被测组分)+bB(标准溶液) =Cc + dD,有
mA/MA=a/b ·CBVB/1000 (4-2)
式中:mA———A物质的质量,g;
MA———A 物质的摩尔质量,g/mol;
VB———B标准溶液的体积,mL。
根据滴定度T的定义有
TA/B = mA/VB =a/b·CB MA /1000
式中各物理量的含义同前。


