第7-8课时
2.2 有效数字及计算规则
2.2.1有效数字
1. 有效数字的意义
有效数字它是用来表示量的多少,同时反映测量准确程度的各种数字称为有效数字。具体说来,有效数字就是指在分析工作中实际上能测量到的数字。
如在滴定终点记录滴定管读数时,A读数为25.65mL,B读数为25.64mL,C读数为25.66mL。这些数中,前三位数字都是很准确的,是根据滴定管刻度读取的,最后一位是从最小刻度间估读出来的,所以每个人读出的数会有微小的差别。最后一位也称可疑数据,但它并不是臆造出来的,故记录时应保留。此时,包括最后一位可疑数据在内的所有数据都是有效数据,对于可疑数据,除非特别说明,通常可以理解为它存在±1个单位误差。
2.确定有效数字的原则
在定量分析中,要求记录的数据和计算结果,不仅都必须是有效数字,而且必须与所用的方法和仪器的精确程度相适应。任意增加和减少有效数字的做法都是不正确的。确定有效数字时应遵循以下原则。
① 一个量值只保留一位不确定的数字,且只能保留一位。阿拉伯数字包括0在内,均可作为有效数字,但当0只是作为定小数点位置时不是有效数字,如1.00中有三位有效数字,0.10中有两位有效数字,而0.01中只有一位有效数字。
② 分析化学计算中分数和整数可视为有足够有效位数,即不根据它来确定有效数字位数。
③ 若某一数据首位有效数字大于等于8,则有效数字的位数可多算一位。如8.54是三位有效数字,但可作四位有效数字看待。
④ 对数的有效数字位数按尾数计(小数部分才是有效数字,且全是有效数字)。如pH=1.03,pKa(HAC)=4.74中的有效数字位数均为2位。
⑤ 有关化学平衡的计算,可根据具体情况保留两位或三位有效数字。pH 计算时,通常取一位或两位有效数字即可。在表示相对误差或偏差时,一般取一位,最多取两位有效数字,且取舍时一律采取进制,而非“四舍六入五留双”的原则。
⑥ 对于高含量组分(w >10%),分析结果一般保留四位有效数字。对于中等含量组分(1%<w<10%),一般保留三位有效数字。对于微量组分(w <1%),一般保留两位有效数字。
3. 有效数字修约规则
在处理数据过程中,各测量值有效数字位数可能不同,为计算准确,须对其有效数字进行确定,之后将它后面的多余数字舍弃,该过程称为修约。
国标GB1.1—1981中规定,有效数字的修约规则为“四舍六入五留双”。当尾数(欲舍弃数字的第一位数)≤4时舍弃;当尾数≥6时则进位;当尾数=5时,若“5”后的数字为“0”,则按“5”前面为偶数者舍弃,为奇数者进入,使欲保留的数字为偶数;若“5”后有不为“0”的数字,则不论“5”前面为偶数或奇数均进入。
【例3-2】 欲保留4位有效数字,对以下数字进行数据修约:
3.1414, 3.1455, 3.1445, 3.1466, 3.1451, 3.1357
解:将原始数据修约成为4位有效数字:
3.1414→3.141; 3.1455→3.146; 3.1445→3.144; 3.1466→3.147; 3.1451→3.145;
3.1357→3.136
注意:每个原始数据只能修约一次,而不能连续修约,即不能3.1455→3.146→3.15而应一次修约为3.14。
“4舍6入5成双”,<=4的都舍掉,>=6都进一位;如果是5,升上去是双数,就升上去;升上去成为单数,就舍掉。就是这样的
12.355=> 4位有效数字,最后一个5升上去就成了12.36,6是偶数,所以就要升上去哦!
2.2.2有效数字运算规则
在分析结果的计算中,每个测量值的误差都要传递到结果中。因此必须应用有效数字的运算规则,合理取舍各数据有效数字的位数。
1. 加减法
当几个数据相加或相减时,它们的和或差的有效数字位数的保留,应以各数中绝对误差最大,即小数点后位数最少的那个数为依据。
在有效数字中,小数点后位数越少,结果的绝对误差越大。
【例3-3】 1.52 25.64
+) 0.476 -) 0.0121
1.996→2.00 25.6279→25.63
在加减法运算中只能确定小数点的位置,不能直接确定有效数字的位数。
2. 乘除法
当几个数据相乘或相除时,它们的积或商的有效数字位数的保留,应以其中相对误差最大,即有效数字位数最少的那个数为依据。
在有效数字中,有效数字位数越少,结果的相对误差越大。
【例3 4】 用有效数字运算规则计算下列各式:
(1)2.187×0.854+9.6×10-2-0.0326×0.00814
(2)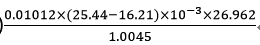
(3)PH=8.23,求c(H+ )=?
解 (1) 原式= 1.868 + 0.096 - 0.000265 =1.964
(2) 原式 = 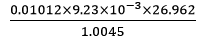 =2.507×10-3 = 2.51×10-3
=2.507×10-3 = 2.51×10-3
(3) c(H+) =10-8.23 = 5.9×10-9 (mol/L)
现在,计算器的应用很普遍,而且计算器上显示的数值位数较多,在使用计算器计算结果时,特别要注意最后计算结果有效数字位数,应根据有关规则进行取舍保留,切记不可全部照抄计算器的所有数字或任意取舍计算结果的有效数字位数。


