
★掌握四个量子数的取值及其物理意义,量子数组合和轨道数的关系;原子轨道、电子云的角度分布;基态原子核外电子排布遵守的三条规律(Pauli不相容原理,能量最低原理,Hund规则);
★熟悉原子轨道和概率密度的概念;原子轨道的角度分布图、径向分布函数图的意义和特征;熟悉电子组态与元素周期表的关系,有效核电荷、原子半径及电负性变化规律;
★了解氢原子的Bohr模型;电子的波粒二象性,测不准原理;电子云的径向分布;元素性质的周期性变化规律;元素和人体健康。

1803年英国科学家道尔顿提出了著名的原子学说:一切物质都是由分子组成的,分子是保持原有物质一切化学性质的最小颗粒;各种分子又是由更小的粒子—原子组成的;
1897年,英国物理学家汤姆逊发现了电子,并确认电子是原子的组成部分;(“枣糕模型”:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多带负电的电子)
1911年,英国物理学家卢瑟福提出了行星原子轨道模型;
1913年,年轻的丹麦物理学家玻尔在卢瑟福原子结构模型的基础上,建立了玻尔原子结构模型,成功解释了氢光谱,推动了原子结构理论的发展。
1911年 英国物理学家Rutherford E根据α粒子散射实验,提出了 原子的有核模型(nuclear model),即“行星系式”原子模型 :原子核好比是太阳,电子好比是绕太阳运动的行星,电子绕核高速运动。
Rutherford E的模型存在一个解决不了的问题:电子在核外空间有怎样的状态?根据他的模型,绕核运动的电子会连续地辐射电磁波,得到连续光谱,并且因电磁辐射而损失能量的电子会堕入原子核内。但事实是原子光谱是线性光谱,原子是稳定的。
解决这一矛盾的是丹麦科学家Bohr N,他借助Plank关于热辐射的量子理论,应用于原子中电子的运动,建立了氢原子模型。
人们用眼睛能观察到的可见光的波长范围是400—760 nm。当一束白光通过石英棱镜时,不同波长的光由于折射率不同,形成红、橙、黄、绿、青、蓝、紫等没有明显分界线的彩色带状光谱,这种带状光谱称为连续光谱。
连续光谱
气态原子被火花、电弧或其他方法激发产生的光,经棱镜分光后,得到不连续、有明显分界的线状光谱,这种线状光谱称为原子光谱。
氢原子光谱及实验示意图
Bohr在1913年提出Bohr假定:
1、能级假说
核外电子在一定的轨道上运动,在这些轨道上运动的电子不放出能量也不吸收能量,电子处于某种“定态”(stationarystate)。轨道上电子有特定的能量值,称为“能级”(energy level)。核外电子能量为
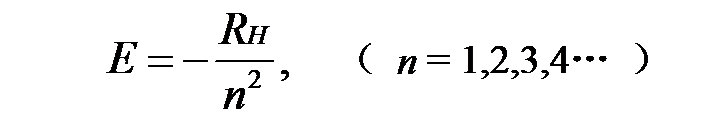
式中RH是常量 ,值为2.18×J,n称为主量子数,取整数值。n=1时能量最低,称为原子的基态,其它能量较高的状态都称为激发态。
2、能级间的跃迁
当电子的能量由一个能级改变到另一个能级,称为跃迁。电子跃迁所吸收或辐射光子的能量等于电子跃迁后的能级( E )与跃迁前的能级( E
)的能量差: hν=E
-E
式中ν是光子的频率,h为普朗克常量,等于6.626×10-34J·s
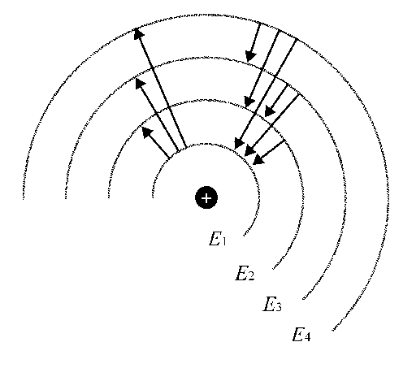
氢原子能级图
玻尔理论成功地解释了原子稳定存在的事实和氢原子光谱:
◆ 在正常状态时,核外电子处于最低的基态,在该状态下运动的电子既不吸收能量,也不放出能量,电子的能量不会减少,因此不会落到原核上,原子不会毁灭。
◆ 原子从外界接受能量时,电子就会跃迁到能量较高的激发态。而处于激发态的电子是不稳定的,它会跃迁回能量较低的轨道 ,同时将能量以光的形式发射出来 ,发射出的光的频率决定于跃迁前后两个轨道间的能量差。由于轨道的能量是不连续的,所发射出的光的频率也是不连续的,因此得到的氢原子光谱是线状光谱。

1923年,法国物理学家de Broglie L 在光的波粒二象性启发下,提出了所有微观粒子如电子、原子等也具有波粒二象性 。他将反映光的二象性的公式应用到微粒上,导出了微观粒子具有波动性的de Broglie关系式:
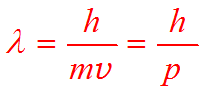
p:微粒的动量
m:微粒的质量
v:微粒的运动速度
λ:微粒波的波长
贝尔电话实验室的Davisson C J和Germer L H用电子束代替X射线通过一薄层镍的晶体 (作为衍射光栅),投射到照相底片上,得到了完全类似单色光通过小圆孔那样的衍射图象。
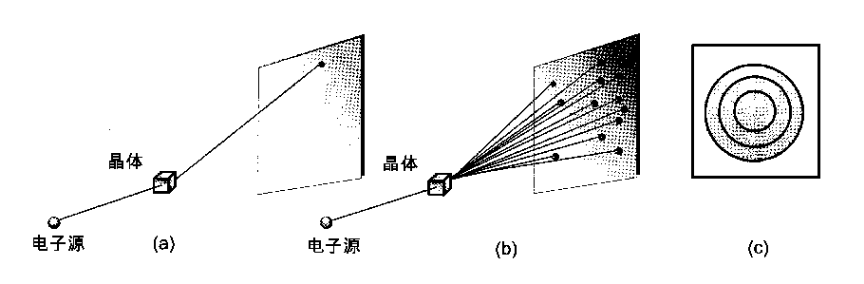
电子衍射图
衍射图像上,亮斑强度大的地方,电子出现的概率大,反之,电子出现少的地方,亮斑强度就弱。

电子衍射图
电子波是概率波,反映电子在空间各区域出现的概率大小。

Heisenberg不确定原理:无法同时确定微观粒子的位置和动量,它的位置越准确,动量(速度)就测得越不准。反之,它的动量测得越准确,位置就越不准确。
x·△px≥h/4π
△ x:为x方向坐标的测不准量(误差)
△ px:为x方向的动量的测不准量
h:是普朗克常量。
对于质量为0.01 kg 的子弹,运动速率为1000m·s,若速率的不确定程度为其运动速率的 0.1% ,则其位置的不确定程度为。
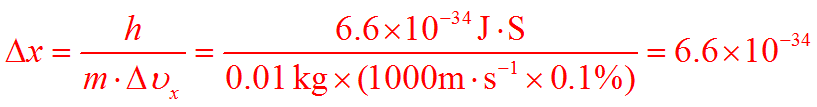
宏观物体的位置不确定程度Δx = m就已经很准确了,这样小的位置不确定程度可以忽略不计。



