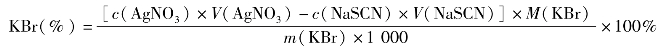反应中生成碘遇淀粉变为蓝色,如果在反应物中预先加入淀粉指示剂,则淀粉变蓝色所需要的时间t可以用来表示反应速率的大小。
一般增加反应物的浓度,反应速率加快。增加反应物的浓度,平衡正向移动。如CoCl2溶液中,当用滴管滴加浓HCl溶液数滴,溶液颜色会从红变蓝,再加水稀释,溶液颜色又会从蓝变红。反应式如下:
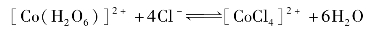
改变反应物或生成物浓度,会使平衡移动,从而使溶液改变颜色。
温度可显著地影响化学反应速率,对大多数化学反应来说,温度升高,反应速率增大。升高温度,平衡向吸热方向移动。
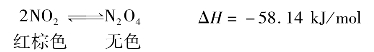
催化剂可大大改变化学反应速率,催化剂与反应系统处于同相,称为均相(或单位)催化,在KMnO4和H2C2O4的酸性混合溶液中,加入Mn2+可增大反应速率,该反应的反应速率可由KMnO4的紫红色退去时间长短来指示。
反应表示如下:
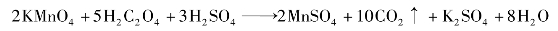
催化剂与反应系统不为同一相,称为多相催化,如H2O2溶液在常温下不易分解放出氧气,而加入催化剂MnO2则H2O2分解速率明显加快。
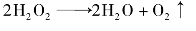
3.仪器及试剂
(1)仪器
大试管、量筒(10mL)、秒表、玻璃棒、烧杯(200mL)、酒精灯、温度计(100℃)、二氧化氮平衡仪等。
(2)试剂
MnO2固体粉末(分析纯)、0.04mol/L Na2SO3(每升含淀粉5g)、0.004mol/L KIO3(每升加浓H2SO44mL,使pH在4左右)、3%H2O2、3.0mol/LH2SO4、0.1mol/LMnSO4、0.01mol/L KmnO4、0.05mol/L H2C2O4、饱和CoCl2、浓HCl等。
4.过程设计
(1)浓度对反应速率的影响
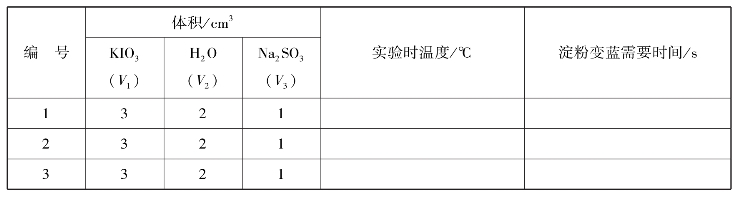
取一支大试管,量取0.004mol/L KIO3溶液5mL,加入1mL 0.04mol/L Na2SO3,并立即按动秒表,同时振荡试管,当溶液变蓝时,马上停止秒表,记下出现蓝色所需的时间。用同样的方法,改变KIO3的浓度,记下每次溶液变蓝所需要的时间,填入实训表3中。
(2)温度对反应速率的影响
取一支大试管,加入3mL 0.004mol/L KIO3再加2mL蒸馏水振荡,在另一支试管中加入1mL 0.04mol/L Na2SO3两管同时放入盛热水的烧杯中水浴加热,在其中一试管中插一温度计,待温度升至比室温高10℃时,将1mL的Na2SO3迅速倒入盛KIO3的试管中,立即计时,并振荡,记录变蓝需用的时间。用同样的操作方法,固定浓度,在高于室温20℃、30℃时,记录淀粉变蓝所需用的时间,填入实训表4中。
(3)催化剂对反应速率的影响
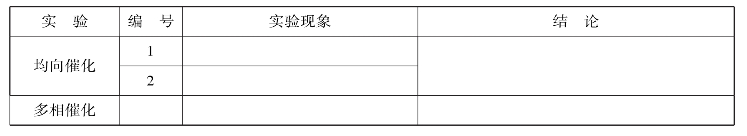
①均相催化:取两支试管,往第一支试管中加入3mol/L 1mL H2SO4和3mL 0.05mol/L H2C2O4,加1mL蒸馏水。在另一支试管中加同样数量的硫酸和草酸,但另加1mL 0.1mol/L MnSO4(作催化剂),然后在两支试管中迅速加入0.01mol/L KmnO4溶液3滴,比较两支试管中紫色褪去的快慢。观察现象,记录在实训表5中。
②多相催化:取两支小试管各加入2mL 3%H2O2,用润湿的玻璃棒沾少量的MnO2粉末(作催化剂)伸进其中的一支试管内,比较两支试管气泡的产生,并用燃烧余烬的火柴检验放出的气体。观察现象,记录在实训表5中。
(4)浓度对化学平衡的影响
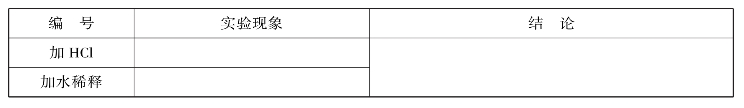
在培养皿中倒入少量的CoCl2溶液(溶液的量刚刚盖上皿底),然后,用滴管滴加浓HCl溶液数滴,待溶液颜色改变后,再加水稀释。观察现象,记录在实训表6中。
(5)温度对化学平衡的影响
将双联二氧化氮平衡仪的两个玻璃球分别放入热水和冷水中2~3min,比较两球的颜色,有什么不同。将观察结果记录在实训表7中。
5.数据记录与结果处理
实训表3 不同浓度下的反应速率

实训表4 不同温度下的反应速率
实训表5 催化剂对反应速率的影响
实训表6 浓度对化学平衡的影响
实训表7 温度对化学平衡的影响
6.注意事项
(1)时间的记录。两支试管分装两个反应物,当第2支试管中溶液快速倒入近一半时开始计时,混合后的试管边振荡边观察,出现蓝色后立即停止计时。为便于计时,两人合作。
(2)水浴加热。烧杯下应放石棉网,杯内同时放入分装两反应物的试管,并且其中一试管中放一支温度计,待温度升至比原温度高10℃、20℃时混合两试管,观察现象,并记录时间。
(3)浓盐酸的使用。因其具有强烈的腐蚀性,使用时要小心,若滴到手或衣物上,用大量的水冲洗。
(4)液体试样的取用。若用量大于1mL,用量筒量取,用量若小于1mL,则用滴管滴加,注意液滴的大小均匀。
(5)废液处理。废液倒入废液缸。
7.参考学时
2学时。
8.实训思考
(1)从实训结果说明哪些因素影响化学平衡?怎样判断化学平衡移动的方向?
(2)根据NO2和N2O4的平衡实验说明,升高温度时,p(N2O4)、p(NO2)、K将如何变化,平衡将向什么方向移动?
实习实训3 酸度计的使用及溶液pH的测定
1.实训目的
(1)学会酸度计的使用方法。
(2)能正确测定溶液pH值。
2.实训原理
酸度计是利用pH复合电极对被测溶液中氢离子浓度产生不同的直流电位,通过前置放大器输入到A/D转换器,以达到pH测量的目的,最后由数字显示pH值。
3.仪器及试剂
(1)仪器用具
pHS⁃3C酸度计、温度计、小烧杯等。
(2)试剂
标准缓冲溶液、池塘水、0.001mol/L HCl溶液、0.000 1mol/L NaOH溶液等。
4.过程设计
(1)仪器结构
仪器结构如实训图1所示。
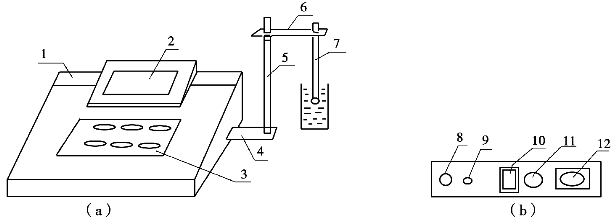
实训图1 pHS⁃3C酸度计
(a)仪器外形结构;(b)仪器后面板
1—机箱;2—显示屏;3—键盘;4—电极梗座;5—电极梗;6—电极夹;7—电极;8—测量电极插座;9—温度电极插座;10—电源开关;11—保险丝座;12—电源插座
(2)pHS⁃3C酸度计的使用
①将多功能架插入电极架插座中,并拧好。
②将pH复合电极安装在电极架上。
③用蒸馏水清洗电极。
④连接电源线,并打开仪器开关,仪器显示“pHS⁃3C”字样;接下来会显示上次标定后的斜率以及EO值;然后进入测量状态,显示当前的电位值或者pH值(其中显示屏上方为电位值或者pH值,下方为设定的温度值)。
⑤在测量状态下,按“mV/pH”键可以切换显示电位以及pH值。
⑥设置温度。按“温度△”或“温度▽”键调节显示值,使温度显示被测溶液的温度,按“确认”键,即完成当前温度的设置,按“mV/pH”键放弃设置,返回测量状态。
⑦标定。仪器使用前需要标定,分为一点标定和二点标定。标定步骤如下:
(a)清洗电极,将电极插入标准缓冲溶液1中(pH=6.86);
(b)用温度计测出被测溶液的温度,按“温度”,使温度显示被测溶液的温度;
(c)待读数稳定后按“定位”键,仪器显示“Std YES”字样,按“确认”键进入标定状态,仪器自动识别并显示当前温度下的标准pH值;
(d)按“确认”键完成一点标定(斜率为100.00%),(即两次“确认”);
(e)如果需要二点标定,则继续下面操作;
(f)再次清洗电极,将电极插入标准缓冲溶液2中;
(g)用温度计测出被测溶液的温度,按“温度”键,使温度显示为被测溶液的温度;
(h)待读数稳定后按“斜率”键,仪器提示“Std YES”字样,按“确认”键进入标定状态,仪器自动识别并显示当前温度下的标准pH值;
(i)按“确认”键完成二点标定;
⑧测量pH值或电极电位。
⑨清洗电极,擦干后戴上电极保护套,拆卸电极支架,将酸度计装入盒子以备下次使用。
(3)实训测试项目
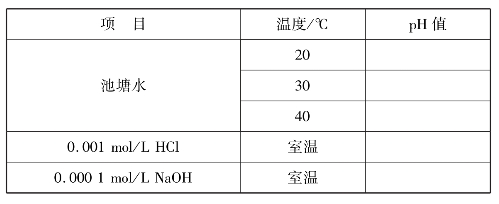
①测定池塘水在20℃、30℃、40℃下的pH值。
②测定0.001mol/L HCl溶液pH值。
③测定0.0001mol/L NaOH溶液pH值。
5.数据记录与结果处理
实训表8 溶液pH测定数据记录表
6.注意事项
(1)电极在测量前必须用已知pH值的标准缓冲溶液进行定位校准,其值越接近被测值越好。
(2)取下电极套后,应避免电极的敏感玻璃泡与硬物接触,因为任何破损或擦毛都会使电极失效。
(3)测量后,及时将电极保护套套上,电极套内应放少量内参比补充液以保持电极球泡的湿润。切忌浸泡在蒸馏水中。
(4)复合电极的内参比补充液为3mol/L NaCl溶液,补充液可以从电极上端小孔加入。复合电极不使用时,拉上橡皮套,防止补充液干涸。
7.参考学时
2学时。
8.实训思考
(1)为什么测量溶液pH时,应尽量选用pH与它相近的标准缓冲溶液来校正pH计?
(2)用酸度计测定溶液的pH值应该如何正确操作?
实习实训4 醋酸电离常数的测定
1.实训目的
(1)掌握pH法测定醋酸电离常数Ka的原理和方法。
(2)学会使用酸度计测定溶液的pH值。
(3)练习使用pH计、容量瓶的使用方法。
2.实训原理
醋酸(CH3COOH或写出HAc)是弱电解质,在溶液中存在下列电离平衡:
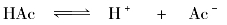
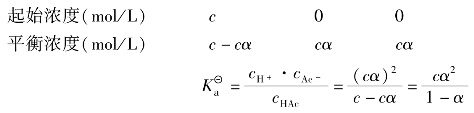
一般情况下,当K/c≥500,则弱酸的电离度α<5%,此时采用近似计算结果的相对误差约为2%,1-α≈1。
故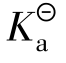 =cα2,而cH+=cHAcα,因此α=cH+/cHAc。
=cα2,而cH+=cHAcα,因此α=cH+/cHAc。
cHAc为HAc的起始浓度,HAc溶液的pH值由数显pH计测定,然后根据pH=-log cH+,cH+=10-pH,将cH+、cHAc带入上式即可求算出电离度α和解离平衡常数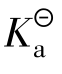 。
。
3.仪器及试剂
(1)仪器
pH计、50mL烧杯、温度计、移液管、洗耳球等。
(2)试剂
0.200 0mol/L HAc标准溶液、pH标准缓冲溶液(邻苯二甲酸氢钾、混合磷酸盐、四硼酸钠)等。
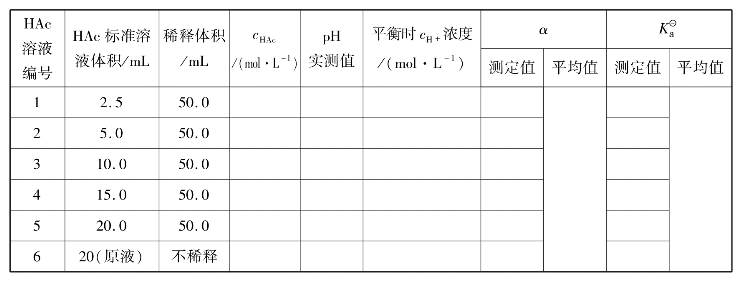
4.过程设计
(1)配制不同浓度的HAc溶液
分别移取2.5mL、5.0mL、10.0mL、15.0mL、20.0mL HAc标准溶液于5只50mL容量瓶中,用去离子水稀释至刻度,摇匀,并计算出5个容量瓶中HAc溶液的准确浓度。将溶液从稀到浓排序编号为:1、2、3、4、5,原溶液为6号。
(2)测定不同浓度的HAc溶液的pH值,计算α和Ka
将上述6种溶液(30~40mL)分别倒入干燥洁净的小烧杯中,按由稀到浓的顺序分别测定不同浓度的pH值。并记录数据和室温,将数据填入实训表9。
(3)计算HAc电离度和电离常数
根据pH=-log cH+,cH+=10-pH,把cH+、c带入公式α=cH+/c即可求算出电离度α,进而根据公式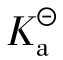 =cα2即可求得电离常数
=cα2即可求得电离常数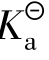 。
。
5.数据记录与结果处理
实训表9 醋酸电离度和电离常数的测定(温度________℃)
6.注意事项
(1)测量pH值之前,烧杯必须洗涤并干燥。
(2)复合电极要轻拿轻放,避免损坏。
(3)测定不同浓度醋酸溶液的pH值时,宜按由稀到浓的顺序测定。
7.参考学时
2学时。
8.实训思考
(1)测得的电离常数是否与附表中所给的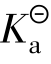 (HAc)有误差?试讨论怎样才能减少误差。
(HAc)有误差?试讨论怎样才能减少误差。
(2)使用复合电极有哪些需要注意的地方?
(3)用pH计测定醋酸溶液的pH值,为什么要按浓度由低到高的顺序进行?
实习实训5 电子分析天平使用与称量技术
1.实训目的
(1)了解电子分析天平的基本构造。
(2)学会用增量法、减量法称量试样。
2.实训原理
电子分析天平是最新一代天平,它是利用电子装置完成电磁力补偿的调节,使物体在重力场中实现力的平衡,或通过电磁力矩的调节,使物体在重力场中实现力矩的平衡。自动调零、自动校准、自动去皮和自动显示称量结果是电子天平最基本的功能。这里的“自动”,严格地说应该是“半自动”,因为需要经人工触动指令键后方可自动完成指定的动作。
(1)直接法称量
直接法适用于称量洁净干燥的器皿,块状的金属,不易潮解或升华的整块固体试样。调整天平零点后,把被称物用一干净的纸条套住(也可采用戴一次性手套、专用手套、用镊子或钳子等方法),放在天平称盘中央,直接称量其质量。记录称量结果(准确至0.1 mg)。
(2)固定质量称量法(增量法)
固定质量衡量法适用于称取指定质量的试样。适合于称取本身不宜吸水,并在空气中性质稳定的细粒或粉末状试样,在分析化学实训中,当需要用直接配制法配制指定浓度的标准溶液时,通常用此法来称取基准物。其操作步骤如下:先称出容器(如表面皿、铝勺、硫酸纸)的质量。再用牛角勺将试样慢慢加入盛放试样的表面皿(或其他器皿、硫酸纸)中。少量加样后,判断加入的量距指定的质量差多少。用牛角匙逐渐加入试样,当所加试样与指定质量相差不到10mg时,极其小心地将盛有试样的牛角勺伸向左称盘的容器上方2~3 cm处,勺的另一端顶在掌心上,用拇指、中指及掌心拿稳牛角勺,并用食指轻弹勺柄,将试样慢慢抖入容器中,直至天平平衡。然后,取出表面皿,将试样直接转入接收器。
(3)差减称量法(减量法)
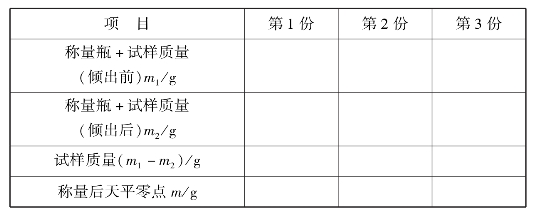
即称取试样的量是由两次称量之差而求得。此法比较简便、快速、准确,在化学实验中常用来称取待测样品和基准物,是最常用的一种称量法。它与上述两种方法不同,称取样品的质量只要控制在一定要求范围内即可。操作步骤如下:用手拿住表面皿的边沿,连同放在上面的称量瓶一起从干燥器里取出。用小纸片夹住称量瓶,打开瓶盖,将稍多于需要量的试样用牛角匙加入称量瓶(在台秤上粗称),盖上瓶盖,用清洁的纸条叠成约1 cm宽的纸带套在称量瓶上,左手拿住纸带尾部把称量瓶放到天平左盘的正中位置,天平平衡,称出称量瓶加试样的准确质量(准确到0.1 mg),记下读数设为m1。左手仍用纸带将称量瓶从秤盘上拿到接收器上方,右手用纸片夹住瓶盖柄打开瓶盖,瓶盖不能离开接收器上方。将瓶身慢慢向下倾斜,并用瓶盖轻轻敲击瓶口,使试样慢慢落入容器内,不要把试样撒在容器外。当估计倾出的试样已接近所要求的质量时(可从体积上估计),慢慢将称量瓶竖起,用盖轻轻敲瓶口,使黏附在瓶口上部的试样落入瓶内,然后盖好瓶盖,将称量瓶再放回天平左盘上称量。需准确称取其质量,设此时质量为m2。则倒入接收器中的质量为(m1-m2)。按上述方法连续操作,可称取多份试样。
3.仪器及试剂
(1)仪器用具
电子分析天平、称量瓶、锥形瓶、小烧杯、药匙、毛刷、纸条等。
(2)试剂
氯化钠、石英砂、硼砂等。
4.过程设计
(1)准确称取1.258 5g石英砂1份(增量法)
①将一干燥洁净的小烧杯放在电子分析天平的秤盘上,利用TAR键调天平至零点。
②用药匙将试样少量多次加到小烧杯瓶中,直到显示出所设定的试样量。
注意:天平的使用、称量瓶的使用和样品加入的操作技巧等应由老师指导。
(2)准确称取0.4~0.6g硼砂3份(减量法)
①取一只洁净、干燥的称量瓶,先在台秤上粗称其质量,加入0.5g左右的硼砂,后在分析天平上准确称量(准确至0.1 mg),记下质量为m1g。
②从称量瓶中小心倾斜轻敲出0.4~0.6g硼砂试样于一洁净的100mL锥形瓶中,并准确称出称量瓶和剩余试样的质量m2g。(m1-m2)即为第1份试样的质量。
③重复上两步操作,称出第2、3份试样。将有关数据分别填入相应的表中。
④称量完毕后,检查天平盘内和大理石底面上有无脏物,如有用毛刷清除。
⑤最后用罩布将天平罩好,在天平使用簿上填写使用记录。请指导教师检查签名后,方可离开。
5.数据记录与结果处理
实训表10 固定质量称量法(增量法)记录表
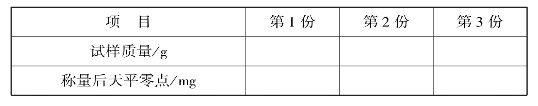
实训表11 差减称量法(减量法)记录表
6.注意事项
(1)天平在校准后,切不可轻易移动天平,否则校准工作需重新进行。
(2)严禁不使用称量纸(瓶)直接称量,每次称量后,请清洁天平,避免对天平造成污染而影响称量精度。
7.参考学时
2学时。
8.实训思考
(1)使用分析天平时,以下操作是否允许?为什么?
①在天平门没有关闭时读取读数。
②用手直接拿取称量瓶或称量物。
(2)什么情况下用直接法称量?什么情况下则需用减量法称量?
(3)用减量法称取试样时,若将称量瓶内的试样吸湿,将对称量结果造成什么误差?若试样敲落在烧杯内再吸湿,对称量结果是否有影响?
知识拓展
TP⁃214型电子分析天平的使用方法
TP⁃214型电子分析天平是多功能、上皿式常量分析天平,感量为0.1 mg,最大载荷为210g。从左到右控制键分别为:开/关键(ON/OFF);功能键(FUNCTION);清除键(CF);打印键(PRINT);去皮/调零键(TARE);重量显示屏。

电子分析天平外形

电子分析天平的显示屏及控制板

电子分析天平调平状态
一般情况下,只能用开/关键、去皮调零键和校准/调整键。使用时的操作步骤如下:
1.检查水平仪,如不水平,应通过调节天平前边左、右两个水平支脚而使其达到水平状态。天平后面的水平仪内的气泡位于圆环的中央表示水平调好。
2.接通天平电源,按ON/OFF键。在天平预热30min后,天平达到所需的操作温度后在执行量测作业。首先按TARE键将天平去皮,天平显示为0.0000g。
3.天平去皮归零后,可以将待测物品放入天平秤盘上,待显示数据稳定后即为物品重量。
4.测量完毕后,先取出测量物品,然后按ON/OFF键关闭电源。最后将电源变压器插头拔出,切断电源。
5.如果量测后,称盘表面有污染物,切断天平电源后用一块浸有中性清洗剂如肥皂水的布清洁称盘,清洗干净后,用柔软的干布将天平擦干,最后拿出秤盘并清洗。清洗作业时候动作一定要轻。
6.如果天平长时间没有用过,或天平移动位置,应进行一次校准。校准要在天平预热30min以后进行,程序是:调整水平,按下“ON/OFF”键,显示稳定后如不为零则按一下“TARE”键,稳定地显示“0.0000g”后,按一下校准键(CAL),天平将自动进行校准。10 s左右,“CAL”消失,表示校准完毕,应显示出“0.0000g”。如果显示不正好为零,可按一下“TARE”键,然后即可进行称量。
实习实训6 滴定分析基本操作练习
1.实训目的
(1)学习滴定管的准备和滴定操作。
(2)初步学会准确地确定终点的方法。
(3)熟悉甲基橙和酚酞指示剂的使用和终点的变化。
2.实训原理
中和反应:

当达到等当点时,A的物质的量为nA与B的物质的量nB之比为:
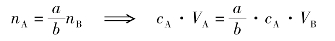
由此可见,酸碱溶液通过滴定,确定它们中和时所需的体积比,即可确定它们的浓度比。如果其中以溶液的浓度已知,则另以溶液的浓度可求出。中和反应的滴定终点借助指示剂的颜色变化来确定。
3.仪器及试剂
(1)仪器用具
酸式滴定管、碱式滴定管、20mL移液管、锥形瓶等。
(2)试剂
0.1mol/L HCl溶液、0.1mol/L、NaOH溶液、酚酞指示剂(2g/L)以及甲基橙指示剂(1g/L)等。
4.过程设计
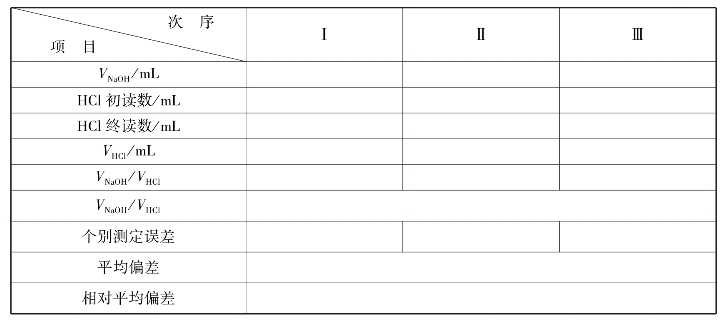
①用0.1mol/L NaOH润洗碱式滴定管2~3次(每次用量5~10mL)→装液至“0”刻度线以上→排除管尖的气泡→调整液面至0.00刻度或稍下处,静置1min后,记录初始读数。
②用0.1mol/L HCl润洗酸式滴定管2~3次(每次用量5~10mL)→装液至“0”刻度线以上→排除管尖的气泡→调整液面至0.00刻度或稍下处,静置1min后,记录初始读数。
③用移液管称取20.00mL NaOH于100mL锥形瓶中→滴加2滴甲基橙指示剂→用HCI滴定至橙色(30 s内不褪色)→记录读数,反复练习至熟练,要求∣Er∣≤0.1%。
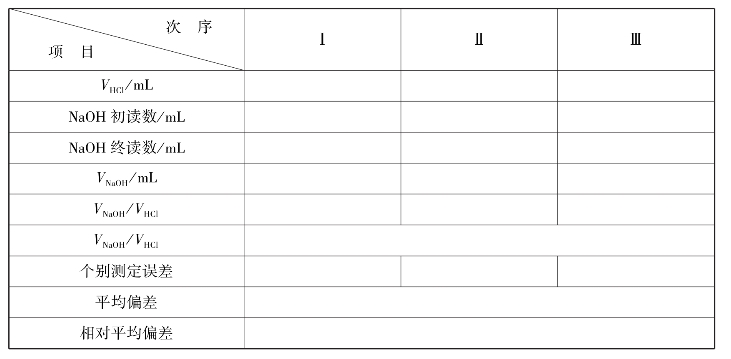
④用移液管称取20.00mL HCl于100mL锥形瓶中→滴加2滴酚酞指示剂→用NaOH滴定至微红色(30 s内不褪色)→记录读数,反复练习至熟练,要求∣Er∣≤±0.1%。
5.数据记录与结果处理
实训表12 HCl滴定NaOH数据记录表(指示剂:甲基橙)
实训表13 NaOH滴定HCl数据记录表(指示剂:酚酞)
6.注意事项
(1)滴定管使用前先润洗,后装入操作液,先赶走气泡,再调零。
(2)平行试验每次从0.00mL开始。
(3)规范滴定操作,注意观察终点前后颜色的变化。
7.参考学时
2学时。
8.实训思考
(1)滴定管和移液管均需用待装溶液润洗3次的原因何在?滴定用的锥形瓶也要用待装溶液润洗吗?
(2)以下情况对滴定结果有何影响?
①滴定管中留有气泡。
②滴定近终点时,没有用蒸馏水冲洗锥形瓶的内壁。
③滴定完后,有液滴悬挂在滴定管的尖端处。
④滴定过程中,有一些滴定液自滴定管的旋塞处渗漏出来。
(3)滴定至临近终点时加入半滴的操作是怎样进行的?
实习实训7 盐酸溶液的配制与标定
1.实训目的
(1)学会标准溶液的配制方法,掌握盐酸溶液标定过程及原理。
(2)学会酸式滴定管的基本操作,掌握滴定过程及指示剂选择原则和变色原理。
(3)进一步熟悉分析天平、容量瓶、移液管、量筒等的操作。
2.实训原理
滴定分析法中,标准溶液的配制有2种方法。由于盐酸不符合基准物质的条件,只能用间接法配制,再用基准物质来标定其浓度。标定盐酸常用的基准物质有无水碳酸钠Na2CO3和硼砂Na2B4O7·10H2O。采用硼砂较易提纯,不易吸湿,性质比较稳定,而且摩尔质量很大,可以减少称量误差。硼砂与盐酸的反应为:
Na2B4O7·10H2O+2HCl  4H3BO3+NaCl+5H2O
4H3BO3+NaCl+5H2O
在化学计量点时,由于生成的硼酸是弱酸,溶液的pH值约为5,可用甲基红作指示剂。
本实训采用称取硼砂后直接用盐酸的方法进行操作,根据所称硼砂的质量和滴定所用盐酸溶液的体积,可以求出盐酸溶液的准确浓度。
3.仪器及试剂
(1)仪器用具
吸量管(10mL)、烧杯、试剂瓶、酸式滴定管(50mL)、容量瓶(250mL)、移液管(20mL)、锥形瓶(250mL)等。
(2)试剂
0.1mol/L HCl溶液、硼砂(分析纯)、甲基红指示剂(0.1%乙醇溶液)等。
4.过程设计
(1)配制0.1mol/L盐酸250mL
用吸量管吸取计算所需体积的浓盐酸,注入事先盛有少量蒸馏水的烧杯中,稀释后转入250mL容量瓶中定容。将所配溶液转入洁净的试剂瓶中,用玻璃瓶塞塞住瓶口,摇匀,贴好标签,待标定。
(2)盐酸的标定
从称量瓶中用差减法准确称取纯净硼砂3份,每份重0.3~0.4g(称至小数点后4位),置于锥形瓶中,加20mL蒸馏水使之溶解(可稍加热以加快溶解,但溶解后需冷却至室温),加入甲基红指示剂2滴,用待定的盐酸溶液滴定,至溶液颜色由黄色转变为橙色,30 s不褪色,即为滴定终点。记录所消耗盐酸的体积,平行滴定3次。同时做空白试验。
(3)根据试验结果计算HCl溶液浓度

5.数据记录与结果处理
实训表14 盐酸标准溶液标定数据记录表
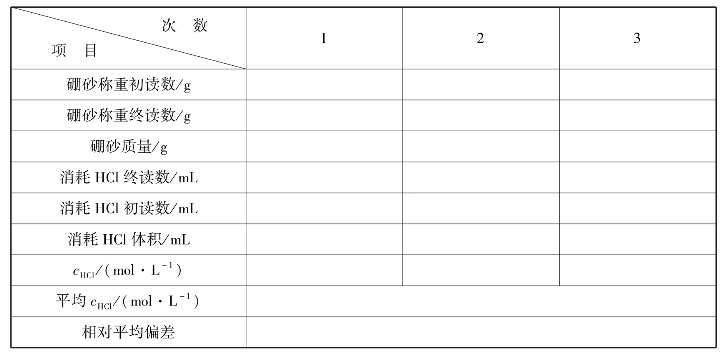
∗要求相对平均偏差≤0.2%。
6.注意事项
(1)称量硼砂时,必须采用减量法称量。
(2)接近终点时,滴定速度应减慢。
7.参考学时
2学时。
8.实训思考
(1)为什么不能用直接法配制盐酸标准溶液?
(2)实训中所用锥形瓶是否需要烘干?加入蒸馏水的量是否需要准确?
实习实训8 氢氧化钠溶液的配制与标定
1.实训目的
(1)学会标准溶液的配制方法,掌握氢氧化钠溶液标定过程及原理。
(2)学会碱式滴定管的基本操作,掌握滴定过程及指示剂选择原则和变色原理。
(3)进一步熟悉分析天平、容量瓶、移液管、量筒等的操作。
2.实训原理
大多数物质的标准溶液不宜用直接法配制,可选用标定法。即先配成近似所需浓度的溶液,再用基准物质或已知准确浓度的标准溶液标定其准确浓度。NaOH标准溶液在酸碱滴定中最常用,但NaOH固体易吸收空气中的CO2和水蒸气,故只能选用标定法来配制。其浓度一般为0.01~1mol/L,通常配制0.1mol/L的溶液。
常用标定碱标准溶液的基准物质有邻苯二甲酸氢钾、草酸等。本实训选用邻苯二甲酸氢钾作基准物质,其反应为:
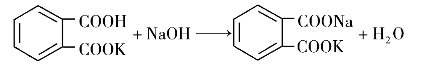
化学计量点时,计量点时由于弱酸盐的水解,溶液呈弱碱性(pH=9.20),可选用酚酞作指示剂。
3.仪器及试剂
(1)仪器用具
天平、烧杯、试剂瓶、碱式滴定管(50mL)、容量瓶(250mL)、移液管(25mL)、锥形瓶(250mL)等。
(2)试剂
NaOH(分析纯)、酚酞指示剂(0.2%乙醇溶液)、甲基橙指示剂(0.2%水溶液)、邻苯二甲酸氢钾(分析纯)等。
4.过程设计
(1)0.1mol/L NaOH溶液的配制
用天平迅速称取4g NaOH固体于100mL小烧杯中,加约30mL去离子水(煮沸以除去其中的CO2)溶解,然后转移至试剂瓶中,用去离子水稀释至1 000mL,摇匀后,用橡皮塞塞紧。贴好标签,备用。
(2)氢氧化钠溶液的标定
用差减法准确称取0.4~0.6g已烘干的邻苯二甲酸氢钾3份,分别放入3个已编号的250mL锥形瓶中,加20~30mL水溶解(若不溶可稍加热,冷却后),加入1~2滴酚酞指示剂,用0.1mol/L NaOH溶液滴定至呈微红色,30 s不褪色,即为终点。记录所消耗氢氧化钠的体积,平行滴定3次。
(3)根据试验结果计算NaOH溶液浓度

0.204 2——与1 mmol氢氧化钠标准滴定溶液相当的基准邻苯二甲酸氢钾的质量,g。
5.数据记录与结果处理
实训表15 氢氧化钠标准溶液标定数据记录表
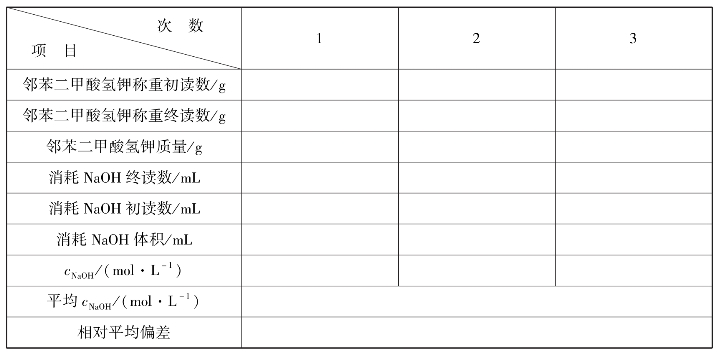
∗要求相对平均偏差≤0.2%。
6.注意事项
(1)称量邻苯二甲酸氢钾时,必须采用减量法称量。
(2)整个过程滴定速度不能太慢。
7.参考学时
2学时。
8.实训思考
(1)与其他基准物质比较,邻苯二甲酸氢钾有什么优点?
(2)称取NaOH及邻苯二甲酸氢钾各用什么天平?为什么?
(3)标定NaOH溶液,邻苯二甲酸氢钾的质量是怎样计算得来的?
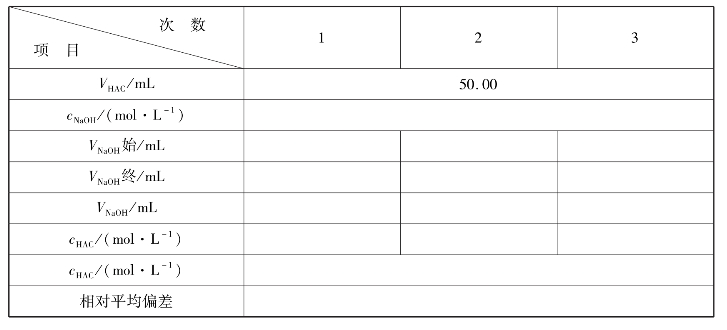
实习实训9 食醋总酸量的测定
1.实训目的
(1)学会酸度计的使用方法。能正确测定pH值。
(2)了解强碱滴定弱酸的反应原理及指示剂的选择。
(3)学会食醋中总酸度的测定方法。
2.实训原理
食醋中的主要成分是醋酸,此外还含有少量的其他弱酸如乳酸等,醋酸为有机弱酸(Ka=1.8×10-5),用NaOH标准溶液滴定,在化学计量点时溶液呈弱碱性,滴定突跃在碱性范围内,化学计量点时pH约为8.7选用酚酞作指示剂,可测出酸的总量。结果按醋酸计算。反应式:
CH3COOH+NaOH 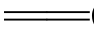 CH3COONa+H2O
CH3COONa+H2O
3.仪器及试剂
(1)仪器用具
50mL碱式滴定管、25mL移液管、250mL容量瓶、250mL锥形瓶等。
(2)试剂
0.1mol/L NaOH标准溶液、白醋(市售)、酚酞指示剂(0.2%乙醇溶液)等。
4.过程设计
(1)准确移取食用白醋25.00mL置于250mL容量瓶中,用蒸馏水稀释至刻度摇匀
用25mL移液管分别取3份上述溶液置于250mL锥形瓶中,加入2~3滴酚酞指示剂,用NaOH标准溶液滴定至呈微红色并保持30 s不褪色,即为终点。计算每100mL食用白醋中含醋酸的质量。
(2)根据试验结果计算食醋总酸度

5.数据记录与结果处理
实训表16 食用白醋含量的测定数据记录表
6.注意事项
(1)食醋必须稀释,不能直接滴定。
(2)稀释后,如果食醋呈浅黄色且混浊时,终点颜色略暗。
7.参考学时
2学时。
8.实训思考
(1)测定食用白醋含量时,为什么选用酚酞为指示剂?能否选用甲基橙或甲基红?
(2)强碱滴定弱酸与强碱滴定强酸相比,滴定过程中pH变化有哪些不同点?
(3)测定醋酸含量时,所用的蒸馏水不能有CO2,为什么?
实习实训10 铵盐含氮量测定(甲醛法)
1.实训目的
(1)了解氮含量的测定原理,掌握间接滴定的原理。
(2)掌握铵盐含量的计算。
(3)进一步掌握天平、移液管的使用。
2.实训原理
常用的含氮化肥有NH4Cl、(NH4)2SO4、NH4NO3、NH4HCO3和尿素等,其中NH4Cl、(NH4)2SO4和NH4NO3是强酸弱碱盐。由于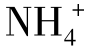 的酸性太弱(Ka=5.6×10–10),因此不能直接用NaOH标准溶液滴定,但用甲醛法可以间接测定其含量。尿素通过处理也可以用甲醛法测定其含氮量。甲醛与
的酸性太弱(Ka=5.6×10–10),因此不能直接用NaOH标准溶液滴定,但用甲醛法可以间接测定其含量。尿素通过处理也可以用甲醛法测定其含氮量。甲醛与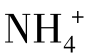 作用,生成质子化的六次甲基四胺(Ka=7.1×10-6)和H+,其反应如下:
作用,生成质子化的六次甲基四胺(Ka=7.1×10-6)和H+,其反应如下:
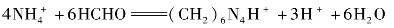
所生成的H+和(CH2)6N4H+,以酚酞为指示剂,可用NaOH标准溶液滴定,其反应如下:
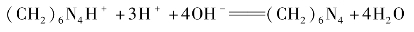
3.仪器及试剂
(1)仪器用具
分析天平、20mL移液管、量筒、锥形瓶、碱式滴定管等。
(2)试剂
固体NH4NO3、0.1mol/L氢氧化钠标准溶液、酚酞指示剂(0.2%乙醇溶液)、甲醛等。
4.过程设计
①取原装甲醛(40%)的上层清液于烧杯中,用水稀释一倍,加入1~2滴0.2%酚酞指示剂,用0.1mol/L NaOH溶液中和至甲醛溶液呈淡红色。
②准确称取硝酸铵样品2.0~3.0g(若是硫酸铵,称样量应先估算),放入100mL烧杯中,加30mL水溶解。将溶液定量转移至250mL容量瓶中,用水稀释至刻度,摇匀。
③用移液管吸取上述试液25.00mL至锥形瓶中,加1~2滴甲基红指示剂,溶液呈红色,用0.1mol/L NaOH溶液中和至红色转为金黄色,此时消耗的氢氧化钠体积不记录,然后加5mL中性甲醛溶液,摇匀,放置1min。在溶液中加2滴酚酞指示液,用0.1mol/L NaOH标准溶液滴定至溶液呈浅粉色30 s不褪即为终点,平行测定3次,同时作空白,要求相对平均偏差不大于0.5%。
④根据试验结果进行计算。

5.数据记录与结果处理
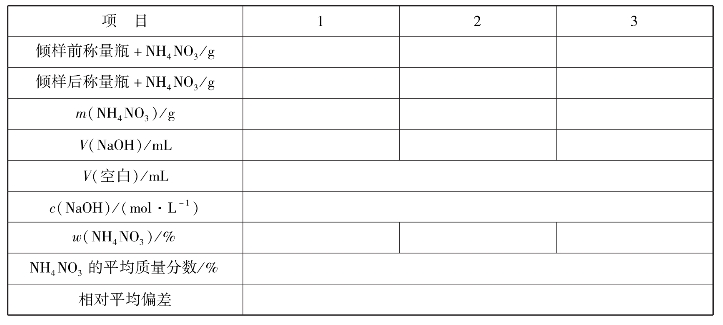
实训表17 铵盐含氮含量测定记录表
6.注意事项
(1)甲醛法只适用于强酸铵盐中氮含量的测定。
(2)测定前,必须先去除甲醛中的游离酸。
7.参考学时
2学时。
8.实训思考
(1)铵盐中氮的测定为何不采用NaOH直接滴定法?
(2)为什么中和甲醛试剂中的甲酸以酚酞作指示剂;而中和铵盐试样中的游离酸则以甲基红作指示剂?
(3)NH4NO3、NH4Cl或NH4HCO3中的含氮量测定,能否用甲醛法?
实习实训11 果蔬中总酸度的测定
1.实训目的
(1)学会果蔬样品的预处理方法。
(2)掌握用酸碱滴定法测果蔬样品中总酸度的原理和方法。
(3)能规范记录数据并进行数据处理。
2.实训原理
根据酸碱中和原理,用碱标准溶液滴定试样液中的酸时,以酚酞为指示剂。当滴定至终点溶液呈浅红色,且30 s不褪色时,根据滴定时消耗的标准NaOH溶液的体积,可算出试样中的总酸度。其反应如下:

3.仪器及试剂
(1)仪器用具
碱式滴定管、锥形瓶、移液管、量筒、烧杯、容量瓶、胶头滴管、洗耳球、水浴锅、铁架台、电子天平、玻璃棒、小纸片、干燥的纱布等。
(2)试剂
0.1000mol/L NaOH标准溶液、酚酞指示剂、果蔬试样、无CO2的蒸馏水等。
4.过程设计
(1)试样处理
取水果试样,需去皮、去柄、去核,切成块状,置于搅拌机中捣碎并混匀。准确移取25mL水果试样,加100mL无CO2的蒸馏水,稀释定容为250mL溶液。然后倒入烧杯中在75~80℃水浴上加热30min。冷却后过滤,滤液倒入容量瓶中备用。
(2)滴定
准确吸取20mL滤液3份于250mL锥形瓶中,各加25mL水稀释。加1~2滴酚酞指示剂,用NaOH标准溶液滴定至终点,至粉红色30 s不褪色。记录NaOH消耗量的体积,平行测定3次。
(3)根据试验结果进行计算
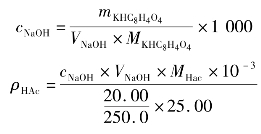
5.数据记录与结果处理
实训表18 水果总酸度测定数据记录表
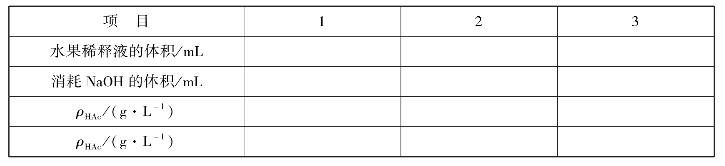
6.注意事项
(1)注意碱式滴定滴定前要赶走气泡,滴定过程不要形成气泡。
(2)NaOH标准溶液滴定HAc,属于强碱滴定弱酸,CO2的影响严重,注意除去所用碱标准溶液和蒸馏水中的CO2。
7.参考学时
2学时。
8.实训思考
(1)本实训中为什么选用酚酞做指示剂?其选择原则是什么?根据选择原则选用其他指示剂可以吗?如果可以请举例说明。
(2)溶解基准物质时加入20~30mL水,是用量筒量取,还是用移液管移取?为什么?
实习实训12 重铬酸钾法测铁
1.实训目的
(1)掌握重铬酸钾标准溶液的配制及使用。
(2)学习矿石试样的酸溶法和重铬酸钾法测定铁的原理及方法。
(3)了解二苯胺磺酸钠指示剂的作用原理。
2.实训原理
铁矿石经硫磷混酸及硝酸溶解后,首先用SnCl2溶液还原大部分Fe3+。为了控制SnCl2的用量,加入SnCl2使溶液呈浅黄色(说明这时尚有少量Fe3+),然后加入TiCl3溶液,使其少量铁均还原成Fe2+,为使反应完全,TiCl3要过量,而过量的TiCl3溶液用微量铜离子催化溶液中溶解氧,氧化除去,该过程以指示剂靛红二磺酸钠变蓝说明TiCl3已被除尽。其反应式:
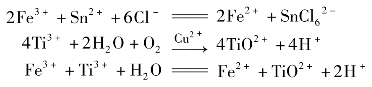
3.仪器及试剂
(1)仪器用具
烘干箱、称量瓶、电子天平、干燥器、电热板、酸式滴定管、锥形瓶、移液管、烧杯、容量瓶、胶头滴管、铁架台、玻璃棒等。
(2)试剂
SnCl2溶液10%(10g SnCl2·2H2O固体溶于50mL浓盐酸中,用水稀释至100mL,加纯锡几粒);TiCl3溶液1∶1(将市售TiCl3溶液与等量盐酸1∶1混合);0.2%CuSO4溶液;靛红二磺酸钠指示剂(将0.25g指示剂溶于100mL水中,加1∶1H2SO4溶液5滴);1∶1硫磷混酸(将150mL浓硫酸缓缓加入700mL水中,冷却后再加入150mL浓磷酸);浓硝酸;二苯胺磺酸钠指示剂0.5%;HCl(浓)。
4.过程设计
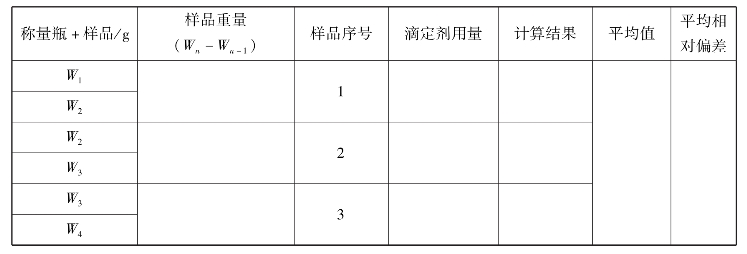
①0.02mol/L K2Cr2O7标准溶液的配制:精确称取已在150~180度烘干2 h,放在干燥器中冷却至室温的K2Cr2O71.4~1.5g于100mL烧杯中,加蒸馏水溶解后,移入到250mL容量瓶中,用水稀释到刻度混匀。
②准确称取0.2~0.3g试样置于250mL锥形瓶中,用少量水润湿加入浓盐酸溶液10mL,盖上表面皿,低温加热溶解后,用少量水洗表面皿及瓶壁,加热至沸,摇匀。趁热逐滴加入10%SnCl2至溶液由黄色变为浅黄色,继续滴加TiCl3溶液至Fe3+的黄色恰好消失,并过量2滴,将溶液流水冷却到室温,并加水70mL,加入10mL硫磷混酸,0.25%靛红二磺酸钠指示剂2滴,摇匀,放置溶液由蓝色变为无色,加入0.2%CuSO42滴,摇匀,放置溶液变蓝,加0.5%二苯胺磺酸钠5滴,用重铬酸钾标准溶液滴定至紫色即为终点。
③根据滴定结果,计算铁矿石中铁的含量。
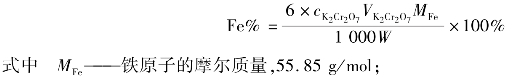

5.数据记录与结果处理
实训表19 K2Cr2O7标准溶液的配制记录表

实训表20 铁矿石中铁的测定数据记录表
6.注意事项
(1)称取的试样后,为防止水解,必须先加盐酸酸化。
(2)还原Fe3+时,SnCl2用量不宜过多,否则Hg2Cl2沉淀过多,会带来不利影响。
(3)加HgCl2除去过量的SnCl2时,溶液要冷却,以避免Hg2+可能氧化Fe2+离子;HgCl2应该一次加入,否则造成局部Sn2+离子浓度过大(尤其SnCl2用量过多时),使生成的Hg2Cl2进一步被Sn2+还原,析出Hg,致使沉淀呈黑灰色,导致实验失败。
(4)指示剂如果配制过久,呈深绿色时不能继续使用。由于二苯胺磺酸钠属于氧化还原指示剂,在滴定过程中参与反应,消耗一定量的K2Cr2O7,所以不能多加。
实习实训13 污水中化学耗氧量的测定
1.实训目的
(1)初步了解环境分析的重要性及水样的采集和保存方法。
(2)掌握高锰酸钾法测定水中COD的原理及方法。
(3)学会反滴定分析的方法和操作技术。
2.实训原理
测定时,在水样中加入H2SO4及一定量的KMnO4溶液,置沸水浴中加热使其中的还原性物质氧化,剩余的KMnO4用一定量过量的Na2C2O4还原,再以KMnO4标准溶液返滴定Na3C2O4的过量部分。由于Cl-对比法有干扰因而本法只适用于地表水、地下水、饮用水和生活污水中COD的测定,含Cl-较高的工业废水则应采用K2Cr2O7法测定。在煮沸过程中,KMnO4和还原性物质作用:

剩余的KMnO4用Na2C2O4还原:
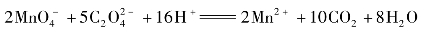
再以KMnO4返滴Na2C2O4过量部分,通过实际消耗KMnO4的量来计算水中还原性物质的量。
3.仪器及试剂
(1)仪器用具
50mL酸式滴定管、50mL碱式滴定管、250mL锥形瓶、10mL吸量管、电炉等。
(2)试剂
0.002mol/L KMnO4溶液、0.005mol/L Na2C2O4溶液、1∶3 H2SO4溶液、1∶5 H2SO4溶液等。
4.过程设计
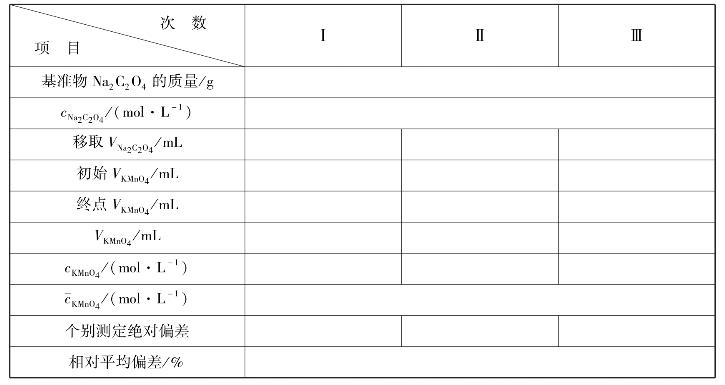
(1)Na2C2O40.005mol/L标准溶液的配制
将Na2C2O4于100~105℃干燥2 h,准确称取0.166 2g于小烧杯中加水溶解后定量转移至250mL容量瓶中,以水稀释至刻度线。
(2)KMnO40.002mol/L溶液的配制及标定
称取KMnO4固体约0.16g溶于500mL水中盖上表面皿,加热至沸腾并保持在微沸状态1 h冷却后用微孔玻璃漏斗过滤存于棕瓶中。
用移液管准确移取25.00mL标准Na2C2O4溶液于250mL锥形瓶中,加入1∶3 H2SO4在水浴上加热到75~85℃,用KMnO4溶液滴定,滴定速度由慢到快到慢的顺序滴加,至溶液呈微红色时停止滴加,记录数据,平行滴定3次。
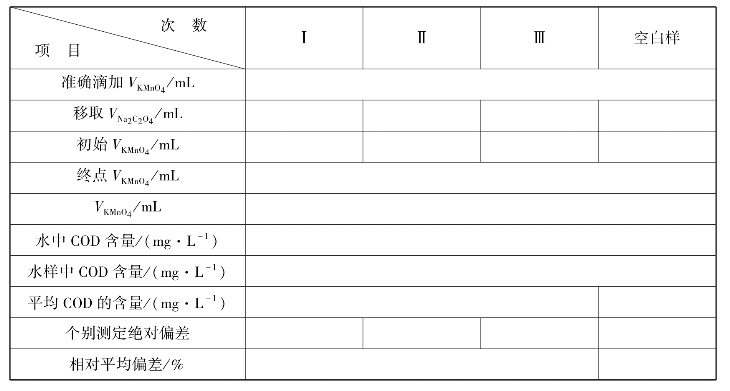
(3)水样中耗氧量的测定
用移液管准确移取100.00mL水样,置于250mL锥形瓶中加10mL 1∶5 H2SO4,后放在电炉子上加热至微沸,再准确加入10.00mL 0.002mol/L KMnO4溶液,立即加热至沸并持续10min,取下锥形瓶,趁热用移液管移入10.00mL Na2C2O4标准溶液、摇匀,此时由红色变为无色,再用移液管移入10.00mL Na2C2O4标准溶液,趁热用0.002mol/L KMnO4标准溶液滴定至稳定的淡红色即为终点,平行滴定3次,记录数据。
(4)空白样耗氧量的测定
用移液管准确移取100.00mL蒸馏水,置于250mL锥形瓶中,后操作如同3号操作,记录数据。
(5)根据滴定结果,进行相关计算
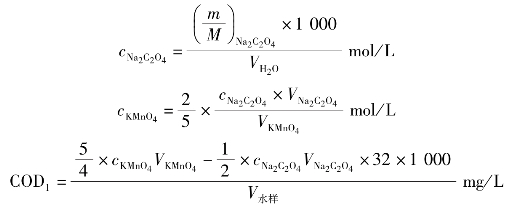
5.数据记录与结果处理
实训表21 KMnO4溶液标定数据记录表
实训表22 水样中化学耗氧量(COD)的测定数据记录表
6.注意事项
(1)本法适用于地表水、地下水和饮用水中COD的测定。
(2)不同条件下测出的COD值不同,因此必须严格控制反应条件。
7.参考学时
2学时。
8.实训思考
(1)水样的采集与保存应注意哪些事项?水样放久了,会有什么影响?
(2)测定水中COD的意义何在?有哪些方法测定COD?
(3)水样中加入KMnO4煮沸后,若紫红色消失说明什么?应采取什么措施?
实习实训14 维生素C含量的测定
1.实训目的
(1)学习定量测定维生素C的原理和方法。
(2)掌握微量滴定法的操作技术。
(3)了解水果及蔬菜中维生素C的含量情况。
2.实训原理
维生素C具有很强的还原性,在中性和微酸性环境中,能将染料2,6⁃二氯酚靛酚还原成无色的还原型的2,6⁃二氯酚靛酚,同时被氧化成脱氢维生素C。氧化型的2,6⁃二氯酚靛酚在酸性溶液中呈现红色,在中性或碱性溶液中呈蓝色。当溶液由无色变为微红色时即表示溶液中的维生素C刚好全部被氧化,此时即为滴定终点。从滴定时2,6⁃二氯酚靛酚溶液的消耗量,可以计算出被检物质中还原型维生素C的含量。
3.仪器及试剂
(1)仪器用具
研钵、天平、50mL容量瓶、量筒、刻度吸管、100mL锥形瓶、玻棒、5mL微量滴定管、漏斗、新鲜蔬菜或新鲜水果、滤纸等。
(2)试剂
2%草酸溶液;1%草酸溶液;标准维生素C溶液(准确称取10 mg纯抗坏血酸,应为洁白色,发黄则不能用,溶于1%草酸溶液中,并稀释至100mL,贮于棕色瓶中,冷藏。最好临用前配制);0.1%2,6⁃二氯酚靛酚溶液(准确称取250 mg 2,6⁃二氯酚靛酚溶于150mL含有52 mg NaHCO3的热水中,冷却后加水稀释至250mL,滤去不溶物,贮于棕色瓶中4℃冷藏约可保存1周。每次使用时,以标准抗坏血酸标定)。
4.过程设计
(1)提取
水洗干净整株新鲜蔬菜(或整个新鲜水果),用纱布或吸水纸吸干表面水分。然后用天平准确称取蔬菜(水果)约0.5g,放在研钵中,加2%草酸5~10mL,研磨成浆状。滤纸过滤,将滤液滤入50mL容量瓶中。滤饼可用少量2%草酸洗2~3次。最后用2%草酸溶液稀释到刻度并混匀。
(2)标准液的滴定
准确吸取标准抗坏血酸溶液1.0mL(含0.1 mg抗坏血酸)置100mL锥形瓶中,加9mL 1%草酸,用微量滴定管以0.1%2,6⁃二氯酚靛酚钠溶液滴定至淡红色,并保持15 s不褪色,即达终点。由所用染料的体积计算出1mL染料相当于多少毫克抗坏血酸(取10mL 1%草酸作空白对照,按以上方法滴定)。
(3)样品的滴定
准确吸取滤液两份,每份10mL分别放入两个锥形瓶(100mL)内,滴定方法同前。另取两份10mL 1%草酸作空白对照滴定。
(4)计算


5.数据记录与结果处理
实训表23 维生素C含量的测定数据记录表
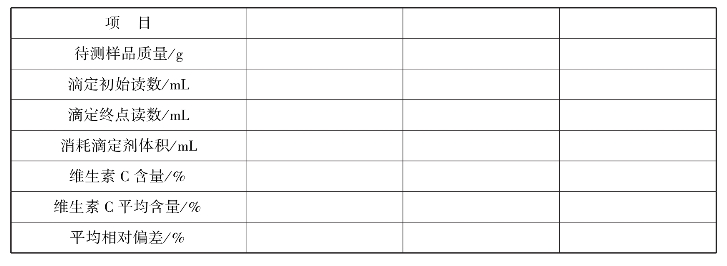
6.注意事项
(1)某些水果、蔬菜(如橘子、西红柿)浆状物泡沫太多,可加数滴丁醇或辛醇。
(2)整个操作过程要迅速,防止还原型抗坏血酸被氧化。滴定过程一般不超过2min。因为在本滴定条件下,一些非维生素C的还原性物质也可与2,6⁃二氯酚靛酚发生反应,影响结果。
(3)滴定所用2,6⁃二氯酚靛酚的量应在1~4mL,超出或低于此范围,应增减样品液用量或改变提取液稀释度。
(4)2%草酸有抑制抗坏血酸氧化酶的作用,而1%草酸无此作用。
7.参考学时
2学时。
8.实训思考
(1)维生素C理化性质最重要的是哪一点?为何用草酸来提取?
(2)为了准确测定维生素C的含量,实训过程中应注意哪些操作步骤?为什么?
实习实训15 EDTA标准溶液的配制和标定
1.实训目的
(1)掌握络合滴定的原理,了解络合滴定的特点。
(2)学习EDTA标准溶液的配制和标定方法。
(3)了解金属指示剂的特点,熟悉二甲酚橙、钙黄绿素指示剂的使用及终点颜色的变化。
2.实训原理
乙二胺四乙酸(简称EDTA),难溶于水,通常用EDTA二钠盐,并采用间接法配制标准溶液。标定EDTA溶液的基准物有Zn、ZnO、CaCO3、Cu、MgSO4·7H2O等。
用于测定Pb2+、Bi3+含量的EDTA溶液可用ZnO或金属Zn作为基准物进行标定。以二甲酚橙作指示剂,在pH为5~6的溶液中,二甲酚橙指示剂(XO)本身显黄色,而与Zn2+的络合物呈紫红色。EDTA与Zn2+形成更稳定的络合物,当用EDTA溶液滴至近终点时。EDTA会把与二甲酚橙络合的Zn2+置换出来而使二甲酚橙游离,因此溶液由紫红色变为黄色。其变色原理可表达如下:
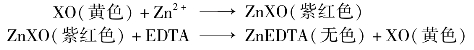
EDTA溶液若用于测定石灰石或白云石中CaO、MgO的含量,则宜用CaCO3为基准物。以钙指示剂(常以H2Ind表示)作指示剂,在pH≥12的溶液中,钙指示剂本身显酒红色,而与Ca2+的络合物呈纯蓝色。EDTA与Ca2+形成更稳定的络合物,当用EDTA溶液滴至近终点时。EDTA会把与钙指示剂络合的Ca2+置换出来而使钙指示剂游离,因此溶液从酒红色变为纯蓝色。其变色原理可表达如下:
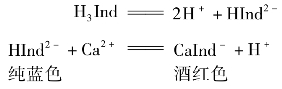
3.仪器及试剂
(1)仪器用具
分析天平、酸式滴定管、移液管、锥形瓶、容量瓶、烧杯、试剂瓶、表面皿等。
(2)试剂
乙二胺四乙酸二钠、CaCO3(优级纯)、1∶1的盐酸(V∶V)、NH3⁃NH4Cl缓冲溶液(pH≈10,称取固体氯化铵67g,溶于少量水中,加浓氨水570mL,用水稀释至1 L)、钙指示剂等。
4.过程设计
(1)0.01mol/L EDTA标准溶液的配制
称取1.8~2.0g分析纯的乙二胺四乙酸二钠溶于100mL温水中,再加入400mL水,摇匀。如需久储,最好储存于聚乙烯塑料瓶中为佳。
(2)0.01mol/L CaCO3标准溶液的配制
准确称量0.26~0.30g CaCO3,置于100mL烧杯中,慢慢滴加1∶1 HCl5mL使CaCO3完全溶解(必要时可以在小烧杯顶部倒扣一个表面皿,微微加热),定量转移到250mL容量瓶中,3次洗涤烧杯的水都要转入,定容到250mL。
(3)EDTA溶液浓度的标定
准确量取20.00或25.00mL钙标准溶液于锥形瓶中,加入10mL氨性缓冲溶液(pH=10),再加入10 mg(米粒大小)钙指示剂,用EDTA溶液(装在酸式滴定管中)滴定,滴定至溶液颜色由酒红色恰变为蓝色。至少平行测定3次,至相对平均偏差小于0.2%为止。
(4)结果计算

5.数据记录与结果处理
实训表24 EDTA标准溶液配制与标定数据记录表
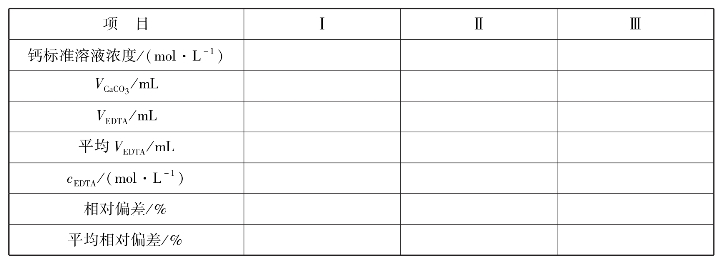
6.注意事项
(1)本法适用于地表水、地下水和饮用水中COD的测定。
(2)不同条件下测出的COD值不同,因此必须严格控制反应条件。
7.参考学时
2学时。
8.实训思考
(1)为什么通常使用乙二胺四乙酸二钠盐配制EDTA标准溶液,而不用乙二胺四乙酸?
(2)以HCl溶液溶解CaCO3基准物时,操作中应注意些什么?
实习实训16 水中总硬度及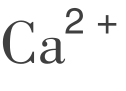 、
、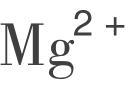 含量的测定
含量的测定
1.实训目的
(1)了解水的硬度的测定意义和常用的硬度表示方法。
(2)了解缓冲溶液的应用。
(3)掌握EDTA法测定水的硬度的原理、方法和计算。
(4)掌握铬黑T和钙指示剂的应用,了解金属指示剂的特点。
2.实训原理
一般含有钙、镁盐类的水叫硬水。用来衡量水中钙、镁盐类含量高低的称为硬度,硬度有暂时硬度和永久硬度之分。由钙、镁的酸式碳酸盐引起的称为暂时硬度;由钙、镁的硫酸盐、氯化物、硝酸盐引起的称为永久硬度。暂时硬度和永久硬度的总和称为“总硬”。由镁离子形成的硬度称为“镁硬”,由钙离子形成的硬度称为“硬度”。
水中钙、镁离子含量,可采用EDTA为标准溶液的络合滴定法来测定。钙硬测定原理同以CaCO3为基准EDTA标准溶液的标定。总硬则以铬黑T为指示剂,调节溶液pH≈10,以EDTA标准溶液滴定之。根据消耗EDTA标准溶液的体积和浓度,即可计算水的总硬;镁硬=总硬-钙硬。
水的硬度表示方法有多种,各国因其习惯的不同而有所不同。我国目前常用的表示方法:以度(°)计,1硬度单位表示十万份水中含1份CaO,1°=10 ppm CaO(ppm为百分之一,为parts permillion的缩写)。
3.仪器及试剂
(1)仪器用具
50mL酸式滴定管、台秤、分析天平、锥形瓶、25mL移液管、250mL容量瓶、烧杯、试剂瓶、100mL量筒、表面皿等。
(2)试剂
0.010 0mol/L EDTA标准溶液、NH3⁃NH4Cl缓冲溶液(pH≈10,称取固体氯化铵67g,溶于少量水中,加浓氨水570mL,用水稀释至1 L)、10%NaOH溶液、钙指示剂、铬黑T指示剂等。
4.过程设计
(1)总硬的测定
量取澄清的水样50mL,放入250mL锥形瓶中,加入5mL NH3⁃NH4Cl缓冲溶液,摇匀。再加入少许铬黑T固体指示剂,边加边摇,至溶液呈酒红色,以0.01mol/L EDTA标准溶液滴定至纯蓝色,即为终点,记下消耗EDTA的体积。
(2)钙硬的测定
量取澄清的水样50mL,放入250mL锥形瓶内,加5mL 10%NaOH溶液,摇匀,再加入少许钙指示剂,边加边摇匀至溶液呈淡红色。用0.01mol/L EDTA标准溶液滴定至纯蓝色,即为终点,记下消耗的EDTA体积。
(3)镁硬的测定
总硬-钙硬=镁硬
(4)结果计算

5.数据记录与结果处理
实训表25 水的总硬度测定数据记录表
续表
6.注意事项
(1)自来水样较纯,杂质少,可省去水样酸化、煮沸、加Na2S掩蔽等步骤。
(2)如果EBT指示剂在水平中变色缓慢,则可能是由于Mg2+含量低,这时应在滴定前加入少量Mg2+⁃EDTA溶液。
(3)开始滴定时滴定速度宜稍快,接近终点时滴定速度宜慢,每加1滴EDTA溶液后,都要充分摇匀。
7.参考学时
2学时。
8.实训思考
(1)配位滴定中为什么要加入缓冲溶液?
(2)为什么滴定Ca2+、Mg2+总量时要控制pH≈10,而滴定Ca2+分量时要控制pH为12~13?若pH>13时测Ca2+对结果有何影响?
实习实训17 牛乳中钙含量的测定
1.实训目的
(1)了解牛奶钙含量的检测方法及其表示。
(2)了解络合滴定法的原理及方法。
2.实训原理
喝牛奶是补钙最常见的方式之一。测定各种牛奶钙含量有助于我们选择哪种牛奶来补钙。牛奶中钙含量为100~125 mg/100mL。测定牛奶中的钙常采取配位滴定法,用二乙胺四乙酸二钠盐(EDTA)溶液滴定牛奶中的钙。用EDTA测定钙,一般调节pH为9~10,以络蓝黑R指示剂,计量点前钙与钙试剂形成粉红配合物,当用EDTA溶液滴定至计量点时,游离出指示剂,溶液呈现蓝色。
在进行定量分析时,样品处理方法很关键,选择正确的样品处理方法是获得准确分析结果的基本保证。目前,常用的预处理方法有干式灰化法(干法)、湿式消化法(湿法)、直接酸溶法等,本实训采用干式灰化法处理牛奶,配合EDTA络合滴定法测定牛奶中钙含量。
滴定时有Fe3+、Al3+干扰时用三乙醇胺掩蔽。
3.仪器及试剂
(1)仪器用具
分析天平、马弗炉、干燥箱、酸式滴定管、碱式滴定管、烧杯、漏斗、滤纸、酒精灯、表面皿、量筒、容量瓶、可调式电炉、坩埚、锥形瓶、台式天平、移液管等。
(2)试剂
0.02mol/L EDTA标准溶液、2mol/L HCl、铬蓝黑R(5g/L)、2mol/L氨水、无水乙醇、饱和(NH4)2C2O4、商品牛奶等。
4.过程设计
①取1个干燥的干净烧杯,称重m,然后将移取100mL牛奶样品于烧杯内。
②将样品置于酒精灯上蒸发至黏稠状,停止加热,待冷却至室温后称重m1。转移包叠好一部分样品(约5g)的滤纸到坩埚中,再次称量烧杯的质量m2。(m1-m为黏稠液总质量,m1-m2为移取的黏稠液的质量)
③将盛有样品的坩埚放于电热恒温干燥箱烘干,然后在可调式电炉上先小火炭化至无烟,再移入马弗炉550~600℃灰化1~2 h,灼烧为固体粉末。
④将灼烧后的样品转移到烧杯中,用蒸馏水洗涤坩埚3~4次,将洗液一并转移入烧杯中,再加入2mol/L HCl溶液,使其完全溶解,调节溶液pH≈4。
⑤向烧杯中加入过量饱和(NH4)2C2O4溶液,约10mL,充分搅拌后过滤。
⑥用2mol/L HCl溶液洗涤漏斗中的沉淀及滤纸4~6次,并将洗液转移入250mL锥形瓶中,加适量水,滴加2mol/L NH3·H2O溶液,调节溶液pH为9~10。
⑦再滴加4~5滴铬蓝黑指示剂,用0.02mol/L EDTA标准溶液滴定至溶液由紫红色恰变为蓝色,即为终点。
⑧平行测定3次,根据消耗EDTA的体积计算出被滴定的钙的含量及每100mL牛奶中钙的含量。
⑨计算牛奶中的含钙量,以每100mL牛奶含钙的毫克数表示。
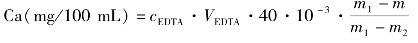
5.数据记录与结果处理
实训表26 牛奶中钙含量测定数据记录表
6.注意事项
(1)pH值必须调到9~10,EBT指示剂才能显色。
(2)开始滴定时滴定速度宜稍快,接近终点时滴定速度宜慢,每加1滴EDTA溶液后,都要充分摇匀。
7.实训思考
(1)配位滴定中为什么加入缓冲溶液?
(2)配位滴定法与酸碱滴定法相比,有哪些不同点?操作中应注意哪些问题?
实习实训18 生理食盐水中NaCl含量的测定
1.实训目的
(1)学习银量法测定氯的原理和方法;
(2)掌握莫尔法的实际应用。
2.实训原理
银量法是指以生成难溶银盐(如AgCl、AgBr、AgI和AgSCN)的反应为基础的沉淀滴定法成为银量法。银量法需要借助指示剂来确定滴定终点。根据作用指示剂的不同,银量法又分为莫尔法。佛尔哈德法和法扬司法。
本次实训采取莫尔法测定生理盐水中NaCl的含量,此法是以K2CrO4为指示剂,用AgNO3标准溶液进行滴定。由于Ag2CrO4的溶解度比AgCl大得多,因此滴定时首先析出AgCl沉淀,当AgCl定量沉淀后,稍微过量的AgNO3溶液即与CrO2-4生成砖红色的Ag2CrO4沉淀,指示终点到达。反应式为:
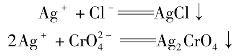
滴定必须在中性或弱碱性溶液中进行,最适宜的酸度范围是pH为6.5~10.5,酸度过高,不产生Ag2CrO4沉淀;酸度过低,则生成Ag2O沉淀。
K2CrO4指示剂的用量对滴定终点的准确判断有影响。如果K2CrO4指示剂加入过多或过少,亦即K2CrO4的浓度过高或过低,Ag2CrO4沉淀的析出就会偏早或偏迟,使终点提前或延迟出现。一般K2CrO4用量应控制在0.05mol/L为宜。
本法也可用于测定有机物中氯的含量。
3.仪器及试剂
(1)仪器用具
烧杯、分析天平、托盘天平、100mL容量瓶、坩埚、称量瓶、250mL锥形瓶、50mL酸式滴定管、25mL移液管等。
(2)试剂
AgNO3(s,分析纯)、NaCl(s,分析纯)、K2CrO4(5%)溶液、生理盐水样品等。
4.过程设计
(1)0.1mol/L AgNO3标准溶液的配制
AgNO3标准溶液可直接用分析纯的AgNO3结晶配制,但由于AgNO3不稳定,见光易分解,故若要精确测定,则要NaCl基准物来标定。
①直接配制:在一小烧杯中精确称量1.7g左右的AgNO3,加适量水溶解后,定量转移到100mL容量瓶中,用水稀释至刻度,摇匀,计算其准确浓度。
②间接配制:将NaCl置于坩埚中,用煤气灯加热至500~600℃干燥后,冷却,放置在干燥器中冷却备用。
用台秤称量1.7g的AgNO3,定量转移到100mL容量瓶中,用水稀释至刻度,摇匀。
标定:准确称取0.15~0.2g的NaCl 3份,分别置于3个锥形瓶中,各加25mL水使其溶解。加1mL K2CrO4溶液。在充分摇动下,用AgNO3溶液滴定至溶液刚出现稳定的砖红色,记录AgNO3溶液的用量,计算AgNO3溶液的浓度。
(2)测定生理盐水中NaCl的含量
将生理盐水稀释1倍后,用移液管精确移取已稀释的生理盐水25.00mL置于锥形瓶中,加入1mL的K2CrO4指示剂,用标准AgNO3溶液滴定至溶液刚出现稳定的砖红色(边摇边滴)。平行滴定3次,计算NaCl的含量。
(3)根据实训结果,计算以每1 L生理盐水中含NaCl的克数表示
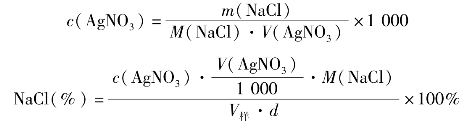
5.数据记录与结果处理
实训表27 AgNO3标准溶液的配制及浓度测定
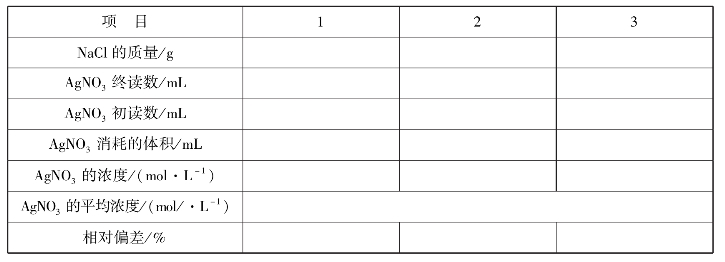
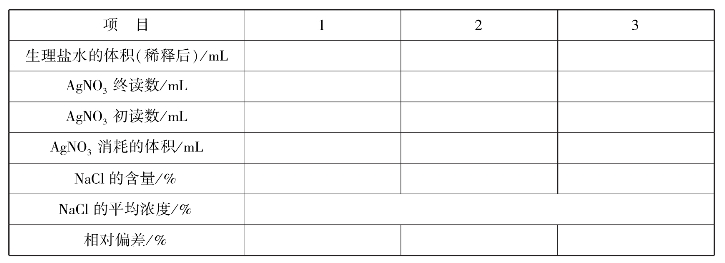
实训表28 生理盐水中NaCl的含量测定
6.注意事项
(1)AgNO3试剂及其溶液具有腐蚀性,能破坏皮肤组织,切勿碰触到皮肤及衣服。银是贵金属,含银的废液应回收。
(2)滴定终点的颜色接近于浅橙色(白色的AgCl沉淀中混有少量砖红色的Ag2CrO4沉淀),要防止滴过。
(3)实训完毕,滴定管要先用蒸馏水洗涤,再用自来水洗净,以免残留AgCl沉淀于滴定管壁上。
7.参考学时
2学时。
8.实训思考
(1)K2CrO4指示剂浓度的大小对Cl-1测定有何影响?
(2)能否用莫尔法以NaCl标准溶液直接滴定Ag+?为什么?
(3)配制好的AgNO3溶液要储于棕色瓶中,并置于暗处,为什么?
实习实训19 溴化钾含量的测定
1.实训目的
(1)学习佛尔哈德法测定溴的原理和方法。
(2)掌握佛尔哈德法的实际应用。
(3)掌握以NH4Fe(SO4)2·12H2O为指示剂确定终点的方法。
2.实训原理
佛尔哈德法分为直接滴定法和返滴定法两种,本实训采用的是返滴定法。在含有Br-的硝酸溶液中,加入适当过量的AgNO3标准滴定溶液,以NH4Fe(SO4)2·12H2O为指示剂,用NaSCN标准溶液返滴定剩余的AgNO3标准滴定溶液,当Ag+完全反应时,稍过量的SCN-与Fe3+生成[Fe(SCN)]2+红色配离子,指示终点到达。反应式如下:
滴定前:
Ag++Br- AgBr↓
AgBr↓
化学计量点前:
Ag++SCN- AgSCN↓
AgSCN↓
化学计量点及化学计量点后:
Fe3++SCN-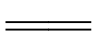 [Fe(SCN)]2+(红色)
[Fe(SCN)]2+(红色)
3.仪器及试剂
(1)仪器用具
烧杯、分析天平、称量瓶、250mL锥形瓶、50mL酸式滴定管、25mL移液管等。
(2)试剂
KBr(分析纯)、0.1mol/L AgNO3标准滴定溶液、40.0g/L NH4Fe(SO4)2·12H2O溶液、0.1mol/L NaSCN标准滴定溶液、HNO3(分析纯)等。
4.过程设计
称取KBr试样约0.2g(称准至0.000 1g)于250mL锥形瓶中,以50mL水溶解后,加入2mL 1mol/L HNO3溶液、40mL 0.1mol/L AgNO3标准滴定溶液,混匀后再加入2mL 40.0g/L NH4Fe(SO4)2·12H2O溶液,用0.1mol/L NaSCN标准滴定溶液滴定至微红色,经振摇后仍不褪色即为终点。记下消耗的体积。平行测定3次。计算KBr的质量分数。
5.数据记录与结果处理
实训表29 溴化钾含量测定数据记录表
6.注意事项
(1)AgNO3试剂及其溶液具有腐蚀性,能破坏皮肤组织,切勿碰触到皮肤及衣服。银是贵金属,含银的废液应回收。
(2)实训完毕,滴定管先用蒸馏水洗涤,再用自来水洗净,以免残留AgCl沉淀于滴定管壁。
7.参考学时
2学时。
8.实训思考
(1)佛尔哈德法中能否用硫酸或磷酸代替硝酸控制溶液酸度?为什么?
(2)佛尔哈德法的优缺点有哪些?
实习实训20 吸光光度法测定水和废水中总磷
1.实训目的
(1)掌握钼锑抗钼蓝光度法测定总磷的原理和操作方法。
(2)掌握用过硫酸钾消解水样的方法。
(3)掌握分光光度计操作技术。
2.实训原理
在天然水和废水中,磷几乎都以各种磷酸盐的形式存在,分别是正磷酸盐,缩合磷酸盐(焦磷酸盐、偏磷酸盐和多磷酸盐)以及与有机物相结合的磷酸盐。它们普遍存在于溶液、腐殖质粒子、水生生物或其他悬浮物中。关于水中磷的测定,通常按其存在形态,分别测定总磷,溶解性正磷酸盐和总溶解性磷。本实训采用过硫酸钾氧化⁃钼锑抗钼蓝光度法测定总磷。在微沸(最好是在高压釜内经120℃加热)条件下,过硫酸钾将试样中不同形态的磷氧化为磷酸根。在酸性条件下,正磷酸盐与钼酸铵反应(以酒石酸锑钾为催化剂),生成磷钼杂多酸,被抗坏血酸还原,变成蓝色络合物,即磷钼蓝。其钼蓝浓度的多少与磷含量成正相关,以此测定水样中的总磷。相关反应式如下:

本方法的最低检出浓度为0.01 mg/L,测定上限为0.6 mg/L,适用于测定地面水、生活污水及日化、磷肥、机械加工表面的磷化处理、农药、钢铁、焦化等行业的工业废水中的正磷酸盐分析。砷含量大于2 mg/L时,可用硫代硫酸钠除去干扰;硫化物含量大于2 mg/L,可以通入氮气除去干扰;若是铬含量大于50 mg/L,可用亚硫酸钠除去干扰。
3.仪器及试剂
(1)仪器用具
分光光度计、50mL容量瓶、刻度吸量管等。
(2)试剂
K2S2O850g/L、H2SO4[(3+7)、(1+1)、(1mol/L)]、NaOH(1mol/L,6mol/L)、酚酞(10g/L,95%的乙醇溶液);抗坏血酸溶液(100g/L)(用少量水将10g抗坏血酸溶解于烧杯中,并稀释至100mL,储存于棕色细口瓶中,待用。此溶液在较低温度下可稳定3周,如果发现变黄,则应重新配制);钼酸铵溶液(溶解13g钼酸铵[(NH4)6Mo7O24·4H2O]于100mL水中,另溶解0.35g酒石酸锑钾[KSbC4H4O7·1/2H2O]于100mL水中。在不断搅拌下,将钼酸铵溶液徐徐加入到300mL的(1+1)硫酸中,再加入酒石酸锑钾溶液,混匀,储存于棕色细口瓶中,置于冷处保存,至少可以稳定2个月));磷标准储备溶液(P,30μg/mL)(将装有磷酸二氢钾的称量瓶置于105~110℃的干燥箱中,干燥2 h,取出冷却后放入干燥器中。准确称取(0.131 7±0.001)g经过干燥的磷酸二氢钾置于烧杯中,加水溶解后转移至1 000mL容量瓶中,加入约800mL水、5mL H2SO4(1+1),再用水稀释至刻度,摇匀);磷标准工作溶液(P,3.0μg/mL)(准确吸取磷标准储备溶液25.00mL于250mL容量瓶中,用水稀释至刻度,摇匀。使用当天配制)。
4.过程设计
(1)水样的采取、消解及预处理
从水样瓶中分取25.00mL混匀的水样(含磷≤30μg)于250mL烧杯中,加水至50mL,加数粒玻璃珠,加1mL(3+7)H2SO4,5mL 50g/L K2S2O8。置于可调温电炉或电热板上加热至沸,保持微沸30~40min,至体积约10mL为止。冷却后,加1滴酚酞,边摇边滴加NaOH溶液至刚呈微红色,再滴加1mol/L H2SO4使红色刚好褪去。
(2)制作标准曲线
取7只50mL容量瓶,分别加入磷标准操作溶液0.00mL、1.00mL、3.00mL、5.00mL、7.00mL、10.00mL。
①显色:向容量瓶中加入1mL 10%抗坏血酸溶液,混匀,30 s后加2mL钼酸铵溶液充分混匀,加水至50mL,放置15min。
②测定:使用光程为1 cm比色皿,于700 nm波长处,以试剂空白溶液为参比,测定吸光度。以磷含量为横坐标,吸光度值为纵坐标,绘制标准曲线。
(3)试样测定
对已经处理的样品,按步骤①、②进行显色和测定吸光度。从标准曲线上查出磷的含量。
5.数据记录与结果处理
实训表30 标准曲线的制作数据记录表
实训表31 试样测定结果记录表

6.注意事项
(1)为了防止光电管疲劳,不测定时必须将试样室盖打开,使光路切断,以延长光电管的使用寿命。
(2)取拿比色皿时,手指只能捏住比色皿的毛玻璃面,而不能碰比色皿的光学表面。
7.参考学时
2学时。
8.实训思考
(1)本实训测定吸光度时,以试剂空白溶液为参比,这同以水作参比时相比较,在扣除试剂空白方面,做法有何不同?
(2)分光光度计的主要部件有哪些?
知识拓展
722型分光光度计的使用方法
1)预热仪器
将选择开关置于“T”,打开电源开关,使仪器预热20min。为了防止光电管疲劳,不要连续光照,预热仪器时和不测定时应将试样室盖打开,使光路切断。
2)选定波长
根据实验要求,转动波长手轮,调至所需要的单色波长。
3)固定灵敏度档
在能使空白溶液很好地调到“100%”的情况下,尽可能采用灵敏度较低的挡,使用时,首先调到“1”挡,灵敏度不够时再逐渐升高。但换挡改变灵敏度后,须重新校正“0%”和“100%”。选好的灵敏度,实验过程中不要再变动。
4)调节T=0%
轻轻旋动“0%”旋钮,使数字显示为“00.0”,(此时试样室是打开的)。
5)调节T=100%
将盛蒸馏水(或空白溶液,或纯溶剂)的比色皿放入比色皿座架中的第一格内,并对准光路,把试样室盖子轻轻盖上,调节透过率“100%”旋钮,使数字显示正好为“100.0”。
6)吸光度的测定
将选择开关置于“A”,盖上试样室盖子,将空白液置于光路中,调节吸光度调节旋钮,使数字显示为“.000”。将盛有待测溶液的比色皿放入比色皿座架中的其他格内,盖上试样室盖,轻轻拉动试样架拉手,使待测溶液进入光路,此时数字显示值即为该待测溶液的吸光度值。读数后,打开试样室盖,切断光路。重复上述测定操作1~2次,读取相应的吸光度值,取平均值。
7)浓度的测定
选择开关由“A”旋置“C”,将已标定浓度的样品放入光路,调节浓度旋钮,使得数字显示为标定值,将被测样品放入光路,此时数字显示值即为该待测溶液的浓度值。
8)关机
实验完毕,切断电源,将比色皿取出洗净,并将比色皿座架用软纸擦净。
722型分光光度计实物图如下图所示。

722型分光光度计
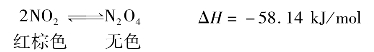







 =cα
=cα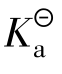 。
。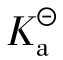 =cα
=cα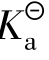 。
。
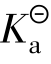 (HAc)有误差?试讨论怎样才能减少误差。
(HAc)有误差?试讨论怎样才能减少误差。






 4H
4H




 CH
CH

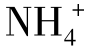 的酸性太弱(K
的酸性太弱(K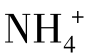 作用,生成质子化的六次甲基四胺(K
作用,生成质子化的六次甲基四胺(K

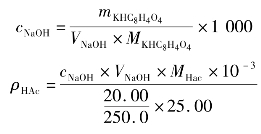

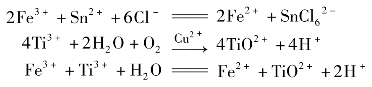
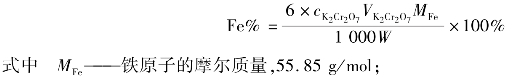









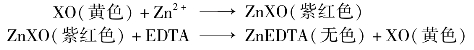
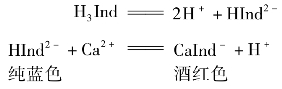


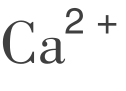 、
、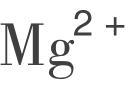 含量的测定
含量的测定



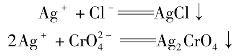
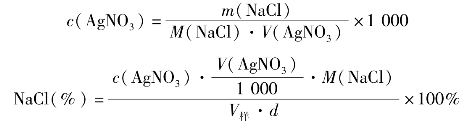


 AgBr↓
AgBr↓ AgSCN↓
AgSCN↓ [Fe(SCN)]
[Fe(SCN)]