摩尔吸光系数ε表示溶液浓度为1mol/L,液层厚度为1 cm时溶液的吸光度,单位为L/(mol·cm)。它是各种吸光物质对一定波长单色光吸收的特征常数,可作为定性分析的参考和估量定量分析方法的灵敏度。ε越大,方法的灵敏度越高。因此,在吸光光度分析中,为提高分析的灵敏度,一般选择ε较大的物质,并以其最大吸收波长作为入射光工作波长。
使用朗伯⁃比尔定律时,应注意溶液的浓度。在高浓度(c>0.01mol/L)时,吸光物质的分子或离子间平均距离缩小,使相邻吸光微粒相互影响,改变它们对特定波长光的吸收能力,使吸光度与浓度之间的线性关系发生偏离。当c≤0.01mol/L,微粒间的相互作用可忽略不计,所以一般认为朗伯⁃比尔定律仅适用于稀溶液。
9.2 显色反应和显色剂
9.2.1 显色反应的要求
在吸光光度分析时,不是所有的待测物质都具备颜色,对于无色的物质,可加入显色剂使其变成有色物质,然后进行测定。
被测物质在某一试剂的作用下,生成有色化合物(或络合物)或使该试剂颜色变化的反应,称为显色反应,而这类试剂就叫显色剂。对于显色反应,一般应满足以下条件:
1)灵敏度高
吸光光度法通常用于测量微量组分,所以灵敏度高的显色反应更为有利。灵敏度的高低,可从摩尔吸光系数(ε)的高低来判断。ε越大,灵敏度越高。但对于高含量的组分测定,则不一定要选择灵敏度高的显色反应。
2)选择性好
一种显色剂最好只和一种被测组分发生显色反应,以减少干扰。或产生的干扰离子容易被消除,再或者产生的干扰离子与生成的有色化合物的最大吸收波长(λmax)相隔较远。
3)生成的有色化合物性质稳定
生成的有色化合物不易受外界环境的影响,如在日光照射条件下不发生变化、不与空气中的O2和CO2反应等。
4)有色化合物与显色剂之间色差要大
这样显色时变化鲜明,试剂空白一般较小,可提高测定的准确度。一般要求有色化合物与显色剂的最大吸收波长之差在60 nm以上。
9.2.2 影响显色反应的因素
1)显色剂的用量
吸光光度分析中,为使显色反应尽量反应完全,加入的显色剂常常需要过量。但过量太多的显色剂容易引起副反应,影响测定结果。同时,不少显色剂本身具有颜色,过量太多会使空白增高。
所以,显色剂的适宜用量,要通过实验来确定,实验方法是在几个相同组分中加入不同量的显色剂,分别测定其吸光度,绘制吸光度与显色剂用量的关系曲线,如图9.4所示。在曲线的平坦处选取一个适当的显色剂用量(稍稍过量)。
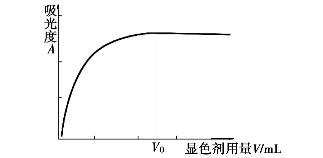
图9.4 吸光度与显色剂用量关系曲线
2)溶液的酸度
溶液的酸度对显色反应的影响很大,这是由于它可以直接影响金属离子和显色剂的存在以及所形成的有色络合物的组成和稳定性。溶液酸度的影响主要体现在:
(1)对显色剂本身颜色的影响
不少有机显色试剂在不同的酸碱度下,颜色不同,有的颜色可能干扰到有色络合物的颜色。例如偶氮胂Ⅲ,在pH≤3时,呈玫瑰红色;在7≥pH≥4时,呈紫色;在pH>7时,呈蓝色。
(2)对显色剂浓度的影响
由于不少有机显色剂是弱酸,因而溶液中的酸度影响其离解度,即其浓度,进而影响显色反应的反应程度。
(3)对金属离子价态的影响
很多高价态金属离子容易水解,在酸度较小的情况下,能形成碱式盐或氢氧化物沉淀,影响测定。
(4)对络合物组成的影响
对于一些逐级生成络合物的显色反应,酸度不同,络合物的络合比不同,其颜色也不同。例如磺基水杨酸与Fe3+的显色反应,在不同的酸度条件下,可生成1∶1、1∶2和1∶3 3种颜色的络合物。在这种情况下,必须控制适宜的酸度,才能获得较好的分析结果。
选择显色反应适宜的酸度范围,可通过绘制酸度曲线来确定。其方法是:待测组分及显色剂浓度不变,通过改变溶液的pH值,绘制吸光度与pH值的关系曲线,如图9.5所示,选择曲线平坦部分对应的pH值范围作为最佳酸度范围。
3)显色温度
显色反应一般在室温下进行,但也有反应需要加热至一定温度才能进行。在温度较高时,有色物质又容易分解。为此,不同显色反应需要通过实验找出适宜的温度。
4)显色时间
大多数显色反应需要经过一定的时间才能反应完全,其时间的长短又与温度有关。例如硅钼蓝法测硅,在室温下需要10min以上,而在沸水浴中只需30 s。有的有色物质生成后,性质相当稳定,这类反应的测定时间比较宽松;而有的有色物质生成后,久置可能发生变化,就需要在显色后尽快测定完毕。
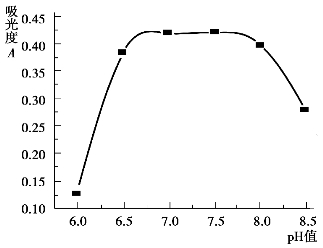
图9.5 吸光度与pH值的关系曲线
5)溶剂的影响
有机溶剂能降低有色络合物的离解度,从而提高显色反应的灵敏度。同时有机溶剂还能提高显色反应的速率,以及影响有色络合物的溶解度和组成。如用氯代磺酚S测定Nb,在水溶液中显色需要几个小时,加入丙酮后只需30min。
6)溶液中干扰离子的影响及消除方法
(1)影响
溶液中干扰离子的存在对吸光光度法测定的影响主要有:
①干扰离子本身有颜色,影响测定。例如Cu2+显蓝色、Co2+显红色、Fe3+显黄色。
②干扰离子与显色剂生成有色络合物,使测定结果偏高。例如用H2O2测定Ti4+时,Mo6+、Ce4+等与H2O2同样能形成黄色络合物,从而干扰实验结果。
③干扰离子与显色剂生成无色络合物,消耗显色试剂而使被测离子与显色剂反应不完全。例如用水杨酸测Fe3+时,Al3+、Cu2+离子就会产生此类影响。
④干扰离子与被测离子形成离解度小的化合物。例如用SCN-测定Fe3+时,由于F-的存在,能与Fe3+形成[FeF6]3-,从而影响测定结果。
⑤干扰离子具有强氧化性或还原性时,易破坏显色剂。例如Mn7+、V5+存在时,能破坏偶氮胂Ⅲ,影响显色。
(2)消除方法
消除干扰的方法,主要有以下几种:
①控制溶液的酸度。许多显色剂是有机弱酸,控制溶液的酸度就可以控制显色剂的浓度,使某种金属离子显色,而使其余一些金属离子不能生成有色络合物。例如以水杨酸测定Fe3+时,Cu2+也能形成黄色络合物。但两种络合物的离解常数不一样,当溶液pH=2.5时,Cu2+不能与水杨酸生成络合物,而Fe3+则能完全形成有色络合物。
②加入掩蔽剂。在显色试剂中加入一种能与干扰离子反应,生成无色络合物的试剂,也是消除干扰的常见办法。例如,用硫氰酸盐测定Co2+时,Fe3+会产生干扰,可加入氟化物,使Fe3+形成无色的[FeF6]3-,即可消除干扰。此外,还可利用氧化还原反应,改变干扰离子的价态,从而消除干扰。例如用硫氰酸盐测定钼,加入还原剂,将产生干扰的Fe3+还原为Fe2+,Fe2+不能与SCN-发生显色反应。这样就能去除Fe3+干扰。
③分离干扰离子。在没有合适的掩蔽试剂时,可采用沉淀法、离子交换法、溶剂萃取法等分离方法去除干扰离子。
④利用参比溶液。某些干扰离子带来的影响,可用参比溶液抵消。例如用铬天青S测定Al3+时,Ni2+、Cr3+会对测定形成干扰。为此,可取部分溶液加入少量氟化铵,与Al3+生成AlF6
3-以此作为参比溶液进行测定,从而消除干扰。
9.2.3 吸光光度法测量条件的选择
选择适当的测量条件,是获得准确结果的重要前提。吸光光度法测量条件的选择,主要做到以下3个方面:
1)选择合适波长的入射光
有色物质对各种波长的光有选择性吸收,为使测定结果有较高的灵敏度和准确度,入射光的波长选择要以摩尔吸光系数最大、灵敏度最高为原则。根据吸收曲线,选择最大吸光度的波长。但如果在该波长处,溶液中其他离子也有吸收,则会形成干扰。这时,就需要选择其他非最大吸收的波长,以排除干扰。这样虽然牺牲了一定的灵敏度,但分析的准确度得到了保证。所以入射光波长的选择的原则可以用“吸收最大,干扰最小”来概括。
例如用丁二酮肟光度法测定钢中的镍配物丁二酮肟镍的最大吸收波长为470 nm,但试样中的铁用酒石酸钠掩蔽后,在470 nm处也有一定吸收(如图9.6所示),干扰镍的测定。为避免铁的干扰,可以选择波长520 nm进行测定,虽然镍测定的灵敏度有所降低,但酒石酸铁不干扰镍的测定。
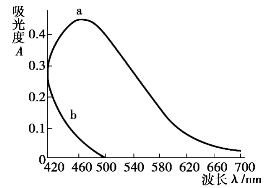
图9.6 丁二酮肟光度法则定钢中的镍
a—丁二酮肟镍;b—酒石酸铁
2)控制吸光度的读数范围
吸光度在0.2~0.8时,测量的准确度较高。为此,需要将吸光度的读数控制此范围内,以得到准确度更高的结果。为此,可以计算而且控制样品的量,含量高时,少取样或稀释试液;含量低时,可多取样或萃取富集。此外,如果溶液已经进行了显色反应,还可通过改变比色皿的厚度,来调节吸光度的大小。
3)选择适当的参比溶液
参比溶液是用来调节仪器工作零点的。能否正确地选择参比溶液,对测定的结果影响较大。选择的办法是:
①如果样品溶液、试剂、显色剂均无色,可以用蒸馏水作为参比溶液。
②如果显色剂无色,而样品溶液中含有其他有色离子,应采用不加显色剂的样品溶液作为参比溶液。
③如果显色剂和试剂均有颜色,可将一份试液加入适当的掩蔽剂,将被测组分掩蔽起来,使之不再发生显色反应,然后把显色剂按操作程序加入试剂,以此作为参比溶液,以消除干扰。
9.3 吸光光度分析的方法
9.3.1 目视比色法
用眼睛比较溶液颜色的深浅以测定物质含量的方法,称为目视比色法。
常用的目视比色法是标准系列法。这种方法就是使用一套由同种材料制成的,大小形状相同的平底玻璃管(称为比色管,其容量有10mL、25mL、50mL、100mL 4种)。在这套比色管中逐一加入浓度逐渐增加的标准溶液、相同体积的显色剂和辅助试剂,然后稀释至同一刻度,形成颜色从浅到深的标准色阶。另取一只同样大小的比色管,在其中加入待测溶液与和标准色阶相同体积的显色剂和辅助试剂,稀释到同样刻度。之后从比色管管口垂直向下观察其颜色,并与标准色阶比较。若被测溶液颜色深浅与标准色阶中某一溶液相同,则说明两者浓度相同;若被测溶液颜色深浅介于两标准溶液之间,则被测溶液浓度约为两标准溶液浓度的算术平均值。
目视比色法的主要优点是设备简单,操作简便。由于比色管较长,在垂直观察时液层较厚,对于颜色很淡的溶液也能测出其含量,使测定的灵敏度较高。且目视比色法在自然光下进行,且测定条件完全相同,一些不完全服从郎伯⁃比尔定律的溶液,也能用目视比色法或吸光光度法进行测定。
目视比色法的主要缺点是准确度不高,如果待测液中存在第2种有色物质,甚至会无法进行测定。另外,由于许多有色溶液颜色不稳定,标准系列不能久存,经常需在测定时配制,比较麻烦。虽然可采用其某些稳定的有色物质(如重铬酸钾、硫酸铜和硫酸钴等)配制永久性标准系列,或利用有色塑料、有色玻璃制成永久色阶,但由于它们的颜色与试液的颜色往往有差异,也需要进行校正。
9.3.2 分光光度法
1)基本原理
分光光度法是用棱镜或光栅作为分光器,用狭缝分出波长很窄的一束光。这种单色光波长范围比较窄,一般在5 nm左右,因此测定的灵敏度、选择性和准确性都比较高。
由于单色光的纯度很高,因此可用分光光度法绘制出比较精细的吸收光谱曲线,再选择适当的波长进行测定,可以准确地测出待测组分的含量。
2)分光光度计的基本部件
分光光度计一般由光源、分光系统、比色皿(吸收池)、检测系统4部分组成,如图9.7所示。
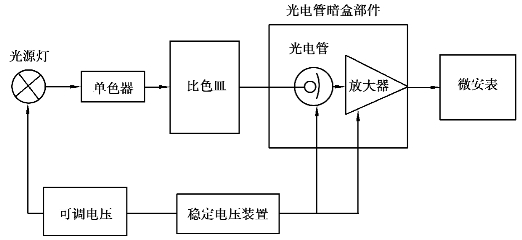
图9.7 分光光度计组成
(1)光源
常用的光源为6~12 V的低压钨丝灯泡,电源由变压器供给,且电压必须保持稳定,以保持光源强度的稳定。因此,许多分光光度计上都采用磁饱和稳压变压器作为电源。另外,为使通过待测溶液的光线是平行光束,分光光度计上都附有聚光透镜。
(2)分光系统
这是一种能把光源发出的复合光按照波长的不同进行色散,并能分出所需波长的单色光的光学装置。其一般包含狭缝、色散元件、反光镜等。色散元件用棱镜或光栅做成。棱镜有玻璃棱镜和石英棱镜,玻璃棱镜的色散范围在360~700 nm,石英棱镜的色散范围在200~1 000 nm,光栅色散的波长范围更宽,但分出的单色光强度较弱。
(3)比色皿(吸收池)
用透明、无色的光学玻璃制造,大多数为长方形,也有圆柱形的。分光光度计一般配有厚度为0.5 cm、1 cm、2 cm、3 cm、5 cm的一套比色皿,以供选用。在使用前,最好对标识同等厚度的比色皿进行检验。检验方法为:将同等浓度的某溶液分别装入比色皿,放入分光光度计,在光源强度和波长不变的情况下,观察检流计的透光读数是否一致,如果一致,则比色皿厚度相等。
(4)检测系统
这是把透光比色皿后的透过光强度转为电信号的装置。分光光度计中常用的检测器包括光电管、放大器及检流计。光电管是一种两极管,在阴极管上涂有光敏物质,光敏物质在受光线照射时会放出电子,形成阴极流向阳极的电流,且电流大小与受光照的强度成正比。由于光电管产生的电流很小,需要用放大装置将其放大,才能使用微安表(检流计)进行测量。分光光度计中的检流计属于精密仪器,灵敏度可达10-9 A。为保护检流计,使用中要防止震动或大电流通过。当仪器不用时,必须将检流计开关指向零位,使其断路。
3)分光光度计的分类
按工作波长范围的不同,分光光度计可分为可见光分光光度计(400~760 nm)、紫外⁃可见分光光度计(200~760 nm)及红外分光光度计(760~40 000 nm)。可见紫外分光光度计主要用于无机和有机物的含量分析,红外分光光度计则主要用于有机物的结构分析。
9.4 吸光光度法的运用
9.4.1 标准曲线法
吸光光度法常用于标准曲线法对某组分含量的测定。与其他许多分析中的标准曲线法类似,要配制一系列不同浓度的标准溶液,在选定的测定波长处测定各标准溶液的吸光度,以吸光度对溶液浓度作图,得到一条标准曲线。然后再同一波长处测得待测溶液的吸光度,并据此在标准曲线上查找与之对应的浓度值,就是待测溶液中该组分的含量。
必须指出,标准曲线法是基于有色溶液完全服从郎伯⁃比尔定律的前提下的。但在某些情况下,一些有色溶液可能并不遵从郎伯⁃比尔定律。这时候采用标准曲线法,就会产生一定的误差。检验有色溶液是否遵从郎伯⁃比尔定律,就要看标准曲线是否是一条过经过原点的直线,如果是,则说明该色溶液遵从郎伯⁃比尔定律;如果标准曲线是一条直线,但不经过原点,则说明参与溶液的选取有误;如果标准曲线是一条曲线,则说明该有色溶液出现了偏离郎伯⁃比尔定律的现象。
偏离郎伯⁃比尔定律的原因有很多,基本可归为物理原因和化学原因两大类。
1)物理原因
(1)单色光不纯
严格意义上,郎伯⁃比尔定律只对同一波长的单色光才成立,但在实际工作中,仪器得到的入射光是有一定波长范围的,并非纯粹的单色光。因此会导致对郎伯⁃比尔定律的偏离。
(2)入射光非平行或被散射
入射光不是平行入射,也就不是垂直通过比色皿,会导致比色皿实际厚度增加,吸光度增大。另外溶液中可能存在的胶粒或悬浮颗粒,使入射光散射,实测吸光度增大,导致对郎伯⁃比尔定律的偏离。
2)化学原因
(1)溶液浓度过大
吸光物质的分子或离子间平均距离缩小,使相邻吸光微粒相互影响,改变它们对特定波长光的吸收能力,使吸光度与浓度之间的线性关系发生偏离。
(2)溶液中有色物质作用
溶液中有色物质的缔合、解离、互变异构、络合等现象,都可能会导致对郎伯⁃比尔定律的偏离。
9.4.2 对照样品比较法
绘制吸光光度法的标准曲线需要配置和测定一系列不同浓度的标准溶液,这项工作有时候会显得比较麻烦。既然在有色溶液完全服从郎伯⁃比尔定律时,标准曲线为过原点的直线,那么从理论上,只要测定任意一个浓度的标准溶液,就可以确定这条直线的斜率,从而得出标准曲线。据此,我们可以用先配制一份标准溶液,加入显色剂,并测定其的吸光度,以此作为对照样品。再用完全一致的方法对待测溶液显色,测定其吸光度,最后用如下方法计算待测溶液的浓度:
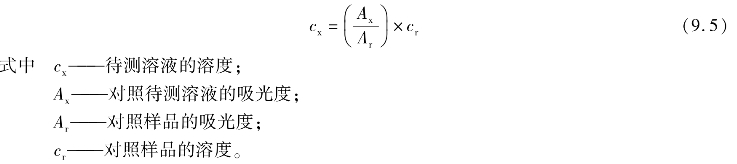
需要注意的是,由于只采用了一个对照样品作为测定依据,计算出的待测溶液浓度结果可能会有误差。特别是待测溶液浓度与对照样品浓度差距较大时,误差可能会较大。所以,在使用对照样品比较法时,待测溶液浓度与对照样品浓度相差不能超过10%。如果发现两者差距过大,应该重新配置对照样品溶液。
9.4.3 应用实例
1)邻二氮菲吸光光度法测铁
(1)实验原理
邻二氮菲(phen)和Fe2+在pH为3~9的溶液中,生成一种稳定的橙红色络合物Fe(phen)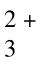 ,其lg K=21.3,508 nm处ε=1.1×104 L/(mol·cm),铁含量在0.1~6μg/mL范围内遵守比尔定律,其吸收曲线如图9.8所示。显色前需用盐酸羟胺或抗坏血酸将Fe3+全部还原为Fe2+,然后再加入邻二氮菲,并调节溶液酸度至适宜的显色酸度范围。有关反应如下:
,其lg K=21.3,508 nm处ε=1.1×104 L/(mol·cm),铁含量在0.1~6μg/mL范围内遵守比尔定律,其吸收曲线如图9.8所示。显色前需用盐酸羟胺或抗坏血酸将Fe3+全部还原为Fe2+,然后再加入邻二氮菲,并调节溶液酸度至适宜的显色酸度范围。有关反应如下:
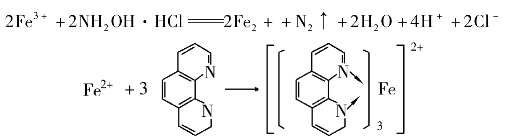
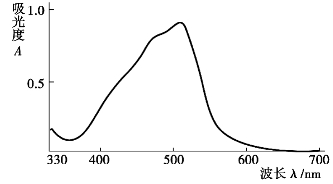
图9.8 邻二氮菲一铁(Ⅱ)的吸收曲线
(2)仪器和试剂
①仪器。分光光度计、容量瓶、移液管等。
②试剂。1×10-3mol/L铁标准溶液;100g/L盐酸羟胺水溶液;1.5g/L邻二氮菲水溶液(避光保存,溶液颜色变暗时即不能使用);1.0mol/L乙酸钠溶液;0.1mol/L氢氧化钠溶液。
(3)实验步骤
①显色标准溶液的配制。在序号为1~6的6只50mL容量瓶中,用吸量管分别加入0mL、0.20mL、0.40mL、0.60mL、0.80mL、1.0mL铁标准溶液(含铁0.1g/L),分别加入1mL的100g/L盐酸羟胺溶液,摇匀后放置2min,再各加入2mL 1.5g/L邻二氮菲溶液、5mL的1.0mol/L乙酸钠溶液,以水稀释至刻度,摇匀。
②吸收曲线的绘制。在分光光度计上,用1 cm吸收池,以试剂空白溶液(1号)为参比,在440~560 nm,每隔10 nm测定一次待测溶液(5号)的吸光度A,以波长为横坐标,吸光度为纵坐标,绘制吸收曲线,从而选择测定铁的最大吸收波长。
③显色剂用量的确定。在7只50mL容量瓶中,各加2.0mL 10-3mol/L铁标准溶液和1.0mL 100g/L盐酸羟胺溶液,摇匀后放置2min。分别加入0.2mL、0.4mL、0.6mL、0.8mL、1.0mL、2.0mL、4.0mL的1.5g/L邻二氮菲溶液,再各加5.0mL的1.0mol/L乙酸钠溶液,以水稀释至刻度。以水为参比,在选定波长下测量各溶液的吸光度。以显色剂邻二氮菲的体积为横坐标、相应的吸光度为纵坐标,绘制吸光度⁃显色剂用量曲线,确定显色剂的用量。
④溶液适宜酸度范围的确定。在9只50mL容量瓶中各加入2.0mL的1×10-3mol/L。铁标准溶液和1.0mL的100mol/L盐酸羟胺溶液,摇匀后放置2min。各加2mL的1.5g/L邻二氮菲溶液,然后从滴定管中分别加入0mL、2.00mL、5.00mL、8.00mL、10.00mL、20.00mL、25.00mL、30.00mL、40.00mL的0.1mol/L NaOH溶液,以水稀释至刻度,摇匀。用精密pH试纸或酸度计测量各溶液的pH。以水为参比,在选定波长下,用1 cm吸收池测量各溶液的吸光度。绘制A⁃pH曲线,确定适宜的pH范围。
⑤络合物稳定性的研究。移取2.0mL的1×10-3mol/L铁标准溶液于50mL容量瓶中,加入1.0mL 100g/L盐酸羟胺溶液混匀后放置2min。2.0mL的1.5g/L邻二氮菲溶液和5.0mL的1.0mol/L。乙酸钠溶液,以水稀释至刻度,摇匀。以水为参比,在选定波长下,用1 cm吸收池,每放置一段时间测量一次溶液的吸光度。放置时间:5min、10min、30min、1 h、2 h、3 h。以放置时间为横坐标、吸光度为纵坐标绘制A⁃t曲线,对络合物的稳定性作出判断。
⑥标准曲线的测绘。以步骤①中试剂空白溶液(1号)为参比,用1 cm吸收池,在选定波长下测定2~6号各显色标准溶液的吸光度。在坐标纸上,以铁的浓度为横坐标,相应的吸光度为纵坐标,绘制标准曲线。
⑦铁含量的测定试样溶液按步骤①显色后,在相同条件下测量吸光度,由标准曲线计算试样中微量铁的质量浓度。
2)钼锑抗吸光光度法测磷
(1)实验原理
在一定酸度和锑离子存在的情况下,磷酸根与钼酸铵形成锑磷钼混合杂多酸,它在常温下可迅速被抗坏血酸还原为钼蓝,在650 nm波长下测定。实验的适宜酸度为0.28~0.38mol/L H2SO4,适宜温度为20~60℃,显色时间为30~60min,可稳定24 h,含磷(5× 10-6~2×10-4)%范围内符合线性关系。
(2)仪器和试剂
①仪器。10支25mL比色管、吸量管、分光光度计、移液管、容量瓶等常用仪器。
②试剂。过硫酸钾;1+1硫酸(浓硫酸与蒸馏水的体积比为1∶1混匀);100g/L(10%)抗坏血酸溶液;钼酸盐溶液;磷酸盐标准溶液(浓度为2μg/mL)。
(3)实验步骤
①标准曲线的绘制。取7支25mL比色管,分别加入磷酸盐标准溶液:0mL、0.5mL、1.0mL、3.0mL、5.0mL、10.0mL、15.0mL,加水定容。此时系列标准液浓度为:0μg/mL、0.04μg/mL、0.08μg/mL、0.24μg/mL、0.4μg/mL、0.8μg/mL、1.2μg/mL。
②消解。在上述比色管中加入0.04g过硫酸钾,旋紧盖子,置于消解器内120℃消解30min,取出冷却。
③显色测量。在比色管中加入1mL抗坏血酸溶液,混匀静置30 s,加2mL钼酸盐溶液充分混匀,静置15min。650 nm下,以0μg/mL标准液为空白,测定吸光度。
④样品的测定。取5mL试样于25mL比色管内,加水定容。按上述方法操作。
⑤由标准曲线计算试样中微量磷的质量浓度。
3)水杨酸吸光光度法测铵
(1)实验原理
在亚硝基五氰络铁(Ⅲ)酸钠的存在下,铵与水杨酸和次氯酸离子的反应生成蓝色化合物,在679 nm下用分光光度计进行测定,在此波长处ε=1.5×104 L/(mol·cm)。在测定中添加酒石酸钾钠作为掩蔽剂,消除钙、镁离子的干扰。实验的适宜酸度为pH=11.7。
(2)仪器和试剂
①仪器。分光光度计、吸量管、移液管、容量瓶等常用仪器。
②试剂。铵氮标准溶液(浓度1 mg/L);显色液(水杨酸50g、2mol/L氢氧化钠160mL、酒石酸钾钠50g共同定容于1 000mL容量瓶中);次氯酸钠溶液(有效铵浓度0.35%);亚硝基五氰络铁(Ⅲ)酸钠溶液。
(3)实验步骤
①向一组6个10mL容量瓶中加入铵氮标准溶液0mL、1mL、2mL、4mL、6mL、8mL。
②显色。加入1mL显色剂和2滴亚硝基五氰络铁(Ⅲ)酸钠溶液,混匀,再滴入2滴次氯酸钠溶液,加水稀释至刻度,混匀。
③60min后,在679 nm下用分光光度计进行测定溶液的吸光度。采用1 cm的比色皿,参比溶液使用蒸馏水。
④绘制吸光度对铵氮浓度的标准工作曲线,该曲线应笔直且通过原点。
⑤样品的测定。取1mL试样于10mL容量瓶内,显色、加水定容。按上述方法操作。
⑥由标准曲线计算试样中微量铵的质量浓度。
本意小结
一、吸光光度法的基本原理
1.溶液显色的原因是溶液中物质对光的选择性吸收,在自然光下,溶液的颜色与吸收光的颜色呈互补关系。
2.物质的吸收光谱主要由吸光物质自身的结果决定,此外还受到溶剂、温度、仪器等的影响,这些可以作为物质定性分析的依据。
3.利用吸光光度法进行物质的定量分析的理论依据是郎伯⁃比尔定律:A=kbc。其意义是当一束平行的单色光通过均匀的、非散射的含有吸光物质的溶液时,溶液的吸光度与溶液的浓度和液层的厚度的乘积成正比。
二、显色反应和显色剂
1.吸光光度法中对于显色反应的要求是保证灵敏,排除干扰,生成色差明显、性质稳定的有色化合物。
2.显色剂的用量、溶剂、溶液酸度、干扰离子、显色时间和温度都会对显色反应造成影响,需要采取加入掩蔽剂、控制酸度、选择合理用量等方法加以消除。
三、吸光光度分析的方法
1.在进行吸光光度测量时,需要注意:以“吸收最大,干扰最小”的原则选择适合入射波长;控制读数范围在0.2~0.8;选择合适的参比溶液。
2.吸光光度的分析方法包括目视比色法和分光光度法。
3.根据吸光光度法原理,可以运用标准曲线法和对照样品比较法等方法对服从郎伯⁃比尔定律的溶液进行浓度测定。
目标检测
一、填空题
1.不同浓度的同一物质,其吸光度随浓度增大而________,但最大吸收波长________,摩尔吸光系数________。
2.为了使分光光度法测定准确,吸光度应控制在0.2~0.8,可采取措施有________和________。
3.摩尔吸光系数是吸光物质________的度量,其值越________,表明该显色反应越________。
4.某一有色溶液,在比色皿厚度为2 cm时,测得吸光度为0.340。如果浓度增大1倍时,其吸光度A=________,T=________。
5.在紫外⁃可见分光光度法中,标准曲线是________和________之间的关系曲线。当溶液符合郎伯⁃比耳定律时,此关系曲线应为________。
二、选择题
1.硫酸铜溶液显蓝色是因为它吸收了白光中的( )。
A.蓝色光B.绿色光C.黄色光D.紫色光
2.可见光的波长范围是( )。
A.200~760 nm B.400~760 nm C.300~760 nm D.760~40 000 nm 3.在分光光度法中,适宜的读数范围是( )。
A.0~0.2 B.0.1~0.4 C.0.3~0.7 D.0.2~0.8
4.分光光度计的基本部件,不包含( )。
A.电压表 B.电源 C.比色皿 D.分光器
5.在显色反应中,显色剂的用量应该是( )。
A.尽量少用 B.稍稍过量 C.过量很多 D.没有固定要求
6.在显色反应中,对于显色时间的描述错误的是( )。
A.一些反应生成的有色化合物非常稳定,测定时间比较宽松,没有严格规定。
B.生成的一些有色化合物,久置后可能褪色,所以在显色后需要尽快测定。
C.显色反应所需的时间,和温度及使用的溶剂有关。
D.显色反应大多需要一定的反应时间,所以测定时间可以多延迟一些。
7.以下说法正确的是( )。
A.溶液的透光度与溶度成正比 B.物质的摩尔吸光系数随波长而变
C.玻璃棱镜适合紫外分光光度计使用 D.物质的摩尔吸光系数与溶剂无关
8.在紫外⁃可见分光光度法测定中,使用参比溶液的作用是( )。
A.调节仪器透光率的零点
B.吸收入射光中测定所需要的光波
C.调节入射光的光强度
D.消除试剂等非测定物质对入射光吸收的影响
9.在比色法中,显色反应应选择的条件不包括( )。
A.显色时间 B.入射光波长
C.显色的颜色 D.显色剂的用量
10.酸度对显色反应影响很大,这是因为酸度的改变可能影响( )(多选)。
A.反应产物的稳定性 B.被显色物的存在状态
C.反应产物的组成 D.显色剂的浓度和颜色
三、判断题
1.吸收光谱曲线中吸收峰随溶液浓度的增大而增高,但最大吸收波长不变。( )
2.吸光光度分析中,透过光与吸收光互为互补色光。( )
3.目视比色法的优点之一就是标准色阶可以长期保存。( )
4.溶液的颜色越深,其吸收自身颜色的补色光越多。( )
5.红色和绿色为互补色光。( )
6.显色反应中摩尔吸光系数(ε)越小,灵敏度越高。( )
7.透射比越大,有色物质的吸光度就越高。( )
8.有色物质是否服从朗伯⁃比尔定律可通过绘制标准工作曲线来检验。( )
9.物质摩尔吸光系数的大小,只与该有色物质的结构特性有关。( )
10.若待测物、显色剂、缓冲溶液等有吸收,可选用不加待测液而其他试剂都加的空白溶液为参比溶液。( )
四、简答题
1.吸光光度法中对于显色反应有哪几点要求?
2.简述目视比色法的操作流程,并简要说明其优缺点。
3.简述影响显色反应中干扰离子可能产生的影响及消除干扰的方法。
4.简述在吸光光度法测量中,如何选定适宜的入射光波长。
5.有色溶液出现了偏离郎伯⁃比尔定律的现象的原因有哪些?
五、计算题
1.某溶液用厚度为2 cm比色皿进行测定时,透射比T=60%,若其改用厚度为1 cm的比色皿,透射比T及吸光度A为多少?
2.50mL的溶液中含有51μg的铜离子,加入显色剂反应后,用吸光光度法进行测定,在厚度为2 cm的比色皿中,于波长600 nm处测得T=50.5%,求其摩尔吸光系数ε的值。
3.测定血清中的磷酸盐含量时,取血清试样5.00mL于100mL量瓶中,加显色剂显色后,稀释至刻度。吸取该试液25.00mL,测得吸光度为0.582;另取该试液25.00mL,加1.00mL 0.050 0 mg磷酸盐,测得吸光度为0.693。计算每毫升血清中含磷酸盐的质量。
4.用磺基水杨酸作为显色剂,测定矿样中铁的含量,加入标准铁溶液及有关试剂后,在50mL容量瓶中稀释至刻度,得到下表所列数据:
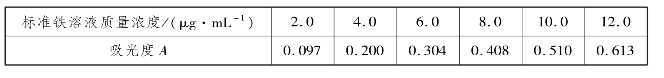
称取矿样0.386 6g,分解后定容于100mL容量瓶,吸取5.0mL试液,置于50mL容量瓶中,在与标样同条件显色后,测得溶液吸光度为0.250。根据以上数据,绘制吸光光度工作曲线,并求出矿样中铁的质量分数。




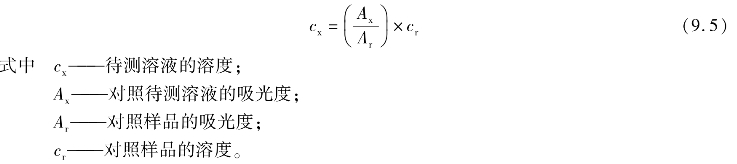
 ,其lg K=21.3,508 nm处ε=1.1×10
,其lg K=21.3,508 nm处ε=1.1×10

