-
1.1高职高专生物技术类专业系列规划教材※编委会※
-
1.2高职高专生物技术类专业系列规划教材※参加编写单位※
-
1.3总 序
-
1.4前 言
-
1.5目录
-
1.6绪 论
-
1.6.10.1 化学学科的发展
-
1.6.20.2 化学与人类的关系
-
1.6.30.3 无机及分析化学的任务和学习方法
-
1.6.4本意小结
-
1.6.5目标检测
-
1.7第1章 物质结构
-
1.7.11.1 原子结构和元素周期系
-
1.7.21.2 分子结构
-
1.7.3本意小结
-
1.7.4目标检测
-
1.8第2章 溶 液
-
1.8.12.1 溶液的基本知识
-
1.8.22.2 溶液的浓度
-
1.8.32.3 电解质溶液
-
1.8.42.4 水的电离和溶液的酸碱性
-
1.8.52.5 稀溶液的依数性
-
1.8.62.6 胶体溶液
-
1.8.7本意小结
-
1.8.8目标检测
-
1.9第3章 化学反应
-
1.9.13.1 化学反应的类型
-
1.9.23.2 化学反应速率
-
1.9.3本意小结
-
1.9.4目标检测
-
1.10第4章 化学平衡
-
1.10.14.1 化学平衡
-
1.10.24.2 酸碱电离平衡
-
1.10.34.3 盐类的水解
-
1.10.44.4 沉淀溶解平衡
-
1.10.54.5 配位离解平衡
-
1.10.64.6 酸碱质子理论
-
1.10.7本意小结
-
1.10.8目标检测
-
1.11第5章 氧化还原与电化学
-
1.11.15.1 氧化还原反应
-
1.11.25.2 原电池和电极电势
-
1.11.35.3 电极电势的应用
-
1.11.4本意小结
-
1.11.5目标检测
-
1.12第6章 元素与化合物
-
1.12.16.1 非金属元素及其化合物
-
1.12.26.2 金属元素及其化合物
-
1.12.3本意小结
-
1.12.4目标检测
-
1.13第7章 定量分析的概述
-
1.13.17.1 定量分析的任务和作用
-
1.13.27.2 定量分析误差
-
1.13.37.3 有效数字及运算准则
-
1.13.4本意小结
-
1.13.5目标检测
-
1.14第8章 滴定分析法
-
1.14.18.1 滴定分析法概述
-
1.14.28.2 酸碱滴定法
-
1.14.38.3 氧化还原滴定法
-
1.14.48.4 配位滴定法
-
1.14.58.5 沉淀滴定法
-
1.14.6本意小结
-
1.14.7目标检测
-
1.15第9章 吸光光度分析法
-
1.15.19.1 吸光光度法的基本原理
-
1.15.29.2 显色反应和显色剂
-
1.15.39.3 吸光光度分析的方法
-
1.15.49.4 吸光光度法的运用
-
1.15.5本意小结
-
1.15.6目标检测
-
1.16实习实训
-
1.16.1实习实训1 氯化钠的提纯
-
1.16.2实习实训2 化学反应速率和化学平衡
-
1.16.3实习实训3 酸度计的使用及溶液pH的测定
-
1.16.4实习实训4 醋酸电离常数的测定
-
1.16.5实习实训5 电子分析天平使用与称量技术
-
1.16.6实习实训6 滴定分析基本操作练习
-
1.16.7实习实训7 盐酸溶液的配制与标定
-
1.16.8实习实训8 氢氧化钠溶液的配制与标定
-
1.16.9实习实训9 食醋总酸量的测定
-
1.16.10实习实训10 铵盐含氮量测定(甲醛法)
-
1.16.11实习实训11 果蔬中总酸度的测定
-
1.16.12实习实训12 重铬酸钾法测铁
-
1.16.13实习实训13 污水中化学耗氧量的测定
-
1.16.14实习实训14 维生素C含量的测定
-
1.16.15实习实训15 EDTA标准溶液的配制和标定
-
1.16.16实习实训16 水中总硬度及、含量的测定
-
1.16.17实习实训17 牛乳中钙含量的测定
-
1.16.18实习实训18 生理食盐水中NaCl含量的测定
-
1.16.19实习实训19 溴化钾含量的测定
-
1.16.20实习实训20 吸光光度法测定水和废水中总磷
-
1.17【习题及实训】参考答案
-
1.18附 录
-
1.18.1附录1 弱电解质的解离常数
-
1.18.2附录2 常见配离子的稳定常数
-
1.18.3附录3 标准电极电势(298.16 K)
-
1.18.4附录4 难溶电解质的溶度积(18~25℃)
-
1.18.5附录5 元素周期表
-
1.19参考文献
1
无机及分析化学
1.11.5
目标检测
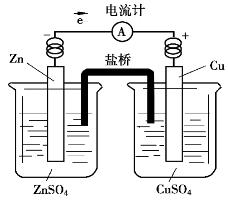
 Sn
Sn Fe
Fe Sn
Sn M
M 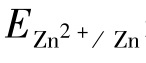 表示,铜的电极电势以
表示,铜的电极电势以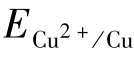 表示。
表示。
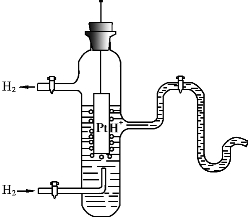
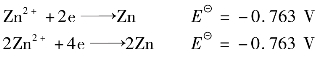
 b还原型
b还原型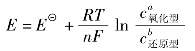
 还原态(aq)
还原态(aq)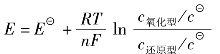
 还原态(aq)
还原态(aq)
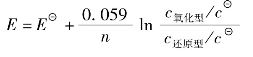
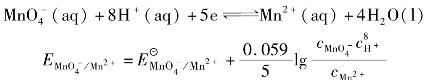
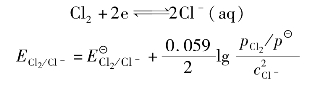
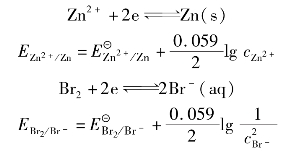
 Fe
Fe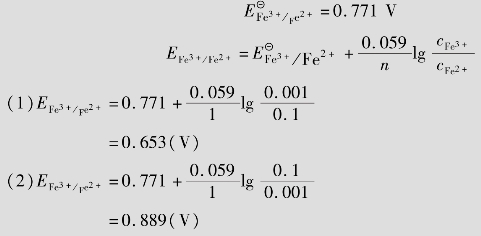
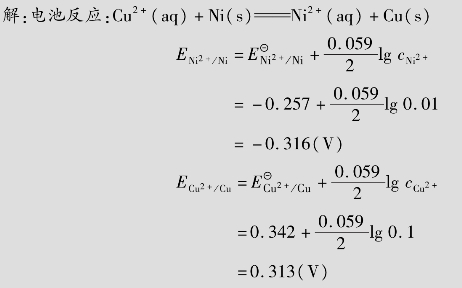
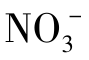 的氧化能力随酸度增大而增强;再如Cr
的氧化能力随酸度增大而增强;再如Cr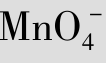 +8H
+8H Mn
Mn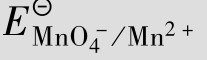 =1.51 V,求当c
=1.51 V,求当c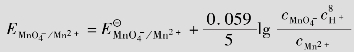
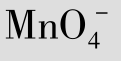 的氧化能力随H
的氧化能力随H Ag(s),
Ag(s),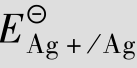 =0.799 V,若在溶液中加入NaCl溶液,达到平衡时,若c
=0.799 V,若在溶液中加入NaCl溶液,达到平衡时,若c
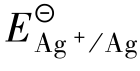 相比,E
相比,E Zn
Zn
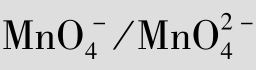 ,Ag
,Ag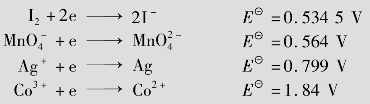

 Zn
Zn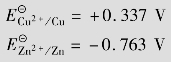
 2Fe
2Fe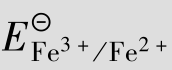 =+0.77 V,
=+0.77 V,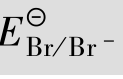 =+1.07 V
=+1.07 V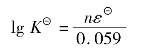
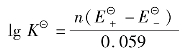
 2Fe
2Fe 2Fe
2Fe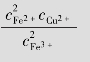
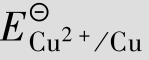 =0.337 V
=0.337 V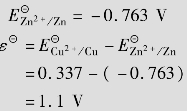
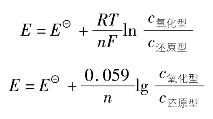
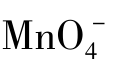 中的Mn是________,Na
中的Mn是________,Na 2Ni(OH)
2Ni(OH) Cu
Cu MnCl
MnCl S+H
S+H CuSO
CuSO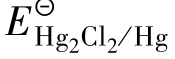 =0.24 V,测得此电池的电动势为0.52 V。写出电极反应和电池反应。
=0.24 V,测得此电池的电动势为0.52 V。写出电极反应和电池反应。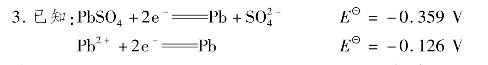
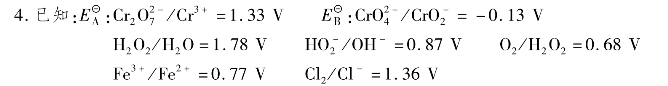
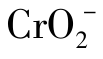 在碱性介质中氧化,选择哪种氧化剂为好?写出反应方程式。
在碱性介质中氧化,选择哪种氧化剂为好?写出反应方程式。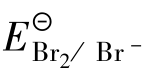 =1.065 V,
=1.065 V,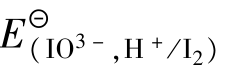 =1.20 V
=1.20 V 2AgNO
2AgNO 2Cr
2Cr