2CO(g)
则平衡常数表示为:
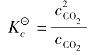
④稀溶液中的反应,如果有水参加,水的浓度也视为常数1,但是反应中有气相水或非水溶液中有水参加(或有水生成)的反应,水的浓度不可视为常数。例如:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
则平衡常数表示为:
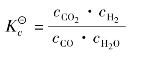
化学反应在一定条件下达到平衡时,通过实验测定各物质的平衡浓度或平衡分压,即可计算出该反应的平衡常数。工业生产中正是根据这种平衡关系来计算有关物质的平衡浓度以及反应物的转化率。
例题4.1 在下列平衡体系中:CO(g)+H2O(g) CO2(g)+H2(g),反应容器为1 L,1 103 K时
CO2(g)+H2(g),反应容器为1 L,1 103 K时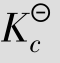 =1.0,若CO的起始浓度为2mol/L,H2O的起始浓度为3mol/L,达到平衡时,各物种的浓度为多少?CO的转化率(指平衡时已转化了的某反应物的量与转化前该反应物的量之比)为多少?
=1.0,若CO的起始浓度为2mol/L,H2O的起始浓度为3mol/L,达到平衡时,各物种的浓度为多少?CO的转化率(指平衡时已转化了的某反应物的量与转化前该反应物的量之比)为多少?
解:设此体系达到平衡时,有xmol/L的CO转化为CO2,则:
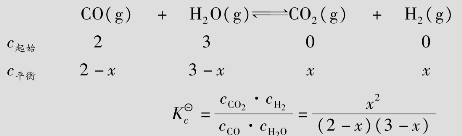
x=1.2mol/L
cCO=2-x=0.8mol/L
cH2O=3-x=1.8mol/L
cH2=cCO=x=1.2mol/L
CO转化率=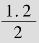 ×100%=60%
×100%=60%
答:达到平衡时,CO、H2O、H2、CO2的浓度是:cCO=0.8mol/L,cH2O=1.8mol/L,cH2=cCO=1.2mol/L,CO的转化率为60%。
例题4.2 在440℃,H2(g)+I2(g) 2HI(g)的标准平衡常数为49.5,已知0.200mol的H2和0.200mol的I2置于10.0 L密闭容器中,待反应达成平衡后,各物质的平衡浓度各为多少?
2HI(g)的标准平衡常数为49.5,已知0.200mol的H2和0.200mol的I2置于10.0 L密闭容器中,待反应达成平衡后,各物质的平衡浓度各为多少?
解:设此体系达到平衡时,有xmol/L的H2转化为HI,则:
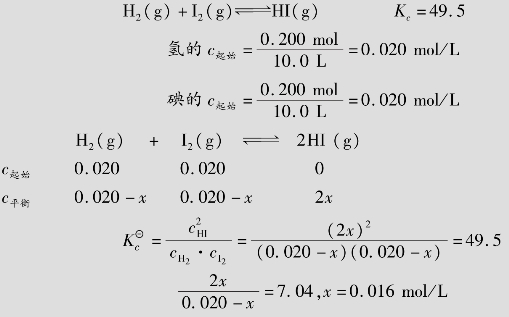
则平衡浓度为:
cH2=0.020-0.016=0.004mol/L
cI2=0.020-0.016=0.004mol/L
cHI=2×0.015 6=0.031 2mol/L
答:当达成平衡时cH2=cI2=0.004mol/L,cHI=0.031 2mol/L。
例题4.3 在催化剂存在下,将2.00mol SO2和1.00mol O2的混合物在2 L的容器中加热至1 000 K,当体系处于平衡时,SO2的转化率为46%,求该温度下的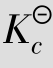 。
。
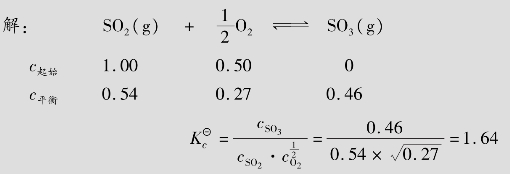
答:在1 000 K时,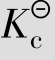 等于1.64。
等于1.64。
4.1.3 化学平衡的移动
化学平衡只是可逆反应在一定条件下一种相对的、暂时的稳定状态。如果改变浓度、压强、温度等反应条件,正、逆反应速率不再相等,原平衡反应混合物里各组分的浓度也随着改变,经过一段时间后,从而达到新的平衡状态。我们把可逆反应中旧化学平衡的破坏、新化学平衡的建立过程称为化学平衡的移动。
研究化学平衡的目的就是要利用外界条件的改变,使旧的化学平衡破坏,建立新的较理想的化学平衡。例如:使转化率不高的化学平衡破坏,而建立新的转化率高的化学平衡,从而提高产量。下面,着重讨论浓度、压强和温度对化学平衡的影响。
1)浓度对化学平衡的影响
当化学反应达到平衡时,只要其他条件不变,改变任何一种反应物或生成物的浓度,都会引起化学平衡的移动。例如,氯化铁与硫氰化钾起反应,生成血红色的硫氰化铁和氯化钾,这个反应的化学平衡可表示为:
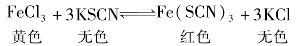
在平衡混合物里,当加入FeCl3或KSCN溶液后,溶液的颜色会变深。这说明,增大任何一种反应物浓度都促使化学平衡向正反应的方向移动,生成更多的硫氰化铁。通过实验还可以证明,当达到平衡时,减小任何一种反成物的浓度,平衡也会向逆反应的方向移动。
浓度对化学平衡的影响可概括为:在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使平衡向着正反应的方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向着逆反应的方向移动。在化工生产中,往往采用增大容易取得的或成本较低的反应物浓度的方法,使成本较高的原料得到充分利用,从而提高某反应物的转化率。例如:在硫酸生产工业中,常用过量的空气使二氧化硫充分氧化生成更多的三氧化硫。
2)压力对化学平衡的影响
固态或液态物质的体积,受压强的影响很小,可以忽略不计。因此,平衡混合物都是固体或液体时,改变压力,化学平衡不发生移动。而对于有气体参加的可逆反应,当处于化学平衡状态时,改变压力就可能使化学平衡发生移动。现以合成氨的反应为例,说明压力对平衡的影响。氨合成的平衡反应方程式为:

在该反应式中,反应物的气体总分子数为4mol,产物的气体总分子数为2mol,反应前后气体分子总数是有变化的。
在一定温度下,当上述反应达到平衡时,各组分的平衡分压为pNH3、pH2、pN2,则有:
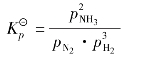
若平衡体系的总压力增加到原来的2倍,则各组分的分压分别为:2pH2、2pN2、2pNH3,于是:
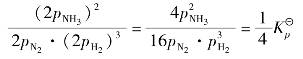
上式表明,体系已经不再处于平衡状态,反应必须朝着生成氨(即分子数减少)的正方向进行。在反应进行的过程中,随着pNH3的不断增大,pH2和pN2下降,最后建立新的平衡。
若将平衡体系的总压力降低到原来的1/2,则各组分的分压也分别减为原来的1/2,即1/2pH2、1/2pN2、1/2pNH3,则:
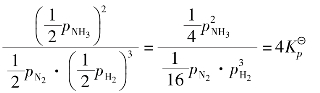
上式表明,体系已经不再处于平衡状态,反应必须朝着生成氨分解(即分子数增大)的逆反应方向进行。在反应进行的过程中,随着NH3的不断分解,pNH3不断下降,pH2和pN2不断升高,最后又建立新的平衡。
由此可见,对于一个反应前后气体分子总数有变化的反应来说,在其他条件不变的情况下,增大压强,化学平衡向着气体体积缩小的方向移动;减小压强,化学平衡向着气体体积增大的方向移动。
在有些可逆反应里,反应前后气体分子总数没有变化。例如:
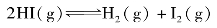
在该反应式中,反应物的气体总分子数为2mol,产物的气体总分子数也为2mol,反应前后气体分子总数没有变化。在一定温度下,改变体系的压力对平衡是否有影响呢?
假设上述反应在恒温下达到平衡时,各组分的分压分别为:pHI、pH2、pI2则:
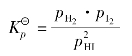
当体系的总压力增加到原来的两倍时,各组分的分压分别为:2pHI、2pH2、2pI2,此时,压力平衡常数表达式中的分子和分母总是同倍数地增大,所以增加体系的压力,并不影响平衡。同理,当体系的总压力减小到原来的1/2时,压力平衡常数表达式中的分子和分母总是同倍数地减小,也不影响平衡。
由此可见,在恒温下有气体参加的可逆反应中,如果气态反应物总分子数和气态生成物的总分子数相等,增加或减小压力对平衡没有影响。
3)温度对化学平衡的影响
温度对化学平衡的影响与前两种情况有本质的区别。改变浓度或压力只能使平衡点改变,而温度的变化却会导致平衡常数值的改变,从而影响平衡移动。例如合成氨反应是个放热反应,该反应的平衡常数随温度变化而变化,见表4.1。
表4.1 合成氨反应的平衡常数随温度的变化情况

通过表4.1可知,对于一个可逆反应来说,如果是放热反应,升高温度,平衡常数减小,平衡向逆反应方向进行。如果是吸热反应,升高温度,平衡常数增大,平衡向正反应方向进行。
综上所述,在一个可逆反应的平衡体系中,如果改变影响平衡的一个条件(如浓度、温度、压力等),平衡就向能够减弱这种改变的方向移动,这可概括为平衡移动原理也叫勒夏特列原理。该原理适用于已达到平衡的体系,不适用于非平衡体系。平衡移动原理对所有的动态平衡都适用,如后面将要学习的电离平衡也适用。但是,这个原理也有局限性,如,虽然能用它来判断平衡移动的方向,但不能用它来判断建立新平衡所需要的时间,以及在平衡建立过程中各物质间的数量关系等。这需要进一步学习其他理论,在此不再介绍。
由于催化剂能够同等程度地增加正反应速率和逆反应速率,因此它对化学平衡的移动没有影响。也就是说,催化剂不能改变达到化学平衡状态的反应混合物的组成,但是使用催化剂,能够改变反应达到平衡所需的时间。
在生物体内存在相当多的平衡。例如,医院里临床输氧抢救病人的过程中,就利用了平衡移动原理。人体血液中的血红蛋白(HHb)具有输氧功能,它能和肺部的氧气结合生成氧合血红蛋白(HHbO2)。氧合血红蛋白又可随血液流经全身组织,将氧气放出。输氧抢救就是增强氧气的浓度,有利于正反应进行,使血液中含较多的HHbO2,可在全身组织中较多地放出O2,供病人所需。
4.2 酸碱电离平衡
弱电解质溶于水后,在水分子的作用下,弱电解质分子电离出离子,而离子又可以重新结合成分子。因此,弱电解质的电离过程是可逆的。这个可逆的电离过程也与可逆的化学反应一样,经过一段时间后相反的两种趋向最终也将达到平衡。在一定条件(如温度、浓度)下,当弱电解质分子电离成离子的速率和离子重新结合生成分子的速率相等时,电离过程就达到了平衡状态,这个平衡状态称为电离平衡。
电离平衡属于化学平衡中的一种。在日常生活、工农业生产和科学研究中,我们经常接触到有关电离平衡的知识。例如:水溶液中发生的许多离子反应,酸的强弱的判断,盐溶液的酸碱性,人体体液的pH与健康等,这些都与电离平衡的知识有密切关系。
4.2.1 弱电解质溶液的电离
1)一元弱酸、一元弱碱的电离平衡
乙酸是一种典型的一元弱酸,其水溶液中存在下列平衡:
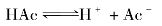
根据化学平衡原理,平衡时未电离的乙酸分子浓度和氢离子、乙酸根离子浓度间存在如下关系:
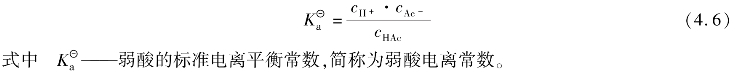
一元弱碱的电离也有类似的情况。如氨水中存在着下列平衡:
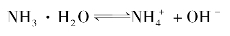
其电离常数表达式为:
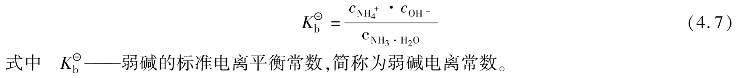
电离常数用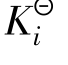 表示,它包括弱酸电离常数
表示,它包括弱酸电离常数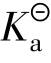 、弱碱电离常数
、弱碱电离常数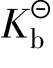 ,与一般的平衡常数一样,在一定温度下,对于给定的弱电解质稀溶液而言,它是一个常数。也就是说,
,与一般的平衡常数一样,在一定温度下,对于给定的弱电解质稀溶液而言,它是一个常数。也就是说,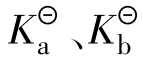 与温度有关而与浓度无关。电离常数能表示弱酸、弱碱电离的趋势,其值越大表示电离的趋势越大。
与温度有关而与浓度无关。电离常数能表示弱酸、弱碱电离的趋势,其值越大表示电离的趋势越大。
2)离解度和电离常数的关系
为了表示平衡时弱电解质的电离程度,人们引入了离解度的概念。离解度是指电离平衡时,已电离的弱电解质分子数和电离前弱电解质的分子总数之比。离解度通常用α表示。若以c0表示弱酸或弱碱的原始浓度,c表示已离解的弱酸或弱碱的浓度,则

不同的弱电解质在相同浓度时,它们的离解度不同。电解质越弱,离解度越小,所以离解度的大小也可反映弱电解质的相对强弱。离解度大小除与电解质本性有关外,还与溶液的浓度等因素有关。同一弱电解质溶液,浓度越小,电离度越大。弱电解质的电离度随溶液浓度的降低而增大。
α和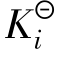 都能表示弱酸(或弱碱)离解能力的大小。
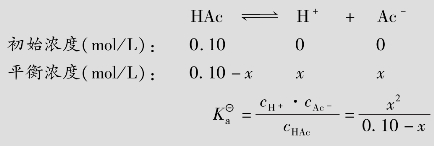
都能表示弱酸(或弱碱)离解能力的大小。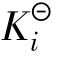 是平衡常数的一种形式,只与温度有关,不随浓度而变化;离解度是转化率的一种形式,其大小除与弱酸(或弱碱)的本性有关外,还与溶液的浓度、温度等因素有关。离解度和电离常数之间是相互联系的,下面以弱酸HAc的电离平衡为例进行说明:
是平衡常数的一种形式,只与温度有关,不随浓度而变化;离解度是转化率的一种形式,其大小除与弱酸(或弱碱)的本性有关外,还与溶液的浓度、温度等因素有关。离解度和电离常数之间是相互联系的,下面以弱酸HAc的电离平衡为例进行说明:
设HAc浓度为c,离解度为α则:
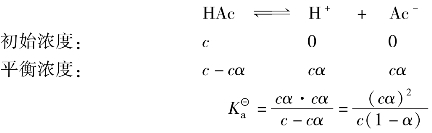
当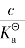 ≥500时,α<10-2,所以1-α≈1,
≥500时,α<10-2,所以1-α≈1,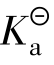 ≈cα2。
≈cα2。
故得离解度与弱酸电离常数关系式为:

同理可得,离解度与弱碱电离常数的关系式为:

以上关系式表明:同一弱电解质的离解度近似地与其浓度平方根成反比,即溶液越稀,离解度越大;同一浓度的不同弱电解质的离解度与其离解常数的平方成正比。
3)一元弱酸、一元弱碱溶液的pH值计算
在弱酸溶液中,同时存在着弱酸和水的两种离解平衡。如在HAc水溶液中有下列两个电解平衡:
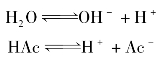
二者之间相互联系,相互影响,它们都能电离生成H+。由于HAc酸性比H2O强,在HAc浓度并不很稀时,(如cHAc>1.0×10-5mol/L),H+主要是由HAc离解而产生的,水离解产生的cH+小于10-7mol/L,HAc离解产生的cH+≫10-7mol/L。计算HAc溶液中cH+时,可以不考虑水的电解平衡。
例题4.4 计算25℃时,0.10mol/L HAc溶液中的HAc、H+、Ac-的浓度及溶液pH值,并计算HAc的离解度α。(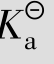 =1.75×10-5)
=1.75×10-5)
解:设已离解的HAc浓度为xmol/L
一般认为:当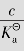 ≥500时,c≫x,0.10-x≈0.10
≥500时,c≫x,0.10-x≈0.10
对于一元弱酸,其溶液中H+浓度近似计算公式为:

对于一元弱碱,则有:

4)多元弱酸、多元弱碱溶液的pH值计算
多元酸在水中是分步电离的,前面讨论的一元弱酸的电离平衡原理,也适用于多元弱酸的电离平衡。现以二元弱酸H2S电离为例来讨论多元弱酸的电离平衡。H2S的电离平衡是分两步进行的,并有各自相应的电离常数。
第1步电离:H2S  H++HS-
H++HS-

第2步电离:HS- H++S2-
H++S2-

Ka1、Ka2分别为二元弱酸的一级和二级电离常数。25℃时,Ka1=1.1×10-7,Ka2=1.3× 10-13。可以看出,Ka1≫Ka2,第2步电离比第1步电离弱得多。一方面是因为带有两个电荷的S2-对H+的吸引比带一个电荷的HS-对H+的吸引要强得多;另一方面是因为第1步电离出的H+对第2步电离产生抑制作用。因此,多元弱酸溶液中的H+主要来源于第1步电离。当近似计算时,忽略第2步电离也不会引起太大误差。
例题4.5 在25℃时,计算0.1mol/L的H2S溶液中H+、HS-、S2-离子浓度和溶液的pH。(Ka1=1.1×10-7;Ka2=1.3×10-13)
解:有关离解平衡和离解常数表达式已如上所示。
①cH+≈cHS-≈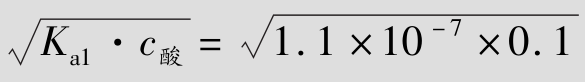 =1.05×10-4mol/L
=1.05×10-4mol/L
②pH=-lg cH+=-lg(1.05×10-4)=3.98
③第2步电离:
HS- H++S2-
H++S2-
电离平衡常数表达式为:
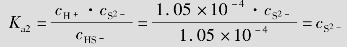
故cS2-=Ka2=1.3×10-13mol/L。
4.2.2 同离子效应
乙酸溶液中存在下列电离平衡:
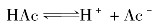
若向乙酸溶液中加入少许固体乙酸钠(NaAc),由于Ac-离子浓度的增大,平衡向生成HAc分子的一方移动,结果导致乙酸电离度降低。
又如氨水中存在下列电离平衡:
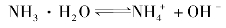
若向氨水中加入少许固体NH4Cl,由于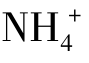 离子浓度的增大平衡向生成NH3·H2O分子的方向移动,结果降低了氨的电离度。
离子浓度的增大平衡向生成NH3·H2O分子的方向移动,结果降低了氨的电离度。
由此可知:在弱电解质溶液中加入与弱电解质具有相同离子的强电解质时,将使弱电解质的离解度降低,这种现象称为同离子效应。
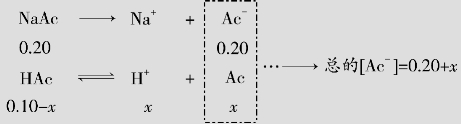
例题4.6 在0.10mol/L的醋酸溶液中,加入固体醋酸钠(设溶液体积不变),使其浓度为0.20mol/L。求此溶液中cH+和醋酸的离解度α。
解:设HAc离解出的cH+为xmol/L
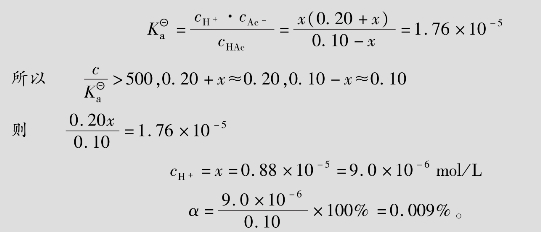
答:此溶液中cH+为9.0×10-6mol/L,α为0.009%。
4.2.3 缓冲溶液
1)缓冲溶液的概念及pH值的计算
坐汽车,在汽车突然加速、减速时,会产生惯性,为防止惯性,要系安全带,安全带起的是缓冲作用。一般的水溶液会呈现不同的酸碱性,即酸性、碱性或两性,若在水溶液中加酸、碱或稀释会引起原有pH值的变化。而有一种溶液能缓冲pH值的改变,正如安全带能缓冲惯性,我们把这种能够抵抗外加少量酸、碱或适量稀释,本身的pH值不发生明显改变的溶液叫缓冲溶液。缓冲溶液所具有的这种性质叫缓冲性,缓冲溶液保持pH不变的作用称为缓冲作用。缓冲溶液在生命活动中具有重要意义,动植物的生长发育都需要保持一定的pH值。如:大多数植物在pH>9和pH<3.5的土壤中就不能生长,人类血液的pH值必须为7.35~7.45,稍有偏离就会生病甚至死亡。
纯水的pH为7,只要在纯水中加入很少的酸或碱,pH值便会发生很大的变化,纯水没有抵抗pH值变化的能力。如向1 L纯水中加1mL 1mol/L的HCl,此溶液的pH值立即变为3。向1 L纯水中加入40 mg的NaOH,溶液的pH值立即变为11。如果以缓冲溶液替代纯水,则结果完全不同。缓冲溶液一般由弱酸和弱酸盐或弱碱和弱碱盐以及多元酸的两种盐组成,如HAc⁃NaAc、NH4Cl⁃NH3·H2O、Na2HPO4⁃NaH2PO4等。
以HAc⁃NaAc缓冲对为例,缓冲溶液的pH值计算公式推导如下:
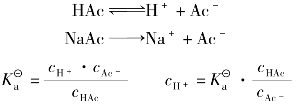
根据近似处理cHAc=c弱酸
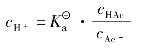
等式左右取负对数(-lg),经整理得:
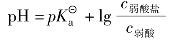
在配置缓冲溶液时,倘若c弱酸盐=c弱酸,则c弱酸盐与c弱酸可用V盐与V酸代替,于是上面的公式可以变换为:

正因为盐与酸存在于同一缓冲溶液中,因此c盐和c酸的比值也就是它们的摩尔比值。
同理:以NH3—NH4Cl缓冲对为例,

例题4.7 血浆中测得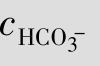 =2.5×10-2mol/L,
=2.5×10-2mol/L,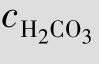 =2.5×10-3mol/L,求血浆的pH值。(已知H2CO3的Ka1=4.3×10-7)
=2.5×10-3mol/L,求血浆的pH值。(已知H2CO3的Ka1=4.3×10-7)
解:pH=pKa1+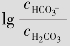 =6.37+lg11.11=6.37+1.05=7.42
=6.37+lg11.11=6.37+1.05=7.42
答:血浆的pH值为7.42。
例题4.8 普通细胞中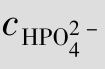 =2.4×10-3mol/L,
=2.4×10-3mol/L,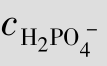 =1.5×10-3mol/L,求细胞液的pH值。
=1.5×10-3mol/L,求细胞液的pH值。
解:H2PO4的Ka1=6.23×10-8,p Ka1=7.21,因此
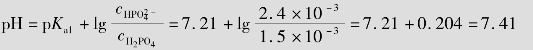
答:细胞液的pH值为7.41。
2)缓冲溶液的缓冲原理
缓冲溶液之所以具有缓冲性,是因为这种溶液中含有足够量的能够对抗外加酸的成分即抗酸成分,又含有足够量的能够对抗外加碱的成分即抗碱成分。通常把抗酸成分和抗碱成分称为缓冲对。根据缓冲组分的不同,缓冲溶液主要有以下3种类型:弱酸及其弱酸盐(如HAc⁃NaAc);弱碱及其弱碱盐(如NH3·H2O⁃NH4Cl);多元酸的酸式盐及其次级盐(如Na2CO3⁃NaHCO3、NaH2PO4⁃NaHPO4)。
现以相同浓度的HAc⁃NaAc缓冲溶液为例来说明缓冲溶液的缓冲原理。
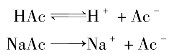
NaAc是强电解质,在溶液中完全电离,溶液中存在大量的Ac-,由于同离子效应,降低了HAc的电离度,溶液中还存在大量的HAc分子。
当向该溶液中加入少量强酸时,H+和溶液中大量Ac-结合成HAc,使平衡向左移动,溶液中H+浓度几乎没有升高,pH值基本保持不变。Ac-是该缓冲溶液的抗酸成分。
当向该溶液中加入少量强碱时,OH-和溶液中的H+结合成H2O,使平衡向右移动,HAc进一步电离,H+浓度几乎没有降低,pH值基本保持不变。HAc是该缓冲溶液的抗碱成分。
当加水稍加稀释时,由于共轭酸碱的浓度之比没有变化,缓冲溶液的pH值基本保持不变。
应当指出的是,缓冲溶液的缓冲能力是有一定限度的。如果向其中加入大量强酸或强碱,当溶液中的抗酸成分或抗碱成分消耗将尽时,它就没有缓冲能力了。
3)缓冲溶液的选择和配制
在实际工作中,经常会用到一定pH值的缓冲溶液,所以掌握缓冲溶液的配制方法是必须的。缓冲溶液的选择和配制可按下列步骤进行:
①选择合适的缓冲对。即所选缓冲对中弱酸的p Ka(或弱碱的p Kb)与所要配制的缓冲溶液的pH值(或pOH值)尽量接近。如配制pH=5的缓冲溶液,可选择HAc⁃NaAc缓冲对,因为p KHAc=4.75,接近所配缓冲溶液的pH值;欲配制pH=9的缓冲溶液,可选择NH3·H2O⁃NH4Cl缓冲对,因为p KNH3·H2O=4.75,pH=14-4.75=9.25,接近所配缓冲溶液的pH值。
②根据pH=p Ka+lg c盐/c酸(或者pOH=p Kb+lg c盐/c酸)计算出所需酸(或碱)和盐的浓度比值,以配得所需的缓冲溶液。
例题4.9 如何配制1 000mL pH=5.00的缓冲溶液?
解:缓冲溶液的pH=5.00,而HAc的p KHAC=4.75,彼此接近,故可选择HAc—NaAc缓冲对。为计算的方便,取原始浓度相同的HAC和NaAc。
若使用缓冲对的原始浓度相同,则缓冲对的浓度比等于体积比,根据公式
pH=p Ka+lg c盐/c酸
5.00=4.75+lg VNaAc/VHAC
lg VNaAc/VHAC=0.25
VNaAc/VHAC=1.8
设用HACVmL,则
1 000-V=1.8V
所以V=360mL,即VHAC=360mL,则VNaAc=1 000-360=640mL。
答:用物质的量浓度相同的640mL NaAc溶液和360mL HAc溶液混合均匀即可配成1 000mL pH=5.00的缓冲溶液。
例题4.10 如何配制1 000mL pH=9.00的缓冲溶液?
解:缓冲溶液的pH=9.00,而NH3·H2O的p Kb=4.75,pH=14-p Kb=14-4.75=9.25彼此接近,所以可选择NH3·H2O⁃NH4Cl缓冲对。为计算的方便,取原始浓度相同的NH3·H2O和NH4Cl。
若使用缓冲对的原始浓度相同,则缓冲对的浓度比等于体积比,根据公式
pOH=p Kb+lg c盐/c酸
pOH=14-pH=14-9=5
5=4.75+lg V盐/V酸
lg VNH4Cl/VNH3·H2O=0.25
VNH4Cl/VNH3·H2O=1.8
设用NH3·H2O VmL,则
1 000-V=1.8V
所以V=360mL,即VNH3·H2O=360mL,则VNH4Cl=1 000-360=640mL。
答:用物质的量浓度相同的640mL NH4Cl溶液和360mL NH3·H2O溶液混合均匀即可配成1 000mL pH=9.00的缓冲溶液。
以上是理论计算值,实际所配的缓冲溶液的pH值还需要用pH计来测定。
例题4.11 用0.025mol/L的H3PO4和0.10mol/L的NaOH,配制pH 7.40的缓冲溶液100mL,求所需H3PO4和NaOH的体积比。
解:缓冲系为NaH2PO4⁃Na2HPO4。设需H3PO4体积V1mL,NaOH体积V2mL
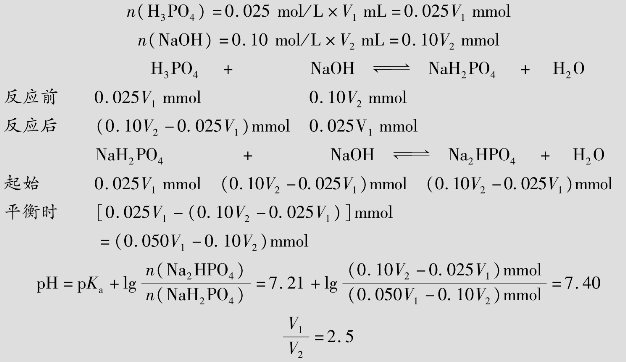
答:用0.025mol/L的H3PO4和0.10mol/L的NaOH,配制pH 7.40的缓冲溶液100mL,所需H3PO4和NaOH的体积比为2.5。
4)缓冲液在生物科学中的作用
缓冲溶液在工业、农业、生物学、医学、化学等方面都有很重要的用途。生物体是以水为基础的系统,细胞和各种生物组织都必须具有保持一定pH的能力,其重要原因之一是各种酶都要在一定的pH条件下才具有催化生化反应的活性。酶是蛋白质大分子,其中常含有可给出质子的酸性集团和可给出质子的碱性集团,例如,在细胞质和细胞液中,含有磷酸缓冲对,控制其pH保持在6.8左右,尿液也主要因磷酸缓冲对的作用而保持在6.3左右,血浆的酸度主要由碳酸缓冲对控制,该缓冲对能中和代谢过程中产生的酸或碱,维持血浆的pH在7.4左右,pH升高或降低较大时都会引起“碱中毒”或“酸中毒”症。当pH改变达到0.4时,将会有生命危险。
适合于部分作物生长的土壤,其pH值在5~8的范围内,正是由于土壤中存在的多种弱酸以及相应的盐如H2CO3⁃NaH2CO3、NaH2PO4⁃NaHPO4、腐殖酸⁃腐殖酸盐等缓冲体系,维持了土壤的酸碱性变化不大,从而保证了植物的正常生长。
4.3 盐类的水解
盐是酸碱中和反应的产物,我们知道酸的水溶液显酸性,碱的水溶液显碱性,而盐的水溶液酸碱性又如何呢?不同类型的盐其水溶液会呈现出不同的酸碱性,有的显酸性,有的显碱性,有的显中性,其原因是盐溶于水后电离出来的阴离子或阳离子与水电离出的H+或OH-作用生成了弱酸或弱碱,使水的电离平衡发生移动,导致溶液中H+或OH-浓度不相等,从而呈现出不同的酸碱性。我们把溶液中盐的离子跟水所电离出来的H+或OH-生成弱电解质的过程称为盐类的水解。
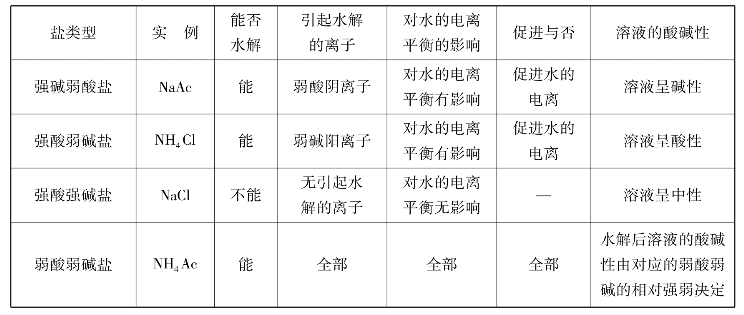
4.3.1 盐类水解的类型
1)强碱弱酸盐的水解
以NaAc水解为例,NaAc和H2O发生下列电离:
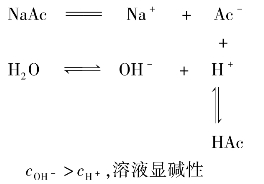
总反应:NaAc+H2O  HAc+NaOH
HAc+NaOH
NaAc水解的实质是:Ac-+H2O 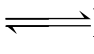 HAc+OH-
HAc+OH-
结论:强碱弱酸盐水解显碱性。
盐类水解到一定时间后,也会达到一个平衡状态,即水解平衡状态。水解的程度可以用水解平衡常数Kh来表示
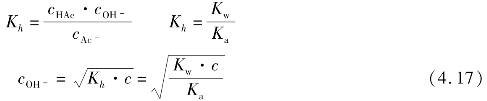
由以上公式可以看出,形成盐的酸越弱,Ka越小,Kh越大,碱性越强;盐的浓度越大,其溶液的碱性越强。所以,水解平衡常数可以衡量盐的水解程度的大小。
盐类的水解程度,除了可用Kh表示外,还可以用水解度(h)来表示:
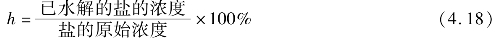
2)强酸弱碱盐的水解
以NH4Cl水解为例,NH4Cl和H2O发生下列电离:
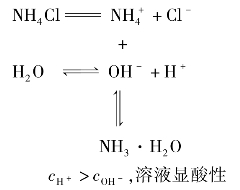
总反应:NH4Cl+H2O 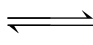 NH3·H2O+HCl
NH3·H2O+HCl
NH4Cl水解的实质是: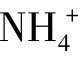 +H2O
+H2O 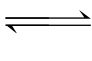 NH3·H2O+H+
NH3·H2O+H+
结论:强酸弱碱盐水解显酸性。
与弱酸强碱盐水解情况类似,可得:
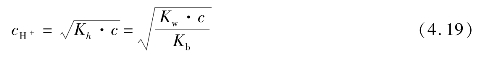
上式表明,形成盐的碱越弱,Kb越小,Kh越大,酸性越强,盐的浓度越大,其溶液的酸性越强。
3)弱酸弱碱盐的水解
以NH4Ac水解为例,NH4Ac和H2O发生下列电离:
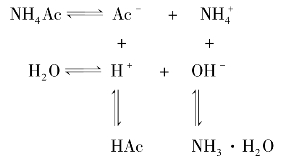
总反应:NH4Ac+H2O  NH3·H2O+HAc
NH3·H2O+HAc
NH4Ac水解的实质是: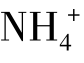 +Ac-+H2O
+Ac-+H2O 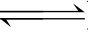 NH3·H2O+HAc
NH3·H2O+HAc
溶液的酸碱性取决于水解生成的两种弱电解质的相对强弱,也就是取决于生成的弱酸和弱碱电离常数的大小。由于KHAC≈KNH3·H2O,所以NH4Ac溶液水解呈中性。
如:NH4F溶液水解,对应的弱酸是HF、弱碱是NH3·H2O,KHF>KNH3·H2O,所以NH4F溶液水解呈酸性。
4)多元弱酸盐的水解
多元弱酸盐的水解与多元弱酸的电离过程相似,也是分步进行的。
以二元弱酸盐Na2CO3水解为例,
第1步水解 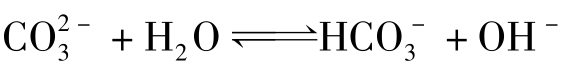

第2步水解 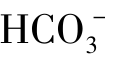 +H2O
+H2O  H2CO3+OH-
H2CO3+OH-

其中Ka1、Ka2分别为二元弱酸H2CO3的分步电离常数。由于Ka2≪Ka1,所以Kh1≫Kh2。
所以多元弱酸盐的水解也是以第1步水解为主。盐类的水解类型见表4.2。
表4.2 盐类的水解类型
4.3.2 盐类水解的特点
①一般来说盐类水解的程度不大,是中和反应的逆反应,由于中和反应趋于完全,其盐类的水解反应是微弱的,所以表示盐类水解的离子方程式不用“ ”,而是用“
”,而是用“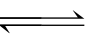 ”。盐类的水解程度一般都很小,通常不会生成沉淀和气体,因此盐类水解的离子方程式中一般不标“↓”或“↑”的气标,也不把生成物(如NH3·H2O、H2CO3等)写成其分解产物的形式。
”。盐类的水解程度一般都很小,通常不会生成沉淀和气体,因此盐类水解的离子方程式中一般不标“↓”或“↑”的气标,也不把生成物(如NH3·H2O、H2CO3等)写成其分解产物的形式。
②多元弱酸的酸根离子水解是分步进行的,且以第1步水解为主,例如Na2CO3的水解:
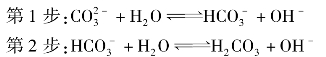
多元弱碱的阳离子水解复杂,可看作一步水解,例如Fe3+的水解:
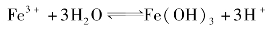
③多元弱酸的酸式酸根离子既有水解倾向又有电离倾向,以水解为主的溶液显碱性;以电离为主的溶液显酸性。例如: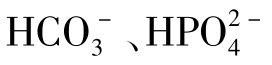 在溶液中以水解为主,其溶液显碱性;
在溶液中以水解为主,其溶液显碱性;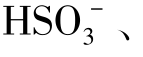
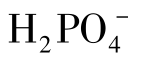 在溶液中以电离为主,其溶液显酸性。
在溶液中以电离为主,其溶液显酸性。
能发生双水解的离子组,一般来说水解都比较彻底,不形成水解平衡,生成物也能出现沉淀、气体。在书写水解反应方程式时要标明物质状态,即标上“↓”“↑”符号,反应方程式用“ ”连接,如NaHCO3溶液与Al2(SO4)3溶液混合:
”连接,如NaHCO3溶液与Al2(SO4)3溶液混合:
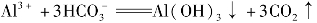
类似的还有:Al3+与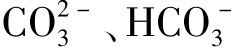 、S2-、HS-、
、S2-、HS-、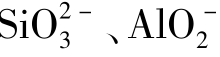 ;Fe3+与
;Fe3+与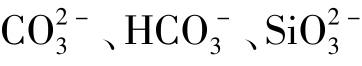 、
、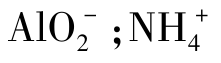 与
与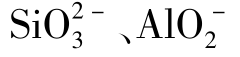 等。
等。
4.3.3 盐类水解的计算
例题4.12 计算0.10mol/L NH4Cl溶液的pH。
解:NH4Cl为强酸弱碱盐,水解方程式为:
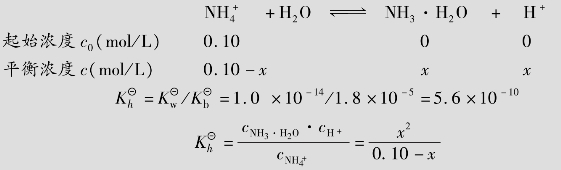
由于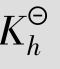 很小,可作近似计算0.10-x≈0.10
很小,可作近似计算0.10-x≈0.10
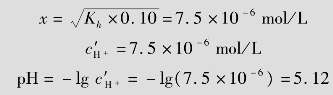
答:0.10mol/L NH4Cl溶液的pH为5.12。
例题4.13 计算0.10mol/L NaAc溶液的pH和水解度。
解:NaAc为强碱弱酸盐,水解方程式为:
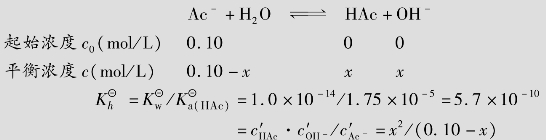
因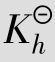 很小,可作近似计算0.10-x≈0.10,所以
很小,可作近似计算0.10-x≈0.10,所以
c′OH-=7.5×10-6mol/L
pH1=14-pOH=14+lg(7.5×10-6)=8.88
h1=(7.5×10-6/0.10)×100%=7.5×10-3%
根据以上例题可以推导出盐类水解的另两个通式:
一元弱酸强碱盐:
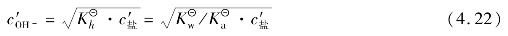
一元强酸弱碱盐:
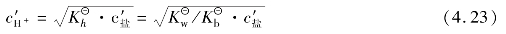
弱酸弱碱盐的水解计算较复杂,本书不作讨论。
4.3.4 影响盐类水解的因素
影响盐类水解的主要因素应该是盐本身的性质,这是内因。碱越弱,对应阳离子水解程度越大,溶液酸性越强,对应弱碱阳离子浓度越小。酸越弱,酸根阴离子水解程度越大,溶液碱性越强,对应酸根离子浓度越小。即越弱越水解。
其次影响盐类水解的因素还有温度、浓度、酸碱度,这是外因。
①温度。盐的水解反应是吸热反应,升高温度水解程度增大。
②浓度。盐的浓度越小,一般水解程度越大。加水稀释盐的溶液,可以促进水解。
③溶液的酸、碱性。盐类水解后,溶液会呈不同的酸、碱性,因此控制溶液的酸、碱性,可以促进或抑制盐的水解,故在盐溶液中加入酸或碱都能影响盐的水解。
4.3.5 盐类水解的应用
(1)分析盐溶液的酸碱性,并比较酸碱性的强弱
如:相同浓度的Na2CO3、NaHCO3溶液均显碱性,且碱性Na2CO3>NaHCO3。
(2)配制能水解的盐溶液时要注意防止水解
如:配制FeCl3溶液时,要向该溶液中加入适量的盐酸防止水解。
(3)判断溶液中的离子能否大量共存
如:能发生双水解的离子不能大量共存。
(4)解释与水解有关的现象
①将活泼的金属放在强酸弱碱盐的溶液里,会有气体产生。如:将镁条放入NH4Cl溶液中会有H2放出,因为NH4Cl要水解产生H+,活泼的金属镁置换H+产生H2。
②热的纯碱溶液有较好的去污能力。因为升高温度促进盐类的水解,使纯碱溶液的碱性增强,故热纯碱溶液去油污的效果更好。
③明矾有净水作用。因为明矾溶于水能水解生成胶状的氢氧化铝,氢氧化铝能吸附水里悬浮的杂质形成沉淀使水澄清。
④泡沫灭火器的原理。泡沫灭火器就是利用强酸弱碱盐与强碱弱酸盐的相互作用,因为饱和的硫酸铝溶液与饱和的碳酸氢钠溶液混合后的离子方程式为:Al3++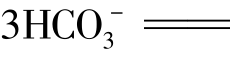 Al(OH)3↓+3CO2↑,有白色沉淀和大量的气泡产生,由于CO2的存在故可起到灭火作用。
Al(OH)3↓+3CO2↑,有白色沉淀和大量的气泡产生,由于CO2的存在故可起到灭火作用。
⑤铵态氮肥使用时不宜与草木灰混合使用。因为草木灰中主要含有K2CO3,其水解显碱性,与铵盐中的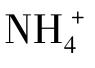 反应。
反应。
4.4 沉淀溶解平衡
4.4.1 难溶电解质的溶度积
严格地说,在水中绝对不溶的电解质是不存在的。通常将溶解度小于0.01g/L的电解质称为难溶电解质,难溶电解质在溶液始终存在溶解与沉淀两个过程。例如,在一定温度下,将过量AgCl固体投入水中,Ag+和Cl-在水分子的作用下会不断离开固体表面而进入溶液,形成水合离子,这是AgCl的溶解过程。同时,已溶解的Ag+和Cl-又会因固体表面的异号电荷离子的吸引而回到固体表面,这是AgCl的沉淀过程。当沉淀与溶解两过程达到平衡时,此时的状态称为沉淀溶解平衡。
例如AgCl(s)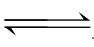 Ag++Cl-
Ag++Cl-
根据平衡原理,其平衡常数可表示为KΘ=cAg+·cCl-
对于沉淀溶解平衡,我们把一定温度下,难溶电解质饱和溶液中有关离子浓度(以计量系数为乘幂)的乘积称为溶度积常数(可简称溶度积),用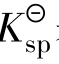 表示。
表示。
即 KΘ=cAg+·cCl-表示为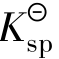 =cAg+·cCl-
=cAg+·cCl-
若难溶电解质为AmBn型,在一定温度下其饱和溶液中的沉淀溶解平衡为:
AmBn(s) m A n+(aq)+n B m-(aq)
m A n+(aq)+n B m-(aq)
溶度积常数的表达式为:
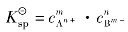
表达式中的浓度是沉淀溶解达到平衡时离子的浓度,此时的溶液是饱和或准饱和溶液。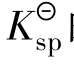 的大小反映了难溶电解质溶解能力。当化学式所表示的组成中阴、阳离子个数比相同时,
的大小反映了难溶电解质溶解能力。当化学式所表示的组成中阴、阳离子个数比相同时,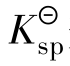 数值越大的难溶电解质在水中的溶解能力越强。
数值越大的难溶电解质在水中的溶解能力越强。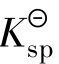 的大小与温度有关,而与难溶电解质的质量无关。
的大小与温度有关,而与难溶电解质的质量无关。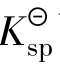 可以比较同种类型难溶电解质的溶解度的大小,不同类型的难溶电解质溶解度的大小不能用
可以比较同种类型难溶电解质的溶解度的大小,不同类型的难溶电解质溶解度的大小不能用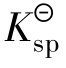 比较。
比较。
4.4.2 溶度积与溶解度的关系
溶解度用S表示,S和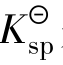 是从不同侧面描述物质的溶解性,尽管二者之间有根本的区别,但也有必然的数量关系。在溶度积的计算中,离子浓度必须是物质的量浓度,其单位是mol/L,而溶解度的单位往往是g/100g水。因此,计算时常常要先将难溶电解质的溶解度S的单位换算成mol/L的浓度单位。
是从不同侧面描述物质的溶解性,尽管二者之间有根本的区别,但也有必然的数量关系。在溶度积的计算中,离子浓度必须是物质的量浓度,其单位是mol/L,而溶解度的单位往往是g/100g水。因此,计算时常常要先将难溶电解质的溶解度S的单位换算成mol/L的浓度单位。
例题4.14 已知CaCO3的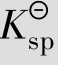 =8.7×10-9,求CaCO3在水中的溶解度。
=8.7×10-9,求CaCO3在水中的溶解度。
解:设CaCO3在水中的溶解度为S,则S为平衡浓度
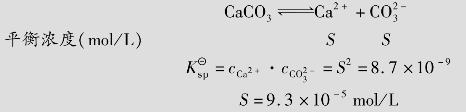
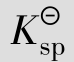 与S之间存在数量关系,是由于某些离子的浓度与S有关,例如在本例中cCa2+和
与S之间存在数量关系,是由于某些离子的浓度与S有关,例如在本例中cCa2+和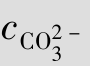 均等于S。
均等于S。
例题4.15 298 K时,Ag2CrO4的溶解度为1.34×10-4mol/L,求Ag2CrO4的溶度积。
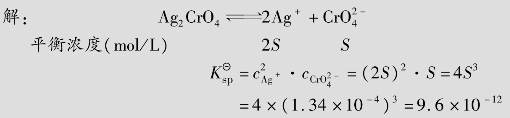
通过上面两个例子可知:相同类型的难溶电解质,其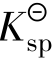 大的S也大。不同类型的难溶电解质不能直接用溶度积比较其溶解度相对大小。
大的S也大。不同类型的难溶电解质不能直接用溶度积比较其溶解度相对大小。
4.4.3 溶度积规则及应用
在难溶电解质的溶液中,我们把有关离子浓度幂次方的乘积称为离子积,用符号Qi表示。
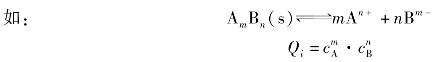
Qi和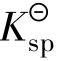 的表达式完全一样,但Qi表示任意情况下的有关离子浓度方次的乘积,其数值不定;而
的表达式完全一样,但Qi表示任意情况下的有关离子浓度方次的乘积,其数值不定;而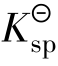 仅表示达到沉淀溶解平衡时有关离子浓度方次的乘积,二者有本质区别。在任何给定的难溶电解质的溶液中,Qi与
仅表示达到沉淀溶解平衡时有关离子浓度方次的乘积,二者有本质区别。在任何给定的难溶电解质的溶液中,Qi与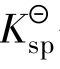 作比较有3种情况:
作比较有3种情况:
①Qi<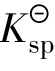 时,为不饱和溶液,无沉淀析出。若体系中有固体存在,固体将溶解直至饱和为止。所以Qi<
时,为不饱和溶液,无沉淀析出。若体系中有固体存在,固体将溶解直至饱和为止。所以Qi<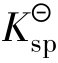 是沉淀溶解的条件。
是沉淀溶解的条件。
②Qi=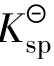 时,是饱和溶液,处于动态平衡状态。
时,是饱和溶液,处于动态平衡状态。
③Qi>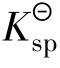 时,为过饱和溶液,有沉淀析出,直至饱和。
时,为过饱和溶液,有沉淀析出,直至饱和。
因此,Qi>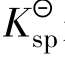 是沉淀生成的条件。
是沉淀生成的条件。
以上3条规则称为溶度积规则,它是难溶电解质多相离子平衡移动规律的总结。据此可以判断体系中是否有沉淀生成或溶解,也可以通过控制离子的浓度,使沉淀生成或使沉淀溶解。
在难溶电解质的溶液中,要使该物质的沉淀生成,根据溶度积规则,则必须达到沉淀生成的必要条件,即Qi>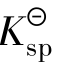 。
。
例题4.16 将等体积的4×10-5mol/L AgNO3和4×10-5mol/L K2CrO4混合时,有无砖红色Ag2CrO4沉淀析出?

根据溶度积规则,沉淀溶解的必要条件是Qi<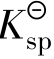 ,只要采取一定的措施,降低难溶电解质沉淀溶解平衡系统中有关离子的浓度,就可以使沉淀溶解。溶解方法有以下几种:
,只要采取一定的措施,降低难溶电解质沉淀溶解平衡系统中有关离子的浓度,就可以使沉淀溶解。溶解方法有以下几种:
①利用酸、碱或某些盐类(如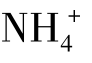 盐)与难溶电解质组分离子结合成弱电解质(如弱酸,弱碱或H2O)可以使该难溶电解质的沉淀溶解。例如固体ZnS可以溶于盐酸中,其反应过程如下:
盐)与难溶电解质组分离子结合成弱电解质(如弱酸,弱碱或H2O)可以使该难溶电解质的沉淀溶解。例如固体ZnS可以溶于盐酸中,其反应过程如下:

由上述反应可见,因H+与S2-结合生成弱电解质,而使cS2-降低,使ZnS沉淀溶解平衡向溶解的方向移动,若加入足够量的盐酸,则ZnS会全部溶解。将上式(1)+(2)+(3),得到ZnS溶于HCl的溶解反应式:
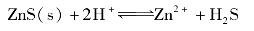
可见,难溶弱酸盐溶于酸的难易程度与难溶盐的溶度积和酸反应所生成的弱酸的电离常数有关。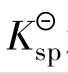 越大,
越大,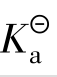 值越小,其反应越容易进行。
值越小,其反应越容易进行。
例题4.17 欲使0.10mol/L ZnS或0.10mol/L CuS溶解于1 L盐酸中,所需盐酸的最低浓度是多少?
式中,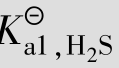 =9.1×10-8;
=9.1×10-8;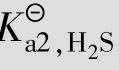 =1.1×10-12;cH2S=0.10mol/L(饱和H2S溶液的浓度),所以
=1.1×10-12;cH2S=0.10mol/L(饱和H2S溶液的浓度),所以
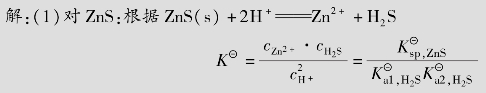
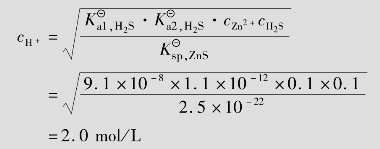
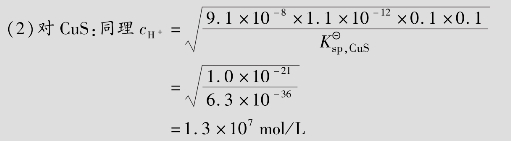
计算表明,溶度积较大的ZnS可溶于稀盐酸中,而溶度积较小的CuS则不能溶于盐酸(市售浓盐酸的浓度仅为12mol/L)中。
②加入一种氧化剂或还原剂,使某一离子发生氧化还原反应而降低其浓度,可以使该难溶电解质的沉淀溶解。如:CuS、PbS、Ag2S等都不溶于盐酸,但能溶于硝酸。
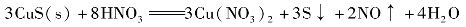
硝酸将S2-氧化成单质硫析出,cS2-降低了,故CuS沉淀溶解。
③在难溶电解质的溶液中加入一种配位剂,使难溶电解质的组分离子形成稳定的配离子,从而降低难溶电解质组分离子的浓度,可以使该难溶电解质的沉淀溶解。如:AgCl溶于氨水。
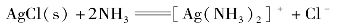
由于生成了稳定的[Ag(NH3)2]+配离子,降低了cAg+,使Qi<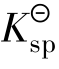 。所以AgCl沉淀溶解了。
。所以AgCl沉淀溶解了。
以上介绍的使沉淀溶解的几种方法,都能降低难溶电解质组分离子的浓度。在实际工作中,常常会遇到系统中同时含几种离子,当加入某种沉淀剂时,几种离子均可能发生沉淀反应,生成难溶电解质。例如,向含有相同浓度的Cl-和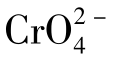 的溶液中,滴加AgNO3溶液,首先会生成白色的AgCl沉淀,然后生成砖红色的Ag2CrO4沉淀。这种先后沉淀的现象,叫分步沉淀。对于混合溶液中几种离子与同一种沉淀剂反应生成沉淀的先后次序,可用溶度积规则来进行判断。
的溶液中,滴加AgNO3溶液,首先会生成白色的AgCl沉淀,然后生成砖红色的Ag2CrO4沉淀。这种先后沉淀的现象,叫分步沉淀。对于混合溶液中几种离子与同一种沉淀剂反应生成沉淀的先后次序,可用溶度积规则来进行判断。
设某混合液中,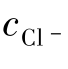 =
=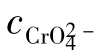 =0.010mol/L,逐滴加入AgNO3后,析出沉淀所需要的Ag+最低浓度是:
=0.010mol/L,逐滴加入AgNO3后,析出沉淀所需要的Ag+最低浓度是:
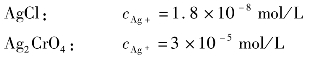
显然,析出AgCl沉淀所需的cAg+比析出Ag2CrO4沉淀所需要的小得多,所以AgCl会先沉淀。随着AgCl沉淀不断地生成,cCl-会不断减少,若要继续生成沉淀,就必须继续加入Ag+,当cAg+增加到能使CrO2-4开始析出Ag2CrO4沉淀时,Ag2CrO4和AgCl会同时沉淀出来。因Ag2CrO4和AgCl处于同一系统中,cAg+必须同时满足Ag2CrO4和AgCl的溶度积。
对于同类型的沉淀来说,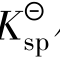 小的先沉淀,溶度积差别越大,后沉淀离子的浓度越小,分离效果就越好。
小的先沉淀,溶度积差别越大,后沉淀离子的浓度越小,分离效果就越好。
分步沉淀的次序:一是与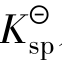 及沉淀类型有关。沉淀类型相同,被沉淀离子浓度相同,
及沉淀类型有关。沉淀类型相同,被沉淀离子浓度相同,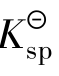 小者先沉淀,
小者先沉淀,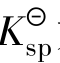 大者后沉淀;沉淀类型不同,要通过计算确定。二是与被沉淀离子浓度有关。
大者后沉淀;沉淀类型不同,要通过计算确定。二是与被沉淀离子浓度有关。
借助于某种试剂,将一种难溶电解质转变为另一种难溶电解质的过程,称为沉淀的转化。
如:在PbCl2饱和溶液中,加入NaCO3溶液后,可生成新的沉淀PbCO3。
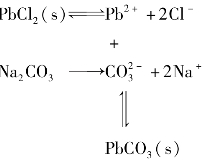
一般来讲,溶解度较大的难溶电解质容易转化为溶解度较小的难溶电解质。如果两种难溶电解质的溶解度相差越大,沉淀转化越完全。但是欲将溶解度较小的难溶电解质转化为溶解度较大的难溶电解质就比较困难;如果溶解度相差太大,则转化实际上不能实现。
4.5 配位离解平衡
4.5.1 配合物的概述
在CuSO4溶液中加入氨水,开始有蓝色沉淀产生,继续加入过量氨水,沉淀溶解,得到深蓝色溶液,经分析证明Cu(OH)2沉淀与NH3·H2O进一步反应生成了[Cu(NH3)4]SO4深蓝色溶液。其主要是Cu2+与NH3二者间以配位键结合生成了复杂离子[Cu(NH3)4]2+,我们把Cu2+称为中心离子,NH3称为配位分子,像这种由中心离子(或原子)和配体分子(或离子)以配位键相结合而形成的复杂分子或离子,通常称为配位单元。如:[Co(NH3)6]3+、[Cr(CN)6]3-、Ni(CO)4都是配位单元,分别称为配阳离子、配阴离子、配分子。凡是含有配位单元的化合物都称作配位化合物,简称配合物。如:[Co(NH3)6]Cl3、K3[Cr(CN)6]、Ni(CO)4都是配位化合物。
配合物是由内界和外界组成的。以[Cu(NH3)4]SO4为例,[Cu(NH3)4]2+是配合物的内界,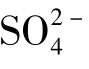 是配合物的外界,如图4.3所示。
是配合物的外界,如图4.3所示。

图4.3 配合物的内界和外界
又如:K4[Fe(CN)6]之中,内界[Fe(CN)6]3-,外界K+。配合物可以无外界,但不能没有内界。如[Ni(CO)4]。
配合物的内界是由中心离子和一定数目的配位体形成的配位单元。中心离子是配合物的形成主体,多为金属(过渡金属)离子,也可以是原子,它能提供接纳孤对电子的空轨道。如:Fe3+、Fe2+、Co2+、Ni2+、Cu2+、Co等。配位体是含有孤对电子的阴离子或分子,如:NH3、H2O、Cl-、Br-、I-、CN-、CNS-等。配位体中给出孤对电子与中心离子直接形成配位键的原子,叫配位原子。配位单元中,中心离子周围与中心离子直接成键的配位原子的个数叫配位数。如:配位化合物[Cu(NH3)4]SO4的内界为[Cu(NH3)4]2+,中心离子Cu2+的周围有4个配位体NH3,每个NH3中有一个N原子与Cu2+配位,N是配体原子,Cu的配位数为4,如图4.4所示。

图4.4 配位单元的组成
配位体常分为单齿配位体和多齿配位体。(简称单齿配体和多齿配体)两种。单齿配体是指一个配位体中只能提供一个配位原子与中心离子成键。如:CN-、H2O、NH3、CO、Cl-等均是单齿配体。配位原子分别是N、O、N、C和Cl,它们直接与中心原子键合。多齿配体是指有两个或两个以上配位原子与中心离子成键。如:乙二胺H2NCH2CH2NH2是双齿配体,配位原子是两个N原子;乙二胺四乙酸根(简称EDTA4-)(—OOCCH2)2N—CH2—CH2—N(CH2COO—)2是六齿配体,配位原子是2个N和4个羧基上的O配位体为负离子或中性分子,偶尔也有正离子(如NH2NH+)。带电荷的配位体称为配离子,带正电荷的配离子称为配阳离子,带负电荷的称配阴离子。配离子的电荷为金属离子和配体所带电荷之和,例如Fe2+和6CN-配位产生[Fe(CN)6]4-配阴离子,Cu2+和4NH3产生[Cu(NH3)4]2+配阳离子,它们各与带相反电荷的阳离子或阴离子组成配合物。中性配位体就是配合物,例如Pt2+和2NH3及2Cl-产生[Pt(NH3)2Cl2];Ni和4CO产生[Ni(CO)4]。
配合物种类繁多,结构复杂,因此有必要进行系统命名。配离子命名原则如下:
①命名配离子时,配位体的名称放在前,中心离子(或中心原子)名称放在后。
②配位体和中心原子的名称之间用“合”字相连。
③中心原子为离子,在金属离子的名称之后附加带圆括号的罗马数字,以表示离子的价态。
④用中文数字在配位体名称之前表明配位数。
⑤如果配合物中有多个配位体,配位体命名的排列次序为:阴离子配位体在前,中性分子配位体在后;无机配位体在前,有机配位体在后。同类配位体中,按配位原子的元素符号在英文字母表中的次序分出先后,在前面的先命名。配位原子相同,配体中原子个数少的在前面。不同配位体的名称之间用圆点分开。
如:[Cu(NH3)4]2+称四氨合铜(Ⅱ)配离子,[PtCl3(NH3)]-称三氯·一氨合铂(Ⅱ)配离子,[PtCl3(C2H4)]-称三氯·(乙烯)合铂(Ⅱ)配离子,[Co(NH3)5(H2O)]3+称三氯化五氨·一水合钴(Ⅲ)配离子,[Pt(Py)(NH3)(NO2)(NH2OH)]+称一硝基·一氨·一羟氨·吡啶合铂(Ⅱ)配离子。
配合物的命名是把配离子视为简单离子,在配离子与其他离子间加“化”字或“酸”字,命名时先阴离子,后阳离子,配阴离子看成是酸根。如:[Cu(NH3)4]SO4称硫酸四氨合铜(Ⅱ),[Pt(NH3)2Cl2]称二氯·二氨合铂(Ⅱ),K[Ag(NH3)]OH称氢氧化二氨合银(Ⅰ)[PtCl3(C2H4)]称三氯·(乙烯)合铂(Ⅱ)酸钾,H2[PtCl6]称六氯合铂(Ⅳ)酸,[Co(NH3)5(H2O)]Cl3称三氯化五氨·一水合钴(Ⅲ)。实际上,配合物还常用俗名,如K4[Fe(CN)6]称黄血盐,K3[Fe(CN)6]称赤血盐,Fe4[Fe(CN)6]3称普鲁士蓝。
4.5.2 配位离解平衡
配合物在水溶液中存在着两种离解方式,内外界按强电解质电离方式全部离解;内界的中心离子和配体按弱电解质电离方式部分离解,并存在着离解与配位两个相反的过程,当配位离子离解与配位的速度相等时,体系所处的状态叫配位离解平衡,如:
[Cu(NH3)4]2+ Cu2++4NH3
Cu2++4NH3
当配离子[Cu(NH3)4]2+的离解速度与Cu2+、NH3的配位速度相等时,体系就处于平衡状态,有关离子、分子的浓度相对不变。
配离子在溶液中处于离解配位平衡时,有离解平衡常 数(不稳定常数)
数(不稳定常数)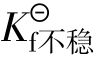 与稳定常数
与稳定常数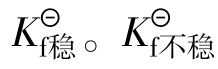 越大配离子越不稳定,
越大配离子越不稳定,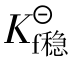 越大配离子越稳定。与
越大配离子越稳定。与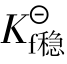 的关系:
的关系: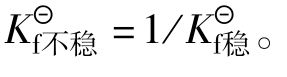
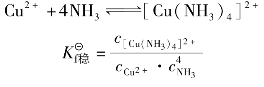
4.5.3 配位平衡移动
在水溶液中,配离子的稳定性是相对的,当外界条件发生变化时,平衡发生移动,在新的条件下建立新的平衡。配离子从一个平衡状态变化到另一个平衡状态的过程叫配位平衡的移动。导致配位平衡移动的因素有:
1)溶液酸度对配位离解平衡的影响
例如:在酸性介质中,F-离子能与Fe3+离子生成[FeF6]3-配离子。当酸度过大(cH+>0.5mol/L)时,由于H+与F-结合生成了HF分子,降低了溶液中F-浓度,使[FeF6]3-配离子大部分解成Fe3+,原有的平衡被破坏。反应如下:
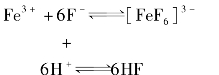
上式表明,酸度增大会引起配位体浓度下降,导致配合物的稳定性降低。这种现象通常称为配位体的酸效应。
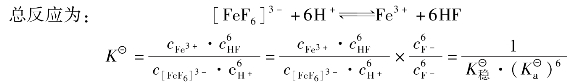
显然,pH值对配位反应的影响程度与配离子的稳定常数有关,与配位剂生成的弱酸的强度有关。
2)沉淀反应对配位离解平衡的影响
沉淀反应与配位平衡的关系,可看成是沉淀剂和配位剂共同争夺中心离子的过程。配合物的稳定常数 越大或沉淀的
越大或沉淀的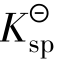 越大,则沉淀越容易被配位反应溶解。
越大,则沉淀越容易被配位反应溶解。
例如:用浓氨水可将氯化银溶解。这是由于沉淀物中的金属离子与所加的配位剂形成了稳定的配合物,导致沉淀的溶解,其过程为:
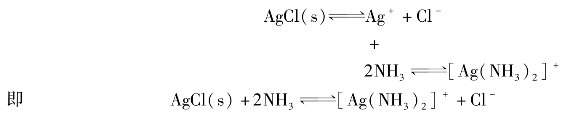
该反应的平衡常数为:
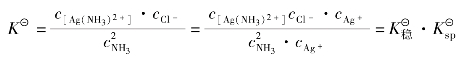
例如:在[Cu(NH3)4]2+溶液中加入Na2S溶液,就有CuS沉淀生成,配离子原有平衡被破坏,其过程可表示为:
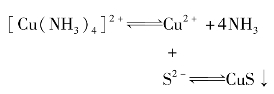
总反应为:
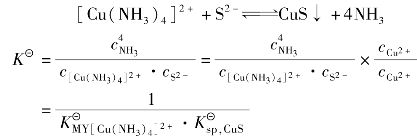
由上述两个平衡常数表达式可以看出,沉淀能否被溶解或配合物能否被破坏,主要取决于沉淀物的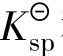 和配合物
和配合物 的值。同时,还取决于所加的配位剂和沉淀剂的用量。
的值。同时,还取决于所加的配位剂和沉淀剂的用量。
例题4.18 计算完全溶解0.01mol的AgCl和完全溶解0.01mol的AgBr,至少需要1 L多大浓度的氨水?(已知AgCl的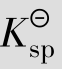 =1.8×10-10,AgBr的
=1.8×10-10,AgBr的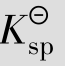 =5.0×10-13,[Ag(NH3)2]+的
=5.0×10-13,[Ag(NH3)2]+的 =1.12×107)
=1.12×107)
解:假定AgCl溶解全部转化为[Ag(NH3)2]+,则氨一定是过量的。因此可忽略[Ag(NH3)2]+的离解产生的NH3,所以平衡时[Ag(NH3)2]+的浓度为0.01mol/L,Cl-的浓度为0.01mol/L,反应为:
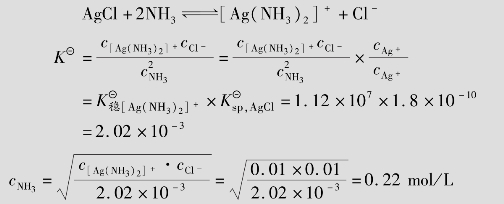
在溶解的过程中与AgCl反应需要消耗氨水的浓度为2×0.01=0.02mol/L,所以氨水的最初浓度为:0.22+0.02=0.24mol/L。
同理,完全溶解0.01mol的AgBr,设平衡时氨水的平衡浓度为ymol/L
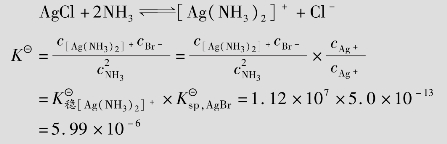
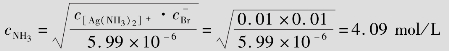
所以,溶解0.01mol的AgBr需要的氨水的浓度是4.09+0.02=4.11mol/L。
可以看出,同样是0.01mol的固体,由于两者的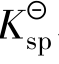 相差较大,导致溶解需要的氨水的浓度有很大的差别。
相差较大,导致溶解需要的氨水的浓度有很大的差别。
例题4.19 向0.1mol/L的[Ag(CN)2]-配离子溶液(含有0.10mol/L的CN-)中加入KI固体,假设I-的最初浓度为0.1mol/L,有无AgI沉淀生成?(已知[Ag(CN)2]-的 =1.0×1021,AgI的
=1.0×1021,AgI的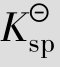 =8.3×10-17)
=8.3×10-17)
解:设[Ag(CN)2]-配离子离解所生成的cAg+=xmol/L,
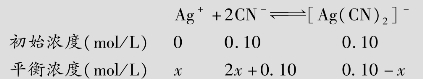
[Ag(CN)2]-解离度较小,故0.10-x≈0.1,代入 表达式得
表达式得
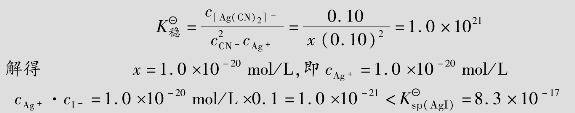
因此,向0.1mol/L的[Ag(CN)2]-配离子溶液(含有0.10mol/L的CN-)中加入KI固体,没有AgI沉淀产生。
3)配位平衡对氧化还原反应的影响
配位平衡对氧化还原反应的影响主要是因为在氧化还原电对中,加入一定的配位剂后,由于氧化型离子或还原型离子与配位剂发生反应生成相应的配离子,从而减小了相应离子的浓度,从而使电对的电极电势发生变化。
例如:金属Cu能从Hg(NO3)2溶液中置换出Hg却不能从[Hg(CN)4]2-溶液中置换出Hg,就是因为在[Hg(CN)4]2-溶液中,由于[Hg(CN)4]2-的稳定常数很大,游离的Hg2+浓度很小,降低了Hg2+/Hg电对的电极电势,使Hg2+氧化能力降低。
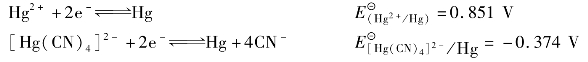
可见,氧化型离子生成配离子后,使电对的电极电势降低了。
利用稳定常数,可以计算金属与配离子之间的标准电极电势。
例题4.20 计算[Ag(NH3)2]++e  Ag+2NH3的标准电极电势。
Ag+2NH3的标准电极电势。
解:查表得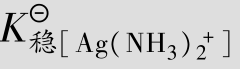 =1.12×107,
=1.12×107,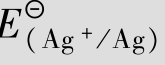 =0.799 V
=0.799 V
①求配位平衡时c(Ag+)
根据题意要求标准电极电势,此时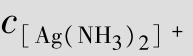 =
=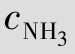 =1mol/L,所以
=1mol/L,所以
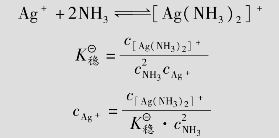
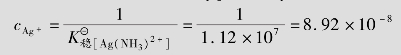
②求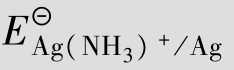
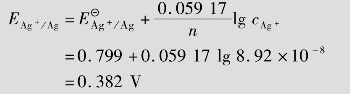
根据标准
+电极电势的定义,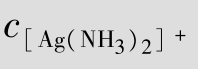 =
=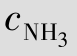 =1
=1 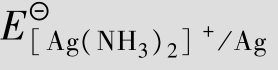 mol/L时,
mol/L时,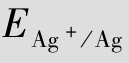 就是电极反应[Ag(NH3)2]+e
就是电极反应[Ag(NH3)2]+e  Ag+2NH3的标准电极电势,即=0.382 V。
Ag+2NH3的标准电极电势,即=0.382 V。
从此题看出,由于Ag+生成了配离子,电极电势降低了。
4)配位平衡之间的转化
在配位反应中,一种配离子可以转化成更稳定的配离子,即平衡向生成更难解离的配离子方向移动。两种配离子的稳定常数相差越大,则转化反应越容易发生。
如[HgCl4]2-与I-反应生成[HgI4]2-,Fe(NCS)6]3-与F-反应生成[FeF6]3-,其反应式如下:
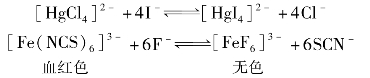
这是由于,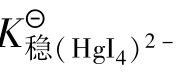 >
>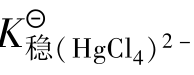 ;
;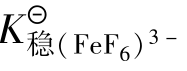 >
>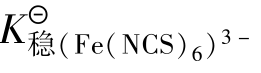 。
。
例题4.21 计算反应[Ag(NH3)2]++2CN-ܪܒܩ[Ag(CN)2]-+2NH3的平衡常数,并判断配位反应进行的方向。
解:查表得,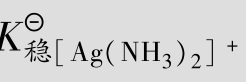 =1.12×107,
=1.12×107,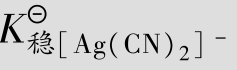 =1.0×1021
=1.0×1021
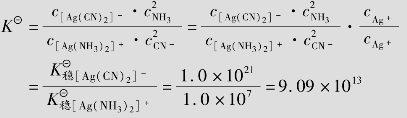
所以,反应向生成[Ag(CN)2]-的方向进行。
通过以上讨论我们可以知道,形成配合物后,物质的溶解性、酸碱性、氧化还原性、颜色等都会发生改变。在溶液中,配位解离平衡常与沉淀溶解平衡、酸碱平衡、氧化还原平衡等发生相互竞争。利用这些关系,使各平衡相互转化,可以实现配合物的生成或破坏,以达到科学实验或生产实践的需要。
4.6 酸碱质子理论
阿伦尼乌斯的酸碱电离理论从定量的角度描写酸碱的性质和它们在化学反应中的作用,解释了酸碱的强弱。但阿伦尼乌斯酸碱理论也遇到一些难题,不能说明Ac-也是碱,也不能说明氨气与氯化氢的反应是酸碱反应。丹麦的布朗斯特和英国的劳瑞,他们于1923年同时提出了酸碱质子理论,扩大了酸碱的范围,将酸碱概念从“水体系”推广到了“质子体系”。
4.6.1 酸碱的概念
质子理论认为:凡能给出质子(H+)的物质都是酸;凡能接受质子的物质都是碱。例如HCl、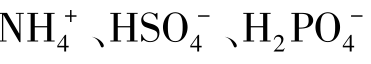 都是酸,因为它们能给出质子;Cl-、NH3、
都是酸,因为它们能给出质子;Cl-、NH3、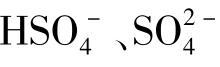 、NaOH等都是碱,因为他们能接受质子。质子理论中,酸和碱不仅可以是分子,还可以是正、负离子。
、NaOH等都是碱,因为他们能接受质子。质子理论中,酸和碱不仅可以是分子,还可以是正、负离子。
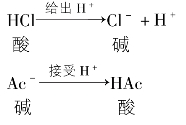
根据酸碱质子理论,酸和碱不是孤立的,酸给出质子后生成碱,碱接受质子后就变成酸。
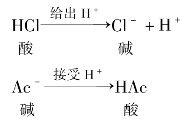
有酸一定有碱,有碱一定有酸,酸和碱是同时存在的,我们把这样一对同时存在的酸和碱称为共轭酸碱。如:HCl的电离,右边的碱是左边酸的共轭碱;左边酸又是右边的碱的共轭酸。
在酸碱质子理论中,把既能给出质子又能接受质子的物质叫两性物质。如:H2O、NH3(非水溶性)、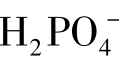 。两性物质是酸还是碱,决定于具体的反应。如:水给出质子时是酸;水接受质子生成H3O+、H2O时是碱。
。两性物质是酸还是碱,决定于具体的反应。如:水给出质子时是酸;水接受质子生成H3O+、H2O时是碱。
由酸碱质子理论可以看出:
①酸和碱可以是分子,也可以是阳离子或阴离子。
②有的离子在某个共轭酸碱对中是碱,但在另一个共轭酸碱对中却是酸,如:H2O等。
③质子理论中没有盐的概念,酸碱电离理论中的盐,在质子理论中都是质子酸或质子碱。
④一种物质是酸还是碱,是由它在酸碱反应中的作用而定的。由此可见,酸和碱的概念具有相对性。
4.6.2 酸碱反应
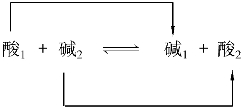
质子理论认为:酸碱反应实质是两个共轭酸碱对相互传递质子的反应。其表达式为:
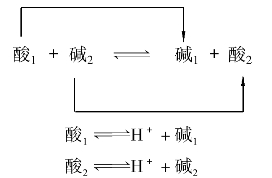
两个共轭酸碱对传递质子发生的化学反应,其中酸1把H+传递给碱2,酸1变成了碱1;碱2接受酸1传递的H+,碱2变成了酸2。
如:
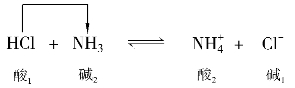
HCl和NH3的反应,HCl是酸,放出质子给NH3,然后变为它的共轭碱Cl-;NH3是碱,接受质子后转变成它的共轭酸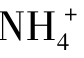 。酸碱反应的方向总是从强酸强碱向弱酸弱碱方向进行。即:强碱夺取强酸放出的质子,转化成较弱的共轭酸和共轭碱。
。酸碱反应的方向总是从强酸强碱向弱酸弱碱方向进行。即:强碱夺取强酸放出的质子,转化成较弱的共轭酸和共轭碱。
酸碱质子理论扩大了酸和碱的范围。电离作用、中和作用、水解作用、同离子效应在酸碱电离理论中分别是不同的反应类型,而在酸碱质子理论中全部包括在酸碱反应的范围内,它们都是质子传递的酸碱中和作用。如HAc的电离作用:
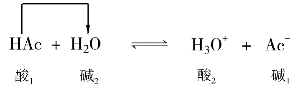
HAc和NH3的中和作用:
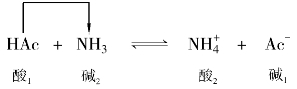
NaAc的水解作用:
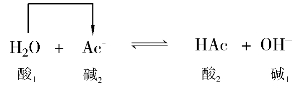
HAc中加NaAc(同离子效应):
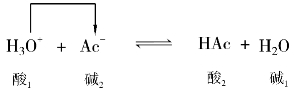
由此可知:在水溶液中进行的各类离子反应全部都是质子传递的酸碱反应。
4.6.3 溶液的酸碱性
质子理论认为:酸的强度决定于它给出质子的能力和溶剂分子接受质子的能力;碱的强度决定于它夺取质子的能力和溶剂分子给出质子的能力。就是说,酸碱的强度与酸碱的性质和溶剂的性质有关。对于:
HA+B-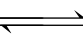 HB+A-
HB+A-
由化学平衡知识可知:在一定温度下,KΘ其值一定。KΘ值越大,表示质子从HA中转移给B的能力越强。
如比较HClO4、H2SO4、HCl和HNO3的强弱,若在H2O中进行,由于H2O接受质子的能力所致,四者均完全电离,故比较不出强弱。若放到HAc中,由于HAc接受质子的能力比H2O弱得多,所以尽管四者给出质子的能力没有变,但是在HAc中却是部分电离。于是根据Ka的大小,可以比较其酸性的强弱。
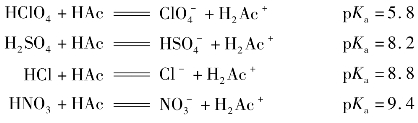
所以四者从强到弱依次是:HClO4>H2SO4>HCl>HNO3。
如比较HCl、HAc和H2S的强弱,在水溶液中,酸碱的强度决定于酸将质子给予水分子或碱从水分子中夺取质子的能力,通常用酸碱在水中的离解常数的大小来衡量。酸碱的离解常数越大酸碱性越强。
如:
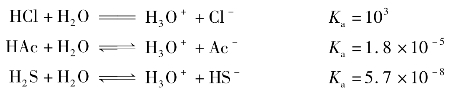
3种酸的强弱顺序是:
HCl>HAc>H2S
酸和碱在水中离解时,同时产生与其相应的共轭碱或共轭酸。某种酸本身的酸性越强(即电离平衡常数Ka值越大),其共轭碱的碱性越弱(即电离平衡常数Kb值越小)。同理,某种碱本身的碱性越强(即Kb值越大),其共轭酸的酸性越弱(即Ka值越小)。
3种共轭碱的强弱顺序是:
Cl-<Ac-<HS-
酸与碱是共轭的,其离解常数Ka与Kb之间必然有一定的关系:Ka·Kb=Kw。知道了某酸的Ka值,就可求得Kb值。电离平衡常数表示酸碱传递质子能力的强弱。酸越强,它的共轭碱越弱,酸越弱,它的共轭碱越强。在同一溶液中,酸碱的相对强弱决定于各酸碱的本性;但同一酸碱在不同溶液中的相对强弱则由溶剂的性质决定。
知识拓展
合成氨适宜条件的选择
工农业生产中对氨的需求量越来越大,合成氨已成为化学工业的一个重要的组成部分。在工业上,用氢气和氮气直接化合制氨气,既要求单位时间内产品的产量要高,又要求原料能够充分利用,尽可能多地转化为产品,降低生产成本,减少毒害物质的排放,这就需要综合考虑化学反应速率和化学平衡两个方面的因素。在实际生产中选择以下工艺条件:
1)浓度的选择
为了使混合气体中氨的含量最大,将反应物配比为n(H2)∶n(N2)=1∶3。同时,生产中要不断地将生成的氨气从反应体系分离出来。
2)压强的选择
增大压强可获得较大的反应速率和较高的转化率。但压强越大,所需动力越大,能量消耗越多,且对设备要求也越高,使设备和生产成本明显增大。因此,生产中在催化剂作用下,兼顾产品产量和生产成本等因素,一般采用压强为20.3~50.7 MPa。
3)温度的选择
在合成氨的生产中,温度的影响是比较复杂的。温度升高,反应速率加快,缩短了反应达到平衡的时间。而合成氨反应为放热反应,温度升高会使平衡向逆方向移动,不利于氨的合成。此外,催化剂铁在温度低时没有催化作用,而在温度比较高时,由于表面烧结等因素,会使催化剂的催化活性降低。铁催化剂的催化温度范围为723~823 K。因此,一般在催化剂的活性温度范围内选择较低的温度,生产中一般为723~773 K。
4)催化剂
化工生产中广泛使用催化剂来提高单位时间的产量。降低生产成本。在合成氨工业中,采用以铁为主体的多组分催化剂。
可见,在化工生产中,运用化学反应速率和化学平衡移动原理,确定一个具体反应条件,一定要从实际出发,综合防治考虑种种因素,反复实践,探索最佳的工艺条件,达到增产、低耗高效、环保的效果。
本意小结
一、化学平衡
1.化学平衡的概念与化学平衡常数
一定温度下,在一个密闭容器里进行的可逆反应,当正反应和逆反应的化学反应速率相等时,即达到了化学平衡。化学平衡是动态平衡,可以从正反应达到,也可以从逆反应达到。在平衡状态时,平衡混合物里各组分的浓度保持不变。
对于可逆反应:
a A+b B 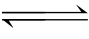 m M+n N
m M+n N
达到平衡时:

2.化学平衡移动原理(勒夏特列原理)
如果改变影响平衡的一个条件(如浓度、温度、压力等),平衡就向能够使这种改变减弱的方向移动。具体分述如下:
浓度:增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,平衡向逆反应方向移动。
温度:升高温度,平衡向吸热反应方向移动;降低温度,平衡向放热反应方向移动。
压力:增大压力,平衡向气体体积缩小方向移动;减小压力,平衡向气体体积增大方向移动。
催化剂对化学平衡的移动没有影响。
二、酸碱电离平衡
1.电离平衡
当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态。电离平衡是化学平衡的一种,同样具有化学平衡的特征。条件改变时平衡移动的规律符合勒夏特列原理。
2.电离平衡常数
对一元弱酸或一元弱碱来说,达到平衡后的溶液中电离所生成的各种离子浓度的乘积,跟溶液未电离的分子浓度之比是一个常数,这一常数叫电离平衡常数,简称电离常数,用Ki表示,标准电离平衡常数用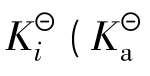 表示酸的标准电离平衡常数,
表示酸的标准电离平衡常数,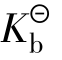 表示碱的标准电离平衡常数)表示。
表示碱的标准电离平衡常数)表示。
例如:乙酸是一种典型的一元弱酸,其水溶液中存在下列平衡:
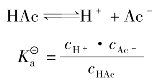
如氨水中存在着下列平衡:

其电离常数表达式是:
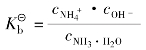
Ki值的大小,表达了一定温度下弱电解质的难易程度。Ki值越大该弱电解质越易电离;Ki值越小,该弱电解质越难电离,故可根据Ki值大小判断弱电解质的相对强度。
3.水的电离和溶液的pH值
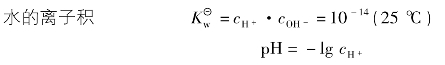
pH越大,酸性越弱,碱性越强;pH越小,酸性越强,碱性越弱。
4.离解度和电离常数的关系
离解度是指电离平衡时,已电离的弱电解质分子数和电离前弱电解质的分子总数之比。
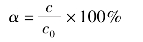
不同的弱电解质在相同浓度时,它们的离解度不同。电解质越弱,离解度越小。所以离解度的大小也可反映出弱电解质的相对强弱。离解度大小除与电解质本性有关外,还与溶液的浓度等因素有关。同一弱电解质溶液,浓度越小,电离度越大。弱电解质的电离度随溶液浓度的降低而增大。
离解度和电离常数之间是相互联系的:
当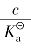 ≥500时,α<10-2,所以1-α≈1,
≥500时,α<10-2,所以1-α≈1,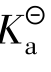 ≈cα2。
≈cα2。
故得离解度与弱酸电离常数关系式为:α≈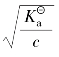
同理可得离解度与弱碱电离常数的关系式为:α≈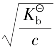
同一弱电解质的离解度近似地与其浓度平方根成反比,即溶液越稀,离解度越大;同一浓度的不同弱电解质的离解度与其离解常数的平方成正比。
5.同离子效应
在弱电解质溶液中加入与弱电解质具有相同离子的强电解质时,将使弱电解质的离解度降低,这种现象称为同离子效应。
6.缓冲溶液
能够抵抗外加少量酸、碱或适量稀释,本身的pH值不发生明显的改变,这种溶液叫缓冲溶液。缓冲溶液对pH值具有缓冲性,是因为这种溶液中含有足够量的能够对抗外加酸的成分即抗酸成分,又含有足够量的能够对抗外加碱的成分即抗碱成分。通常把抗酸成分和抗碱成分称为缓冲对。根据缓冲组分的不同,缓冲溶液主要有3种类型:弱酸及其弱酸盐、弱碱及其弱碱盐、多元酸的酸式盐及其次级盐。缓冲溶液pH值的计算公式为:

三、盐类水解
盐溶于水后电离出来的阴离子或阳离子与水电离出的H+或OH-作用生成弱电解质的反应叫盐类的水解。
1.盐类水解的类型
强碱弱酸盐水解显碱性;强酸弱碱盐水解显酸性;弱酸弱碱盐的水解溶液的酸碱性取决于水解生成的两种弱电解质的相对强弱,也就是取决于它们的电离常数的大小。强碱强酸盐不水解。
2.盐类水解的特点
盐类水解的程度不大,用“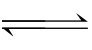 ”表示;多元弱酸的酸根离子水解是分步进行的;多元弱酸的酸式酸根离子既有水解倾向又有电离倾向;能发生双水解的离子组,一般来说水解都比较彻底。
”表示;多元弱酸的酸根离子水解是分步进行的;多元弱酸的酸式酸根离子既有水解倾向又有电离倾向;能发生双水解的离子组,一般来说水解都比较彻底。
3.盐类水解的计算
一元弱酸强碱盐: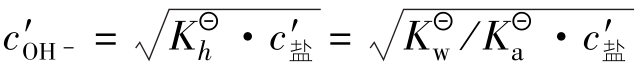
一元强酸弱碱盐: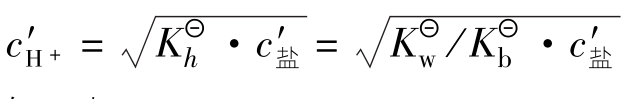
4.影响盐类水解的因素
影响盐类水解的主要因素应该是盐本身的性质,这是内因。其次影响盐类水解的因素还有温度、浓度、酸碱度,这是外因。
5.盐类水解的应用
比较酸碱性的强弱;判断溶液中的离子能否大量共存;解释与水解有关的现象。
四、沉淀溶解平衡
1.沉淀溶解平衡的概念
当沉淀与溶解两过程达到平衡时,此时的状态称为沉淀溶解平衡。
溶度积常数的表达式为: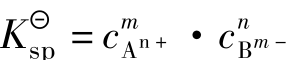
2.溶度积规则
①Qi<Ksp时,为不饱和溶液,无沉淀析出。所以Qi<Ksp是沉淀溶解的条件。
②Qi=Ksp时,是饱和溶液,处于动态平衡状态。
③Qi>Ksp时,为过饱和溶液,有沉淀析出,直至饱和。所以Qi>Ksp是沉淀生成的条件。
3.溶度积规则的应用
可以判断体系中是否有沉淀生成或溶解,沉淀生成的必要条件,即Qi>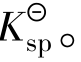
使沉淀溶解。溶解方法有以下3种:
①利用酸、碱或某些盐类(如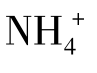 盐)与难溶电解质组分离子结合成弱电解质(如弱酸,弱碱或H2O)可以使该难溶电解质的沉淀溶解。
盐)与难溶电解质组分离子结合成弱电解质(如弱酸,弱碱或H2O)可以使该难溶电解质的沉淀溶解。
②加入一种氧化剂或还原剂,使某一离子发生氧化还原反应而降低其浓度,可以使该难溶电解质的沉淀溶解。
③在难溶电解质的溶液中加入一种配位剂,使难溶电解质的组分离子形成稳定的配离子,从而降低难溶电解质组分离子的浓度,可以使该难溶电解质的沉淀溶解。
五、配位离解平衡
1.配位化合物
由中心离子(或原子)和几个配体分子(或离子)以配位键相结合而形成的复杂分子或离子,通常称为配位单元。凡是含有配位单元的化合物都称作配位化合物,简称配合物。
2.配离子命名
①命名配离子时,配位体的名称放在前,中心离子(或中心原子)名称放在后。
②配位体和中心原子的名称之间用“合”字相连。
③中心原子为离子,在金属离子的名称之后附加带圆括号的罗马数字,以表示离子的价态。
④用中文数字在配位体名称之前表明配位数。
⑤如果配合物中有多个配位体,配位体命名的排列次序为:阴离子配位体在前,中性分子配位体在后;无机配位体在前,有机配位体在后。同类配位体中,按配位原子的元素符号在英文字母表中的次序分出先后,在前面的先命名。配位原子相同,配体中原子个数少的在前面。不同配位体的名称之间用圆点分开。
3.配位离解平衡
当配位和离解反应的速率相等时,体系所处的状态称为配位离解平衡。配离子从一个平衡状态变化到另一个平衡状态的过程称为配位平衡的移动。导致配位平衡移动的因素有:溶液酸度对配位离解平衡的影响;沉淀反应对配位离解平衡的影响;配位平衡对氧化还原反应的影响;配位平衡之间的转化。
六、酸碱质子理论
1.酸碱的概念
凡能给出质子(H+)的物质都是酸;凡能接受质子的物质都是碱。
有酸一定有碱,有碱一定有酸,酸和碱是同时存在的,我们把这样一对同时存在的酸和碱称为共轭酸碱。
2.酸碱反应
质子理论认为:酸碱反应实质是两个共轭酸碱对相互传递质子的反应。其表达式为:
3.溶液的酸碱性
质子理论认为:酸的强度决定于它给出质子的能力和溶剂分子接受质子的能力;碱的强度决定于它夺取质子的能力和溶剂分子给出质子的能力。
目标检测
一、名词解释
弱电解质;化学平衡;水的离子积;离解常数;离解度;水解常数;水解度;同离子效应;缓冲溶液;溶度积;溶度积规则
二、填空题
1.对于A+2B(g) n C(g),ΔH<0。在一定条件下达到平衡后,改变下列条件,请回答:
n C(g),ΔH<0。在一定条件下达到平衡后,改变下列条件,请回答:
(1)A量的增减,平衡不移动,则A为________态。
(2)增压,平衡不移动,当n=2时,A为________态;当n=3时,A为________态。
(3)若A为固态,增大压强,C的组分含量减少,则n ________。
(4)升温,平衡向右移动,则该反应的逆反应为________热反应。
2.将4mol SO3气体和4mol NO置于2 L容器中,一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):
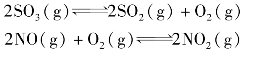
(1)当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1mol、n(NO2)=3.6mol,则此时SO3气体的物质的量为________。
(2)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和________,或NO和________(填它们的分子式)。
(3)在其他条件不变的情况下,若改为起始时在1 L容器中充入2mol NO2和2mol SO2,则上述两反应达到平衡时,c(SO2)平________mol/L。
3.甲烷蒸汽转化反应为:CH4(g)+H2O(g)ܪܒܩCO(g)+3H2(g),工业上可利用此反应生产合成氨原料气H2。
已知温度、压强和水碳比 对甲烷蒸汽转化反应的影响如下图所示:
对甲烷蒸汽转化反应的影响如下图所示:
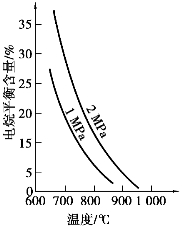
图1 水碳比为3
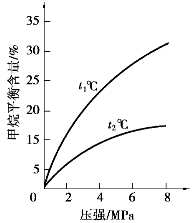
图2 水碳比为3
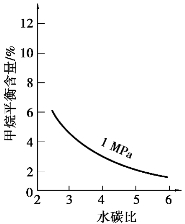
图3 800℃
(1)该反应平衡常数K表达式为________________。
(2)升高温度,平衡常数K________(选填“增大”、“减小”或“不变”,下同),降低反应的水碳比,平衡常数K________。
(3)图2中,两条曲线所示温度的关系是:t1________t2(选填>、=或<);在图3中画出压强为2 MPa时,CH4平衡含量与水碳比之间的关系曲线。
(4)工业生产中使用镍作催化剂。但要求原料中含硫量小于5×10-7%,其目的是________。
4.血液的正常pH值范围是________,若超出这个范围人就会出现不同程度的________或________。
5.难溶电解质在水中的沉淀溶解平衡和化学平衡、电离平衡一样,合乎平衡的基本特征、满足平衡的变化基本规律,其基本特征为:
(1)________________(2)________________
(3)________________(4)________________
6.在含有Cl-、Br-、I-的溶液中,已知其浓度均为0.1mol/L,而AgCl、AgBr、AgI的溶度积分别为1.6×10-10、4.1×10-15、1.5×10-16。若向混合溶液中逐滴加入AgNO3溶液时,首先析出的沉淀________是,最后析出的沉淀是________,当AgBr沉淀开始析出时,溶液中的Ag+浓度是________。
7.写出下列配合物的化学式:
(1)六氟合铝(Ⅲ)酸;________________
(2)二氯化三乙二胺合镍(Ⅱ)________________;
(3)氯化二氯·四水合铬(Ⅲ)________________;
(4)六氰合铁(Ⅱ)酸铵________________。
8.配合物Ni(CO)4中配位体是________;配位原子是________;配位数是________;命名为________。
9.配合物K3[Al(C2O4)3]的配位体是________,配位原子是________,配位数是________,命名为________。
三、判断题(对的打√,错的打×)
1.缓冲溶液就是能抵抗外来酸碱影响,保持pH绝对不变的溶液。( )
2.缓冲溶液被稀释后,溶液的pH基本不变,故缓冲容量基本不变。( )
3.混合溶液一定是缓冲溶液。( )
4.缓冲溶液的缓冲容量大小只与缓冲比有关。( )
5.缓冲溶液中,其他条件相同时,缓冲对的p Ka越接近缓冲溶液的pH时,该缓冲溶液的缓冲容量就一定越大。( )
6.HAc溶液和NaOH溶液混合可以配成缓冲溶液,条件是NaOH比HAc的物质的量适当过量。( )
7.因NH4Cl⁃NH3·H2O缓冲溶液的pH>7,所以不能抵抗少量的强碱。( )
8.由于Ksp[AgCl]>Ksp[Ag2CrO4],则AgCl的溶解度大于Ag2CrO4的溶解度。( )
9.酸碱质子理论认为不可能一种物质既是酸又是碱。( )
10.一定温度下,AgCl的饱和水溶液中,cAg+·cCl-的乘积是一个常数。( )
11.配合物由内界和外界两部分组成。( )
12.配离子的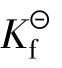 越大,该配离子的稳定性越大。( )
越大,该配离子的稳定性越大。( )
四、选择题
1.对于CH3COOC2H5+OH-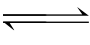 CH3COO-+C2H5OH的反应达平衡后,加入盐酸,以下说法正确的是( )。
CH3COO-+C2H5OH的反应达平衡后,加入盐酸,以下说法正确的是( )。
A.平衡正向移动 B.平衡逆向移动 C.平衡不移动 D.反应速度不变
2.在体积不变的密闭容器中发生2NO+O2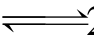 2NO2反应,并达到平衡,若升温体系的颜色变浅,则下列说法正确的是( )。
2NO2反应,并达到平衡,若升温体系的颜色变浅,则下列说法正确的是( )。
A.正反应是吸热 B.正反应是放热
C.升温后,1mol混合气的质量变大 D.升温后,气体密度变小
3.可逆反应N2+3H2 2NH3的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是( )。
2NH3的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是( )。
A.v正(N2)=v逆(NH3) B.3v正(N2)=v正(H2)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
4.下列措施不能使FeCl3+3KSCN  Fe(SCN)3+3KCl平衡发生移动的是( )。
Fe(SCN)3+3KCl平衡发生移动的是( )。
A.加少量KCl固体 B.加固体Fe2(SO4)3
C.加NaOH D.加Fe粉
5.在一定条件下,可逆反应N2+3H2 2NH3+Q达平衡。当单独改变下述条件后,有关叙述错误的是( )。
2NH3+Q达平衡。当单独改变下述条件后,有关叙述错误的是( )。
A.加催化剂,v正、v逆都发生变化,且变化的倍数相等
B.加压,v正、v逆都增大,且v正增大倍数大于v逆增大倍数
C.降温,v正、v逆都减小,且v正减小倍数小于v逆减小倍数
D.增大[N2],v正、v逆都增大,且v正增大倍数大于v逆增大倍数
6.向Cr2(SO4)3的水溶液中,加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的亚铬酸根离子。其平衡关系如下:
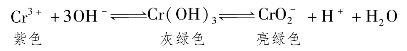
向0.05mol/L的Cr2(SO4)3溶液50mL中,加入1.0mol/L的NaOH溶液50mL,充分反应后,溶液中可观察到的现象为( )。
A.溶液为紫色 B.溶液中有灰绿色沉淀
C.溶液为亮绿色 D.无法判断
7.下列说法中正确的是( )。
A.Na2CO3水解的主要产物有CO2
B.醋酸铵溶液呈中性,是由于醋酸铵不会发生水解
C.盐的水解可视为中和反应的逆反应
D.某些盐的水溶液呈中性,这些盐一定是强酸强碱盐
8.关于盐类水解反应的说法正确的是( )。
A.溶液呈中性的盐一定是强酸强碱生成的盐
B.含有弱酸根离子的盐的水溶液一定呈碱性
C.盐溶液的酸碱性主要取决于形成盐的酸和碱的酸碱性相对强弱
D.同浓度的NH4Cl和NaCl pH之和>14
9.实验室在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀H2SO4中,再加水稀释至所需浓度,如此操作的目的是( )。
A.促进硫酸铁水解 B.抑制硫酸铁水解
C.提高溶液的pH D.提高硫酸铁的溶解度
10.在下列各组离子中,能大量共存的是( )。
A.Ag+、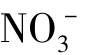 、Na+、Cl- B.K+、
、Na+、Cl- B.K+、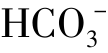 、Cl-、Al3+
、Cl-、Al3+
C.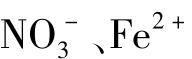 、H+、Br- D、K+、Cl-、
、H+、Br- D、K+、Cl-、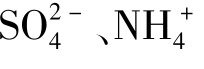
11.下列对沉淀溶解平衡的描述正确的是( )。
A.反应开始时,溶液中各离子浓度相等
B.沉淀溶解平衡达到平衡时,沉淀的速率和溶解的速率相等
C.沉淀溶解平衡达到平衡时,溶液中溶质的离子浓度相等,且保持不变
D.沉淀溶解平衡达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
12.下列说法中正确的是( )。
A.物质的溶解性为难溶,则该物质不溶于水
B.不溶于水的物质溶解度为0
C.绝对不溶解的物质是不存在的
D.某粒子被沉淀完全是指该粒子在溶液中的浓度为零
13.Mg(OH)2固体在水中达到溶解平衡:Mg(OH)2(s)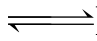 Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,需加入少量的( )。
Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,需加入少量的( )。
A.NH4NO3 B.NaOH C.MgSO4 D.NaHSO4
14.工业废水中常含Cu2+、Cd2+、Pb2+等重金属离子,可通过加入过量的难溶电解质FeS、MnS,使这些金属离子形成硫化物沉淀除去。据以上事实,可推知FeS、MnS具有的相关性质是( )。
A.在水中的溶解能力大于CuS、CdS、PbS
B.在水中的溶解能力小于CuS、CdS、PbS
C.在水中的溶解能力与CuS、CdS、PbS相同
D.二者均具有较强的吸附性
15.石灰乳中存在下列平衡:Ca(OH)2(s)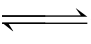 Ca2+(aq)+2OH̄(aq);加入下列溶液,可使Ca(OH)2减少的是( )。
Ca2+(aq)+2OH̄(aq);加入下列溶液,可使Ca(OH)2减少的是( )。
A.Na2CO3溶液 B.KCl溶液 C.NaOH溶液 D.CaCl2溶液
16.0.1mol/L某溶液的pH值为5.1,其溶液中的溶质可能是( )。
A.氯化氢 B.BaCl2 C.氯化铵 D.硫酸氢钠
五、简述题
1.缓冲溶液是如何发挥缓冲作用的?
2.何谓pH、pOH及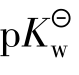 三者之间有什么关系?
三者之间有什么关系?
3.影响盐类水解的因素有哪些?增大或抑制盐类的水解作用在实际工作中有什么应用?举例说明。
4.下列盐的水溶液显酸性、碱性还是中性?说明理由,并写出有关水解方程式。
(1)硫酸铵;(2)硫化钾;(3)氯化钾;(4)碳酸氢钠。
5.将1.0mL 0.10mol/LHAc溶液稀释至100mL,则HAc的离解度增加,平衡向右移动,溶液中H+离子浓度增加。这种说法对吗?
6.锅炉水垢的主要成分为CaCO3、CaSO4、Mg(OH)2,在处理水垢时,通常先加入饱和Na2CO3溶液浸泡,然后再向处理后的水垢中加入NH4Cl溶液,请你思考:
(1)加入饱和Na2CO3溶液后,水垢的成分发生了什么变化?说明理由;
(2)NH4Cl溶液的作用是什么?请描述所发生的变化。
7.为什么医学上常用BaSO4作为内服造影剂“钡餐”,而不用BaCO3作为内服造影剂“钡餐”?
8.试用质子理论的观点,说明水解反应的实质。
9.根据酸碱质子理论,下列分子或离子哪些是酸?哪些是碱?哪些既是酸又是碱?
HS-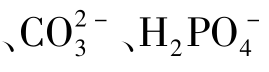 、NH3、H2S、HCl、Ac-、OH-、H2O
、NH3、H2S、HCl、Ac-、OH-、H2O
10.为什么某酸越强,则其共轭碱越弱,或某酸越弱,其共轭碱越强?共轭酸碱对的Ka与Kb之间有何定量关系?
六、计算题
1.已知在室温下,醋酸的电离度为2%,其电离平衡常数为Ka=1.75×10-5。试计算醋酸的物质的量浓度。
2.若欲使氨水溶液中氢氧根离子浓度为1.5×10-3mol/L,氨水浓度应该为多少?
3.某弱碱MOH的摩尔质量为125g/mol,在25℃时取0.5g溶于50mL水中所得溶液的pH为11.3,试计算MOH的电离平衡常数。
4.计算下列各溶液的pH:
(1)0.010mol/L HCl溶液;
(2)0.010mol/L HCN溶液;
(3)0.010mol/L NaOH溶液;
(4)0.010mol/L NH3·H2O溶液;
5.欲使100mL纯水的pH由7变为4,计算需0.1mol/L HCl溶液多少?
6.以pH为0.7的HCl溶液和pH为13.6的NaOH溶液制备100mL pH为12的溶液,问每种溶液各需要多少mL?
7.现有NH3和NH4Cl组成的缓冲溶液,试计算:
(1)若cNH3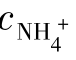 =4.5,该缓冲溶液的pH等于多少?
=4.5,该缓冲溶液的pH等于多少?
(2)当该缓冲溶液的pH=9.00时,cNH3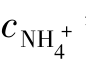 等于多少?
等于多少?
8.若配置500mL pH=9且含铵离子浓度为1mol/L的缓冲溶液,需密度为0.904g/cm3、含氨26%的浓氨水多少毫升和固体NH4Cl多少克?
9.设溶液中Cl-和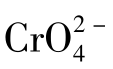 的浓度均为0.01mol/L,当慢慢滴加AgNO3溶液时,问AgCl和Ag2CrO4哪个先沉淀?当Ag2CrO4沉淀时,溶液中的Cl-浓度是多少?
的浓度均为0.01mol/L,当慢慢滴加AgNO3溶液时,问AgCl和Ag2CrO4哪个先沉淀?当Ag2CrO4沉淀时,溶液中的Cl-浓度是多少?
10.50mL含Ba2+离子浓度为0.01mol/L的溶液与30mL浓度为0.02mol/L的Na2SO4混合。
(1)是否会产生BaSO4沉淀?
(2)反应后溶液中的Ba2+浓度为多少?
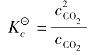
 CO
CO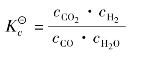
 CO
CO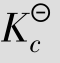 =1.0,若CO的起始浓度为2mol/L,H
=1.0,若CO的起始浓度为2mol/L,H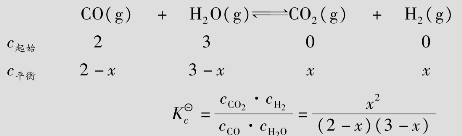
 2HI(g)的标准平衡常数为49.5,已知0.200mol的H
2HI(g)的标准平衡常数为49.5,已知0.200mol的H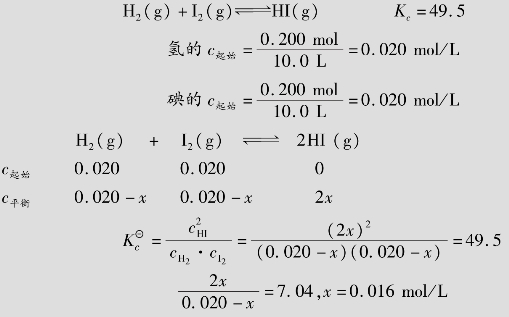
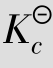 。
。
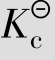 等于1.64。
等于1.64。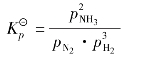
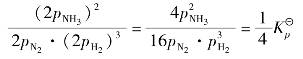
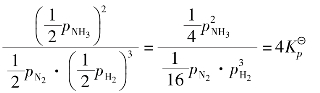
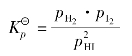

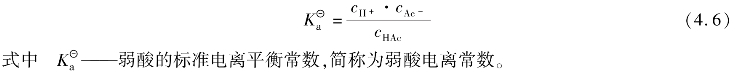
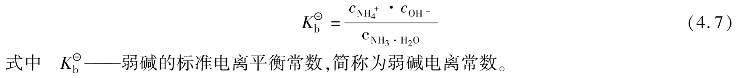
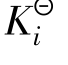 表示,它包括弱酸电离常数
表示,它包括弱酸电离常数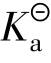 、弱碱电离常数
、弱碱电离常数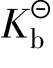 ,与一般的平衡常数一样,在一定温度下,对于给定的弱电解质稀溶液而言,它是一个常数。也就是说,
,与一般的平衡常数一样,在一定温度下,对于给定的弱电解质稀溶液而言,它是一个常数。也就是说,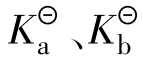 与温度有关而与浓度无关。电离常数能表示弱酸、弱碱电离的趋势,其值越大表示电离的趋势越大。
与温度有关而与浓度无关。电离常数能表示弱酸、弱碱电离的趋势,其值越大表示电离的趋势越大。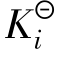 都能表示弱酸(或弱碱)离解能力的大小。
都能表示弱酸(或弱碱)离解能力的大小。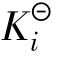 是平衡常数的一种形式,只与温度有关,不随浓度而变化;离解度是转化率的一种形式,其大小除与弱酸(或弱碱)的本性有关外,还与溶液的浓度、温度等因素有关。离解度和电离常数之间是相互联系的,下面以弱酸HAc的电离平衡为例进行说明:
是平衡常数的一种形式,只与温度有关,不随浓度而变化;离解度是转化率的一种形式,其大小除与弱酸(或弱碱)的本性有关外,还与溶液的浓度、温度等因素有关。离解度和电离常数之间是相互联系的,下面以弱酸HAc的电离平衡为例进行说明: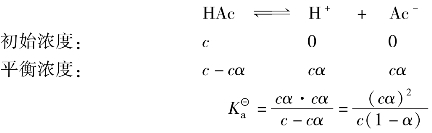
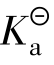 ≈cα
≈cα

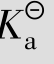 =1.75×10
=1.75×10
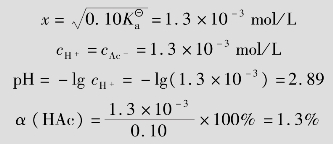
 H
H
 H
H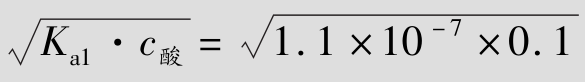 =1.05×10
=1.05×10 H
H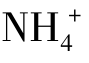 离子浓度的增大平衡向生成NH
离子浓度的增大平衡向生成NH
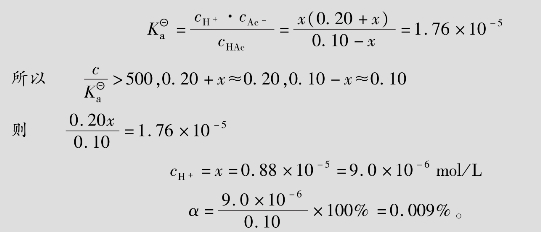
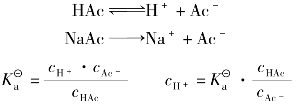
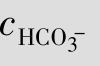 =2.5×10
=2.5×10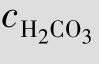 =2.5×10
=2.5×10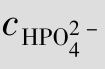 =2.4×10
=2.4×10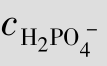 =1.5×10
=1.5×10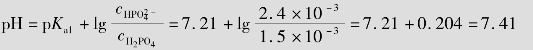
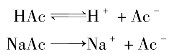
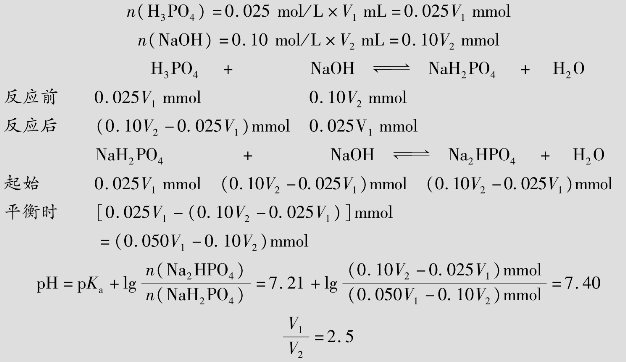

 HAc+NaOH
HAc+NaOH HAc+OH
HAc+OH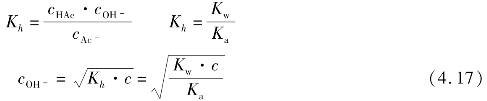

 NH
NH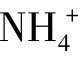 +H
+H NH
NH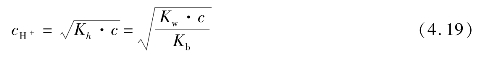

 NH
NH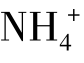 +Ac
+Ac NH
NH
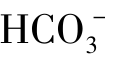 +H
+H H
H

 ”,而是用“
”,而是用“ ”。盐类的水解程度一般都很小,通常不会生成沉淀和气体,因此盐类水解的离子方程式中一般不标“↓”或“↑”的气标,也不把生成物(如NH
”。盐类的水解程度一般都很小,通常不会生成沉淀和气体,因此盐类水解的离子方程式中一般不标“↓”或“↑”的气标,也不把生成物(如NH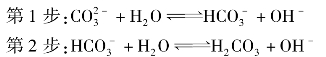
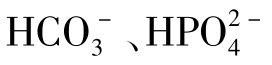 在溶液中以水解为主,其溶液显碱性;
在溶液中以水解为主,其溶液显碱性;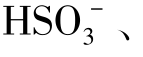
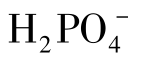 在溶液中以电离为主,其溶液显酸性。
在溶液中以电离为主,其溶液显酸性。 ”连接,如NaHCO
”连接,如NaHCO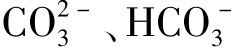 、S
、S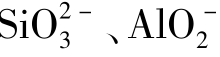 ;Fe
;Fe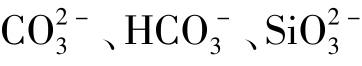 、
、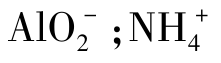 与
与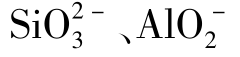 等。
等。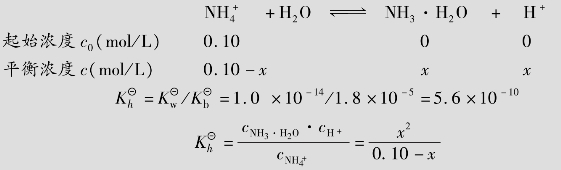
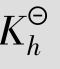 很小,可作近似计算0.10-x≈0.10
很小,可作近似计算0.10-x≈0.10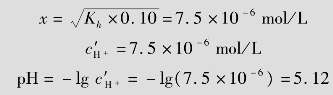
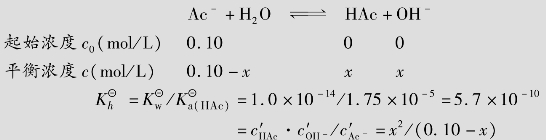
 很小,可作近似计算0.10-x≈0.10,所以
很小,可作近似计算0.10-x≈0.10,所以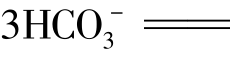 Al(OH)
Al(OH)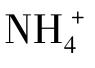 反应。
反应。 Ag
Ag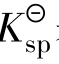 表示。
表示。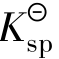 =c
=c m A
m A 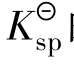 的大小反映了难溶电解质溶解能力。当化学式所表示的组成中阴、阳离子个数比相同时,
的大小反映了难溶电解质溶解能力。当化学式所表示的组成中阴、阳离子个数比相同时,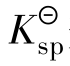 数值越大的难溶电解质在水中的溶解能力越强。
数值越大的难溶电解质在水中的溶解能力越强。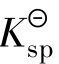 的大小与温度有关,而与难溶电解质的质量无关。
的大小与温度有关,而与难溶电解质的质量无关。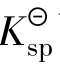 可以比较同种类型难溶电解质的溶解度的大小,不同类型的难溶电解质溶解度的大小不能用
可以比较同种类型难溶电解质的溶解度的大小,不同类型的难溶电解质溶解度的大小不能用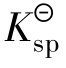 比较。
比较。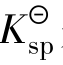 是从不同侧面描述物质的溶解性,尽管二者之间有根本的区别,但也有必然的数量关系。在溶度积的计算中,离子浓度必须是物质的量浓度,其单位是mol/L,而溶解度的单位往往是g/100g水。因此,计算时常常要先将难溶电解质的溶解度S的单位换算成mol/L的浓度单位。
是从不同侧面描述物质的溶解性,尽管二者之间有根本的区别,但也有必然的数量关系。在溶度积的计算中,离子浓度必须是物质的量浓度,其单位是mol/L,而溶解度的单位往往是g/100g水。因此,计算时常常要先将难溶电解质的溶解度S的单位换算成mol/L的浓度单位。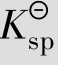 =8.7×10
=8.7×10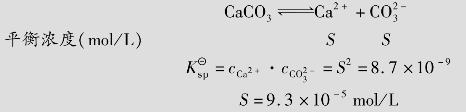
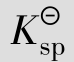 与S之间存在数量关系,是由于某些离子的浓度与S有关,例如在本例中c
与S之间存在数量关系,是由于某些离子的浓度与S有关,例如在本例中c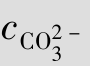 均等于S。
均等于S。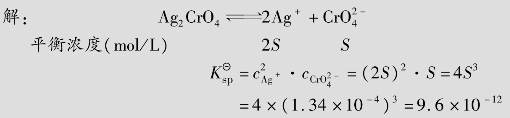
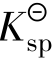 大的S也大。不同类型的难溶电解质不能直接用溶度积比较其溶解度相对大小。
大的S也大。不同类型的难溶电解质不能直接用溶度积比较其溶解度相对大小。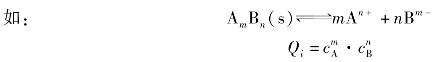
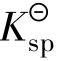 的表达式完全一样,但Q
的表达式完全一样,但Q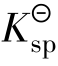 仅表示达到沉淀溶解平衡时有关离子浓度方次的乘积,二者有本质区别。在任何给定的难溶电解质的溶液中,Q
仅表示达到沉淀溶解平衡时有关离子浓度方次的乘积,二者有本质区别。在任何给定的难溶电解质的溶液中,Q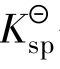 作比较有3种情况:
作比较有3种情况: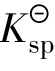 时,为不饱和溶液,无沉淀析出。若体系中有固体存在,固体将溶解直至饱和为止。所以Q
时,为不饱和溶液,无沉淀析出。若体系中有固体存在,固体将溶解直至饱和为止。所以Q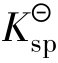 是沉淀溶解的条件。
是沉淀溶解的条件。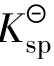 时,是饱和溶液,处于动态平衡状态。
时,是饱和溶液,处于动态平衡状态。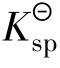 时,为过饱和溶液,有沉淀析出,直至饱和。
时,为过饱和溶液,有沉淀析出,直至饱和。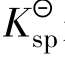 是沉淀生成的条件。
是沉淀生成的条件。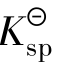 。
。
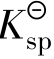 ,只要采取一定的措施,降低难溶电解质沉淀溶解平衡系统中有关离子的浓度,就可以使沉淀溶解。溶解方法有以下几种:
,只要采取一定的措施,降低难溶电解质沉淀溶解平衡系统中有关离子的浓度,就可以使沉淀溶解。溶解方法有以下几种: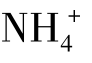 盐)与难溶电解质组分离子结合成弱电解质(如弱酸,弱碱或H
盐)与难溶电解质组分离子结合成弱电解质(如弱酸,弱碱或H
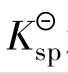 越大,
越大,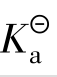 值越小,其反应越容易进行。
值越小,其反应越容易进行。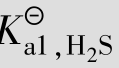 =9.1×10
=9.1×10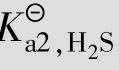 =1.1×10
=1.1×10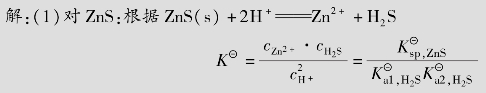
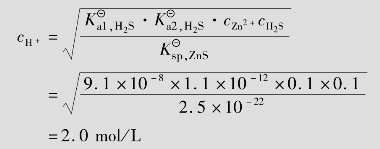
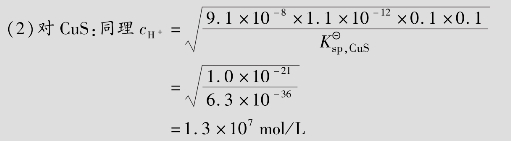
 。所以AgCl沉淀溶解了。
。所以AgCl沉淀溶解了。 的溶液中,滴加AgNO
的溶液中,滴加AgNO =
=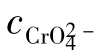 =0.010mol/L,逐滴加入AgNO
=0.010mol/L,逐滴加入AgNO
 小的先沉淀,溶度积差别越大,后沉淀离子的浓度越小,分离效果就越好。
小的先沉淀,溶度积差别越大,后沉淀离子的浓度越小,分离效果就越好。 及沉淀类型有关。沉淀类型相同,被沉淀离子浓度相同,
及沉淀类型有关。沉淀类型相同,被沉淀离子浓度相同,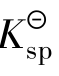 小者先沉淀,
小者先沉淀,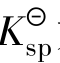 大者后沉淀;沉淀类型不同,要通过计算确定。二是与被沉淀离子浓度有关。
大者后沉淀;沉淀类型不同,要通过计算确定。二是与被沉淀离子浓度有关。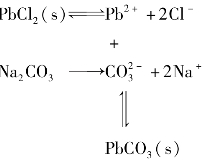
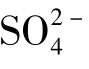 是配合物的外界,如图4.3所示。
是配合物的外界,如图4.3所示。

 Cu
Cu 数(不稳定常数)
数(不稳定常数)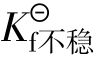 与稳定常数
与稳定常数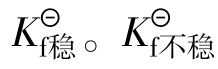 越大配离子越不稳定,
越大配离子越不稳定,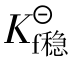 越大配离子越稳定。与
越大配离子越稳定。与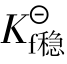 的关系:
的关系: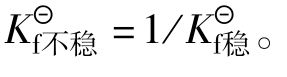
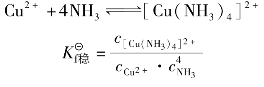
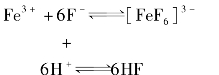
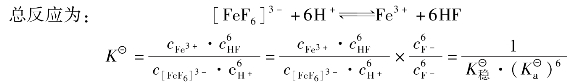
 越大或沉淀的
越大或沉淀的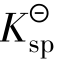 越大,则沉淀越容易被配位反应溶解。
越大,则沉淀越容易被配位反应溶解。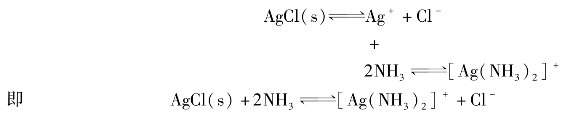
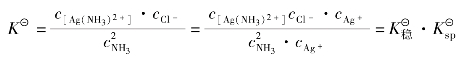
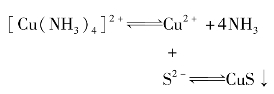
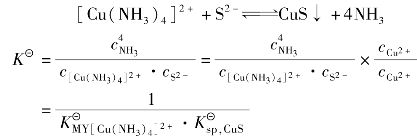
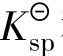 和配合物
和配合物 的值。同时,还取决于所加的配位剂和沉淀剂的用量。
的值。同时,还取决于所加的配位剂和沉淀剂的用量。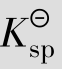 =1.8×10
=1.8×10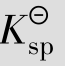 =5.0×10
=5.0×10 =1.12×10
=1.12×10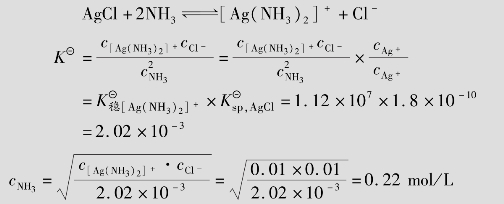
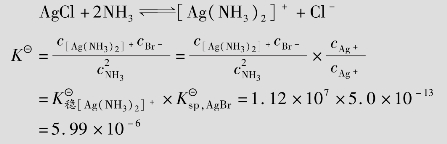
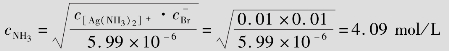
 相差较大,导致溶解需要的氨水的浓度有很大的差别。
相差较大,导致溶解需要的氨水的浓度有很大的差别。 =1.0×10
=1.0×10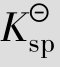 =8.3×10
=8.3×10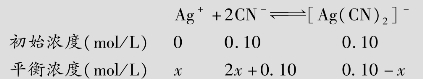
 表达式得
表达式得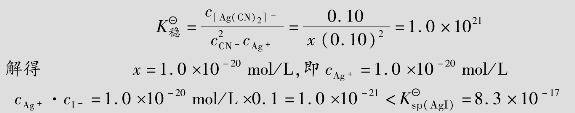
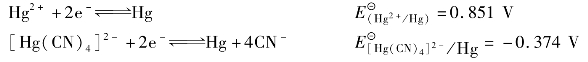
 Ag+2NH
Ag+2NH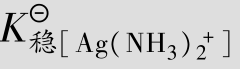 =1.12×10
=1.12×10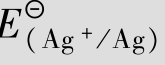 =0.799 V
=0.799 V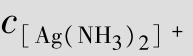 =
=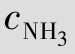 =1mol/L,所以
=1mol/L,所以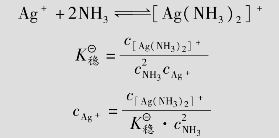
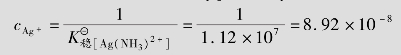
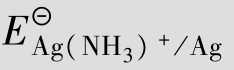
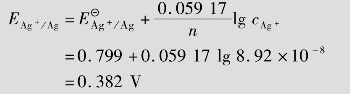
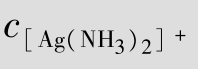 =
=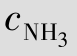 =1
=1 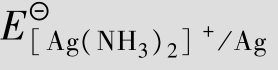 mol/L时,
mol/L时,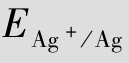 就是电极反应[Ag(NH
就是电极反应[Ag(NH Ag+2NH
Ag+2NH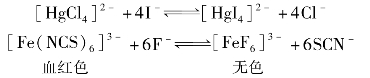
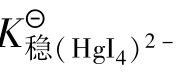 >
>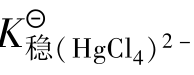 ;
;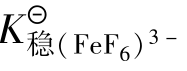 >
>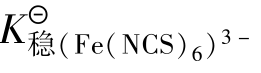 。
。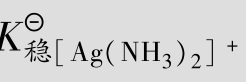 =1.12×10
=1.12×10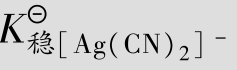 =1.0×10
=1.0×10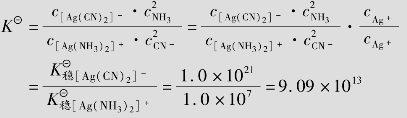
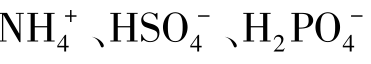 都是酸,因为它们能给出质子;Cl
都是酸,因为它们能给出质子;Cl 、NaOH等都是碱,因为他们能接受质子。质子理论中,酸和碱不仅可以是分子,还可以是正、负离子。
、NaOH等都是碱,因为他们能接受质子。质子理论中,酸和碱不仅可以是分子,还可以是正、负离子。
 。两性物质是酸还是碱,决定于具体的反应。如:水给出质子时是酸;水接受质子生成H
。两性物质是酸还是碱,决定于具体的反应。如:水给出质子时是酸;水接受质子生成H

 。酸碱反应的方向总是从强酸强碱向弱酸弱碱方向进行。即:强碱夺取强酸放出的质子,转化成较弱的共轭酸和共轭碱。
。酸碱反应的方向总是从强酸强碱向弱酸弱碱方向进行。即:强碱夺取强酸放出的质子,转化成较弱的共轭酸和共轭碱。
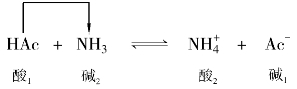

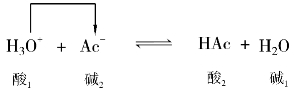
 HB+A
HB+A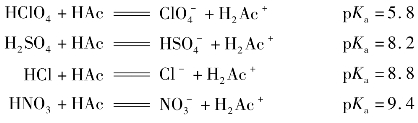
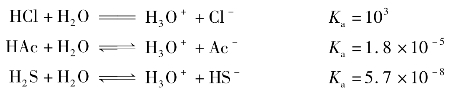
 m M+n N
m M+n N
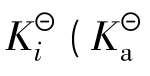 表示酸的标准电离平衡常数,
表示酸的标准电离平衡常数,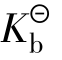 表示碱的标准电离平衡常数)表示。
表示碱的标准电离平衡常数)表示。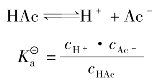
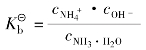
 ≈cα
≈cα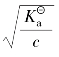
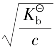

 ”表示;多元弱酸的酸根离子水解是分步进行的;多元弱酸的酸式酸根离子既有水解倾向又有电离倾向;能发生双水解的离子组,一般来说水解都比较彻底。
”表示;多元弱酸的酸根离子水解是分步进行的;多元弱酸的酸式酸根离子既有水解倾向又有电离倾向;能发生双水解的离子组,一般来说水解都比较彻底。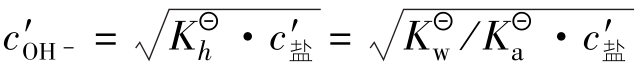
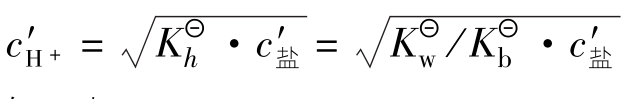
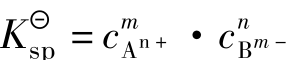
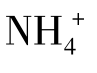 盐)与难溶电解质组分离子结合成弱电解质(如弱酸,弱碱或H
盐)与难溶电解质组分离子结合成弱电解质(如弱酸,弱碱或H

 n C(g),ΔH<0。在一定条件下达到平衡后,改变下列条件,请回答:
n C(g),ΔH<0。在一定条件下达到平衡后,改变下列条件,请回答: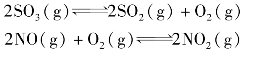



 越大,该配离子的稳定性越大。( )
越大,该配离子的稳定性越大。( ) CH
CH 2NO
2NO 2NH
2NH Fe(SCN)
Fe(SCN) 2NH
2NH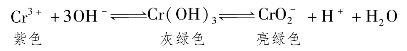
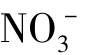 、Na
、Na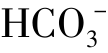 、Cl
、Cl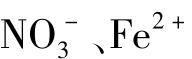 、H
、H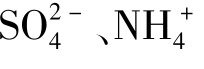
 Mg
Mg Ca
Ca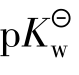 三者之间有什么关系?
三者之间有什么关系?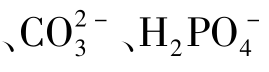 、NH
、NH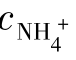 =4.5,该缓冲溶液的pH等于多少?
=4.5,该缓冲溶液的pH等于多少?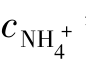 等于多少?
等于多少?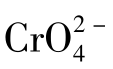 的浓度均为0.01mol/L,当慢慢滴加AgNO
的浓度均为0.01mol/L,当慢慢滴加AgNO