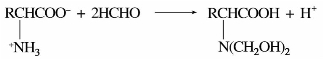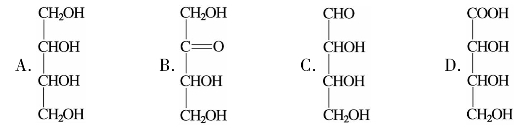(2)还原反应
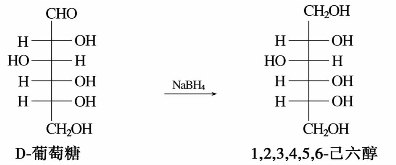
硼氢化钠还原或催化加氢都可把糖分子中的羰基还原成羟基,生成相应的糖醇。例如葡萄糖还原生成山梨醇。
(3)成脎反应
单糖与苯肼作用时,其羰基与苯肼反应首先生成苯腙。但在过量的苯腙存在下,α-碳原子上羟基被苯肼氧化变成羰基,苯肼则被还原为氨及苯胺,新的羰基再继续与苯肼反应生成的产物称为糖脎。
以葡萄糖为例其反应过程如下:
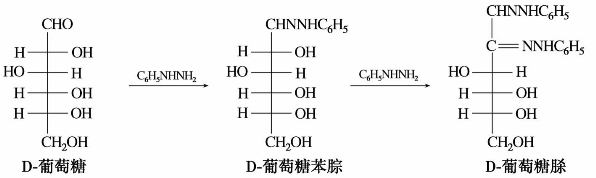
由糖生成的糖脎引入了两个苯肼基,相对分子质量增大,水溶性则大为降低,因此在糖溶液中加入苯肼,加热即可析出糖脎。成脎反应常用于糖的定性鉴别。
3)重要的单糖
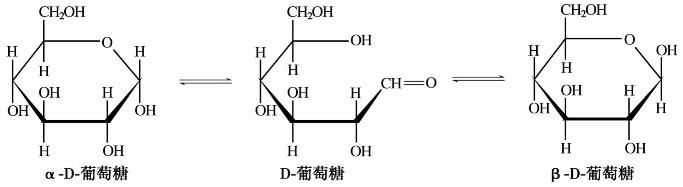
(1)葡萄糖
葡萄糖是无色或白色结晶粉末,熔点146℃。天然葡萄糖是D型右旋糖,在自然界中分布很广。在溶液中,葡萄糖可以3种不同的形式存在,当3种形式达到动态平衡时,溶液的比旋光度为+52.7°。
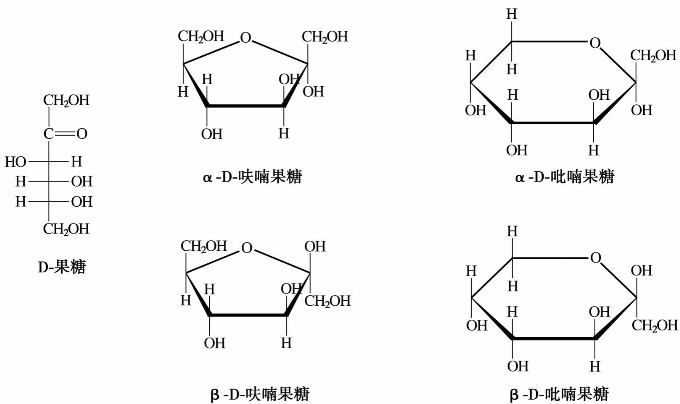
(2)果糖
果糖是白色晶体或结晶粉末,熔点102~104℃(分解)。天然果糖是左旋的,故也称左旋糖。D-果糖结构式如下:
果糖中的酮羰基不但可以与C6上的羟基形成吡喃型六元环,还可以与C5上的羟基形成呋喃型六元环。其哈沃斯式结构为:
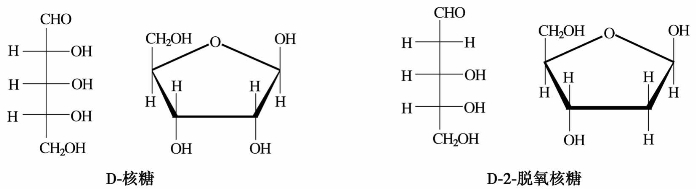
(3)核糖
天然的核糖是结晶固体,熔点87℃。它是一种重要的戊糖,其结构为D型,故叫D-核糖。它的C-2上去掉氧后叫D-2-脱氧核糖。它们都是核酸的重要组成部分,在细胞中起遗传作用。D-核糖与D-2-脱氧核糖结构如下:
练习11.1
用化学方法鉴别葡萄糖、果糖。
11.1.3 低聚糖
常见的低聚糖有麦芽糖、蔗糖、乳糖、纤维二糖,此外,还有淀粉经环糊精糖基转化酶水解得到环糊精。
1)双糖
双糖是由两分子单糖通过苷键连接而成的化合物。主要的双糖有蔗糖、麦芽糖、乳糖和纤维二糖等,它们的分子式为C12H22O11,可以看做是由两分子单糖脱水形成的化合物,能被水解为两分子单糖。自然界中存在的双糖可分为还原性双糖与非还原性双糖两类。
(1)还原性双糖
比较重要的还原性双糖有麦芽糖、纤维二糖和乳糖。还原性双糖不仅具有一般单糖的性质,能还原托伦试剂、斐林试剂等弱氧化剂,而且能与苯肼成脎,因此这类双糖就叫作还原性双糖。
①麦芽糖。麦芽糖为白色的晶体,分子式为C12H22O11,熔点是165℃,易溶于水,麦芽糖水溶液的比旋光度为+137°,其甜味要次于蔗糖。麦芽糖在水溶液中是由α-麦芽糖与β-麦芽糖互变平衡。
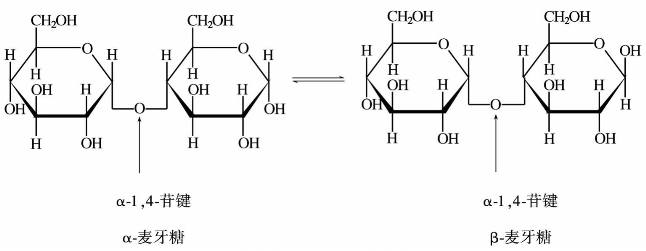
淀粉可部分水解成麦芽糖。麦芽糖用无机酸水解得到两分子D-葡萄糖,说明它是由两分子葡萄糖缩水而成。
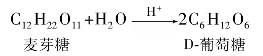
麦芽糖有变旋光现象,能生成脎和腙,能还原托伦试剂、斐林试剂等弱氧化剂,所以麦芽糖为还原性双糖,与溴水反应生成麦芽糖酸。饴糖的主要成分就是麦芽糖。
②乳糖。乳糖因存在于人和哺乳动物的乳汁中而得名。乳糖为白色结晶粉末,分子式为C12H22O11,甜度约为蔗糖的70%,难溶于水,不吸湿,在水溶液中,α-和β-异构达到平衡时,比旋光度为+55.3°。
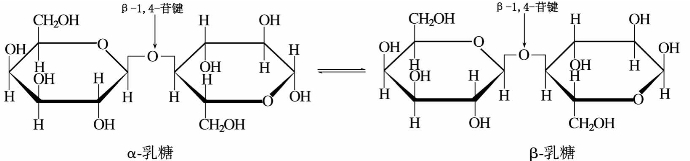
乳糖用酸水解,得一分子D-葡萄糖和一分子D-半乳糖。
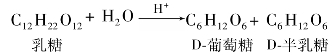
③纤维二糖。纤维二糖分子式为C12H22O11,无色晶体,熔点225℃,是右旋糖,可溶于水。纤维二糖是纤维素的基本组成单元,可通过纤维素部分水解得到。纤维二糖结构式如下所示:
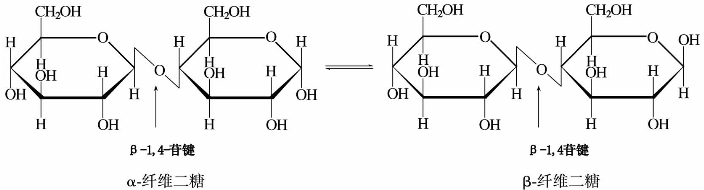
纤维二糖也是还原性双糖,用溴水氧化并进行甲基化则生成纤维二糖酸。纤维二糖水解得到两分子D-葡萄糖。
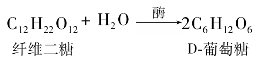
(2)非还原性双糖
非还原性双糖相当于由两个单糖的半缩醛羟基脱水而成的,两个单糖都成为苷,这样形成的双糖就不具有与单糖相似的性质,不能还原托伦试剂、斐林试剂等弱氧化剂,不能与苯肼成脎。
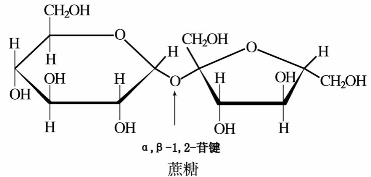
蔗糖分子式为C12H22O11,无色晶体,熔点180℃,易溶于水。蔗糖是右旋糖,其水溶液的比旋光度为+66.5°,将蔗糖水解后得到等量的D-葡萄糖和D-果糖的混合物,由于D-葡萄糖的比旋光度为+52.5°,而D-果糖的比旋光度为-92°,故水解混合物的旋光方向为左旋,所以常将蔗糖的水解产物叫做转化糖。蔗糖结构式如下所示:
2)环糊精
淀粉经环糊精糖基转化酶水解得到一种环状低聚糖称为环糊精。一般情况下,环糊精由6~8个葡萄糖单元结合成环。根据成环葡萄糖单元分别称α-、β-、γ-环糊精。以α-环糊精为例,其结构和形状如图11.1所示。
环糊精为晶体,具有旋光性。各种环糊精对碘呈现不同的颜色,α-环糊精呈青色,β-环糊精呈黄色,γ-环糊精呈紫褐色。环糊精由于分子中没有半缩醛羟基,故无还原性。同时对酸和普通淀粉酶也比较稳定。环糊精中间的空穴可选择性地和一些有机化合物形成包合物。由于环糊精具有极性的外侧和非极性的内侧,它可以包含非极性分子,而形成的包合物却能溶于极性溶剂中,因此可作为相转移催化剂使用。另外,它常用于立体选择合成以及仿生合成、分离和医药工业中。它最重要的用途是作为研究酶作用的模型。
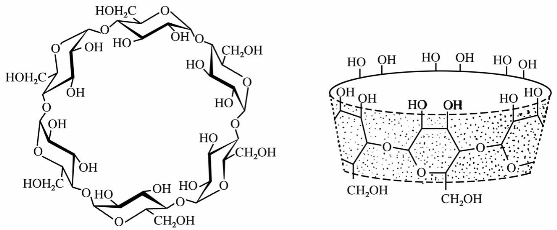
图11.1 α-环糊精的结构和形状
练习11.2
1.举例说明哪些是还原性糖,哪些是非还原性糖?
2.查阅资料,寻找其他的多聚糖及其用途。
11.1.4 多糖
多糖是由许多相同或不相同的单糖分子结合而成的天然高分子化合物,它是一种聚合程度不同的长链分子混合物。植物贮藏的养分——淀粉,动物贮藏的养分——糖原及植物的骨架结构——纤维素等都由葡萄糖单元组成,由同种单糖组成的多糖,称为均多糖;由不同种单糖及其衍生物组成的多糖,称为杂多糖。
均多糖和杂多糖组分只有糖类,称为单纯多糖;若组分中除糖类外,还含有其他组分如蛋白质、脂类等,则称为复合多糖。
1)淀粉
淀粉是绿色植物光合作用的产物,在体内再通过淀粉酶及其他一系列酶的作用,经过复杂的过程,最后变为二氧化碳和水,释放出能量,供给生命活动的需要。
(1)淀粉的物理性质
淀粉为白色无定形粉末,由直链淀粉与支链淀粉两部分组成,在结构与性质上有一定区别。
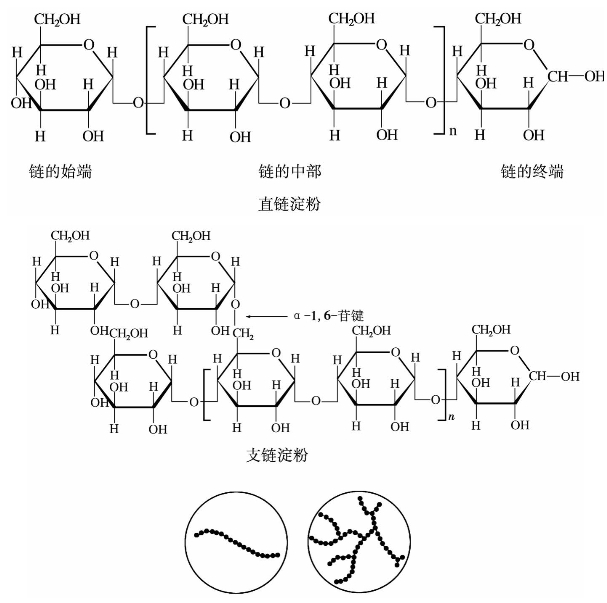
图11.2 直链和支链淀粉的结构示意图
淀粉相对密度约为1.5,一般不溶于有机溶剂及冷水。淀粉在水中加热至60~80℃,其颗粒膨胀并产生悬浮液,当浓度增大时,可以变成黏稠的糊状液,使不透明的淀粉悬浮液变为透明的具有一定黏度的浆液,这种现象称为糊化。淀粉突然膨胀的温度为糊化温度,又称糊化开始温度。
(2)淀粉的化学性质
淀粉没有还原性。淀粉中的羟基能发生成醚、成酯、氧化等反应。淀粉也能发生水解反应,最终生成葡萄糖。由于淀粉的特殊结构,淀粉可以和碘等发生络合反应。
①水解反应。淀粉对碱的作用较稳定,但在酸或酶的催化下,彻底水解时生成D-葡萄糖,用淀粉酶水解得到麦芽糖,所以可以将淀粉看做是麦芽糖的聚合物。
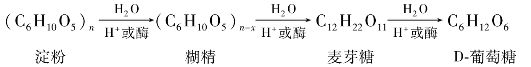
水解的中间产物糊精按其水解程度不同可分为:
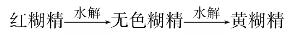
其中相对分子质量稍大的,遇碘呈红色的称红糊精;相对分子质量较小的,遇碘不发生颜色变化的称无色糊精。无色糊精有还原性,溶于水并具有粘性,因此,可做粘合剂及纸张上胶和布匹上浆。
②与碘的络合。淀粉与碘能发生很灵敏的颜色反应。经常用这种特性鉴别碘的存在。淀粉遇碘后变色,是由于淀粉螺旋链中的空隙恰好可以装入碘的分子形成一个络合物,如图11.3所示。络合物的颜色随淀粉的组成、聚合度的不同而异。直链淀粉碘的络合物呈紫蓝色,而支链淀粉呈紫红色。
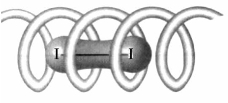
图11.3 直链淀粉与碘形成络合物
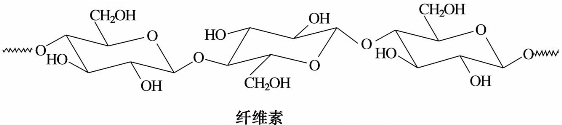
2)纤维素
纤维素是植物细胞壁的主要组分,也是自然界分布最广的多糖。棉花是含纤维素最高的物质,含量可达98%,其次是亚麻和木材。木材含纤维素50%~70%,此外动物体内发现有动物纤维素。
(1)纤维素的物理性质
纤维素和直链淀粉一样,是没有分支的链状分子,并且将几条这样的分子长链并排成索,通过大量邻近的羟基形成氢键,相互聚集,像绳索一样拧在一起而成纤维素。
纤维素为白色固体,无色、无臭,不溶于水和一般有机溶剂,因其分子内含有大量的羟基,具有一定的吸湿性,韧性强,不具有还原性。其分子式也为(C6H10O5)n。纤维素的分子量比淀粉的分子量大得多,其葡萄糖单位为500~5 000。
(2)纤维素的化学性质
纤维素不溶于稀酸和稀碱中,但能溶于二硫化碳和氢氧化钠溶液中,纤维素较难水解,但在高温、高压下与无机酸共热,能被水解成葡萄糖。
①纤维素与碱作用。纤维素可溶于氢氧化铜的氨溶液中,加酸后又重新沉淀出来。如果将这种溶液从一个细孔挤压到稀酸中,纤维素就形成细丝,称为铜氨人造细丝。若在常温下用15%左右的氢氧化钠处理棉纤维,则其长度缩短而直径加大,出现溶胀现象,经拉紧和水洗后,纤维光泽增强,且易染色,这种处理方法称为丝光处理。
②纤维素的水解反应。纤维素的水解比淀粉困难得多。在人体和大多数高等动物体内,不存在水解纤维素的酶,故纤维素不能被水解。但纤维素可以被寄生在食草的反刍动物消化道中的微生物所分泌的纤维素酶所水解,因此反刍动物如牛、羊等能以纤维素为食物。在酸性环境中,一般要在高温、高压较浓的酸存在下,才可水解生成纤维四糖、纤维三糖和纤维二糖,最终产物为葡萄糖。
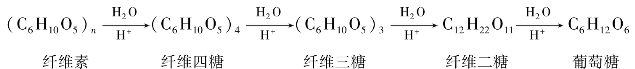
③纤维素酯的生成。纤维素酯化是将纤维素中含有的羟基,与一些试剂作用,生成纤维素酯,纤维素酯用途较广。
常用的纤维素酯有以下3种:
a.硝酸纤维素酯也称纤维素硝酸酯,由纤维素与浓硝酸作用而得。若纤维素分子中绝大部分的羟基都被酯化,则得到三硝酸纤维素酯。
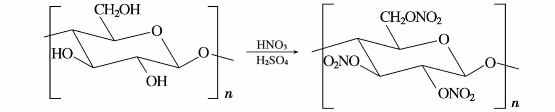
b.醋酸纤维素酯也称纤维素醋酸酯。纤维素在少量硫酸中与乙酸酐和乙酸的混合物作用而得到的。
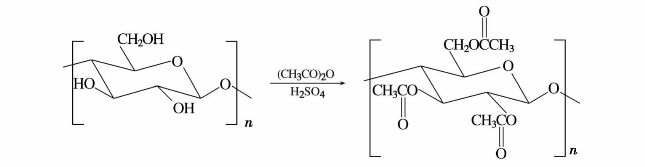
c.纤维素黄原酸酯黄原酸酯是二硫代碳酸的酸式酯,不稳定,在常温下分解成醇和二硫化碳。其钠盐比较稳定,是由醇钠和二硫化碳或有醇、二硫化碳和氢氧化钠作用而得。
练习11.3
1.比较淀粉和纤维素水解的难易程度?水解的最终产物是什么?
2.如何用化学方法区别麦芽糖、淀粉和纤维素?
任务11.2 脂类化合物
11.2.1 油脂
油脂存在于动植物体内,是生物体内维持正常生命活动不可缺少的物质。
1)油脂的组成
油脂的主要成分是含偶数碳原子的直链高级脂肪酸的甘油酯,其构造式如下:
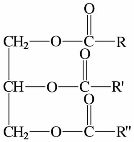
如果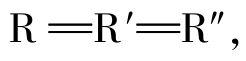 ,称为单纯甘油酯,而R≠R′≠R″,则称为混合甘油酯,天然的油脂大多为混合的甘油酯。
,称为单纯甘油酯,而R≠R′≠R″,则称为混合甘油酯,天然的油脂大多为混合的甘油酯。
一些重要的油脂及其组成它们的重要脂肪酸见表11.1及表11.2。其中,不饱和脂肪酸中的双键一般都是顺式构型的,含有反式构型的双键极少,桐油分子中的桐油酸则是反式构型的双键。
表11.1 一些重要的油脂
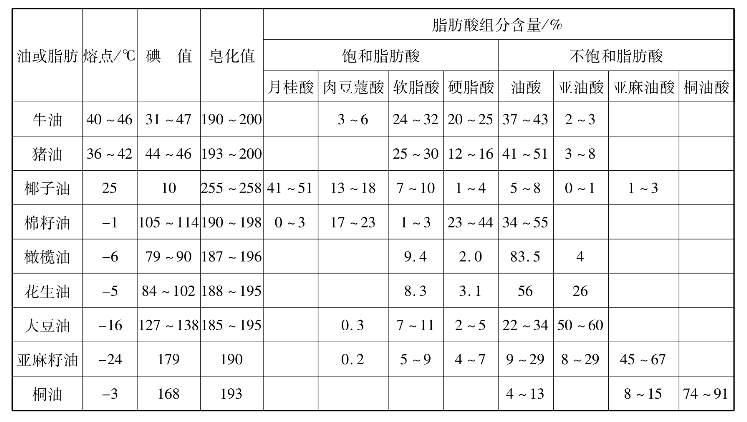
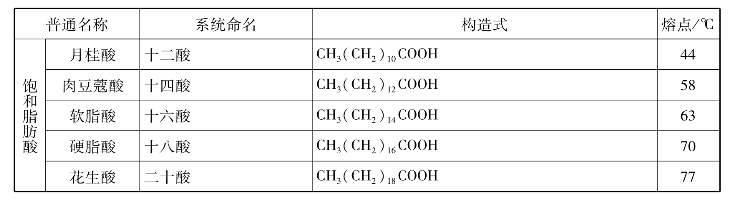
表11.2 一些重要的高级脂肪酸
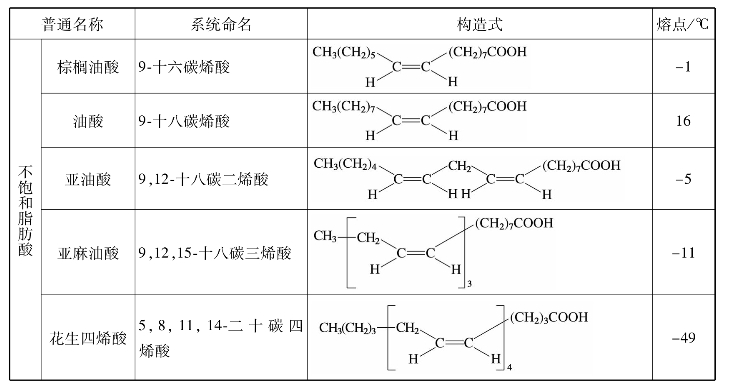
续表
2)油脂的物理性质
植物油中含丰富的不饱和脂肪酸,一般在室温是液体的称为油;含丰富的饱和脂肪酸的动物油脂室温下呈固体或半固体,则称为脂肪。由于天然油脂都是混合物,故熔点范围较大,油脂的熔点随烃链中碳原子数的增加而升高,随烃链的不饱和程度增加而降低。一些重要油脂的熔点见表11.1。油脂比水轻,相对密度0.9~0.95,不溶于水而溶于烃类、丙酮、氯仿和四氯化碳等有机溶剂。
3)油脂的化学性质
油脂属于酯类,除具有酯的性质外,其中的不饱和双键还具有烯的性质。
(1)氧化反应
油脂在空气及细菌作用下,易氧化、水解而生成相对分子质量较低的羧酸。
游离脂肪酸的含量可用KOH中和来测定。中和1 g油脂所需KOH的质量(单位mg)称为酸值。酸值是游离脂肪酸的度量标准。
(2)加成反应
脂肪中含有不饱和脂肪酸可发生加成反应。
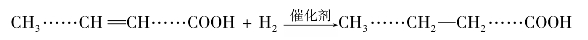
油脂中的不饱和脂肪酸,一般在200℃,0.1~0.3 MPa下,催化氢化后转变为饱和程度较高的固体或半固体的脂肪——氢化油又称硬化油。
油脂的不饱和程度常以碘值表示。100 g油脂与碘加成所需碘的质量(单位g)称为碘值。碘值越大,油脂的不饱和程度越大。
(3)水解和皂化值
油脂在酸催化下与水共沸,则水解生成高级脂肪酸和甘油。这是工业上制取高级脂肪酸和甘油的重要方法。
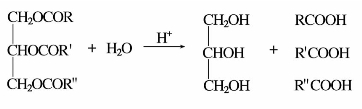
油脂和氢氧化钠溶液共沸,水解生成高级脂肪酸钠(即肥皂)和甘油。因此,油脂的碱性水解又叫皂化反应。工业上1 g油脂皂化时所需KOH的质量(单位mg)称为皂化值。
④干化。含有共轭双键脂肪酸的油脂,具有一个特殊的性质,当把它刷在一个平面和空气接触时,就逐渐变成为一层干硬而有弹性的薄膜。油的这种结膜特性称为油的干化。
练习11.4
1.写出下列脂肪酸的结构简式。
软脂酸、硬脂酸、油酸、亚油酸
2.什么是油脂皂化值、酸值?
11.2.2 类脂
类脂是与油脂在结构上或性质上相类似的化合物。较常见的类脂有磷脂,其中,较重要的磷脂是卵磷脂、脑磷脂和神经磷脂。
1)卵磷脂和脑磷脂
天然卵磷脂为α-卵磷脂,是最典型且分布最广的天然磷脂,存在于动物体及微生物体中,对生物的生长发育具有重要的作用。
卵磷脂和脑磷脂的母体结构都是磷脂酸,即甘油分子中的三个羟基有两个与高级脂肪酸形成酯,另一个与磷酸形成酯。卵磷脂是磷脂酸中的磷酸通过酯键与胆碱结合而成的,脑磷脂是磷脂酸中的磷酸通过酯键与胆胺结合而成的。
按磷酸与甘油的结合位置,卵磷脂可分为α-卵磷脂和β-卵磷脂,当磷酸与甘油中的伯羟基结合时,称为α-卵磷脂。磷酸与甘油中的仲羟基结合时,称为β-卵磷脂。
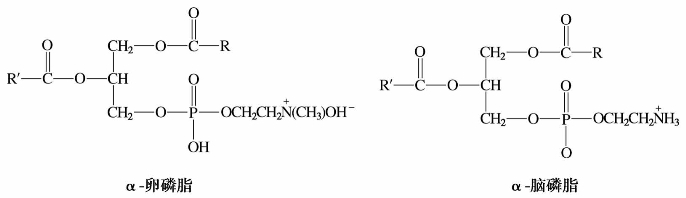
脑磷脂的结构与卵磷脂相似,也有α-脑磷脂和β-脑磷脂之分。天然的脑磷脂也为α-脑磷脂。
2)神经磷脂
神经磷脂简称鞘磷脂,存在于脑、神经组织和细胞膜中,是神经鞘胺醇的衍生物。
练习11.5
1.举例说明卵磷脂、脑磷脂和神经磷脂在人体的作用。
2.α-卵磷脂和β-卵磷脂在结构上有什么异同?
11.2.3 蜡
蜡是指长链脂肪酸和长链醇所生成酯的混合物,同时还含有一些游离的高级羧酸、醇和烃类等。植物的叶和果实表面都有一层蜡,其作用是减少体内水分的蒸发和防止外部水分的聚集,昆虫的外壳、兽类的毛和鸟的羽毛上也有蜡。
组成蜡的羧酸和醇多数含有十六个碳以上偶数碳原子的直链,醇一般为伯醇。
鲸蜡是从鲸油分离得到的软蜡,熔点范围42~50℃,主要成分是棕榈酸鲸蜡酯十六酸十六醇酯CH3(CH2)14COO(CH2)15CH3,用于药膏及化妆品软化剂,也用于生产蜡烛等。
蜂蜡是由蜂腺分泌的从蜂巢采集而来的,熔点范围62~65℃,主要成分是十六酸三十醇酯CH3(CH2)14COO(CH2)29CH3,用于制蜡纸、鞋油及固体润滑剂等。
棕榈蜡是从巴西棕榈叶中获得的一种硬蜡,熔点范围82~86℃,主要成分是二十六酸三十醇酯CH3(CH2)24COO(CH2)29CH3,用于汽车和地板蜡等。
白蜡又称虫蜡,它是白蜡虫的分泌物,熔点范围80~85℃,主要成分是二十六酸二十六醇酯CH3(CH2)24COO(CH2)25CH3。
蜡的物态、物性与石蜡相似,它们在常温下多为固态,都不溶于水而溶于乙醚、苯等有机溶剂。但它们的化学组成完全不同,蜡是酯,石蜡是二十碳原子以上的高级烷烃的混合物。
练习11.6
1.蜡在植物中的作用是什么?
2.比较蜡与石蜡的异同点?
任务11.3 氨基酸和蛋白质
羧酸分子中烃基上的氢原子被氨基取代后的化合物,称为氨基酸,其分子中同时含有氨基和羧基两种官能团。
11.3.1 氨基酸
1)氨基酸的分类和命名
从结构上根据所连烃基的不同,氨基酸可分为脂肪族和芳香族两类。在脂肪族氨基酸中根据氨基和羧基的相对位置可分为α-氨基酸,β-氨基酸,γ-氨基酸,……,ω-氨基酸。
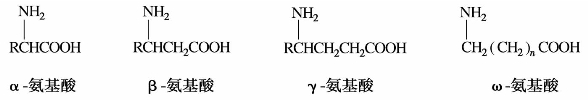
至今为止在自然界中发现的氨基酸已有200余种,其中绝大部分是脂肪族α-氨基酸。在α-氨基酸分子中,若氨基和羧基数目相等时称为中性氨基酸;若羧基数目多于氨基时称为酸性氨基酸;若氨基数目多于羧基数目时称为碱性氨基酸。
表11.3列出了蛋白质水解得到的重要氨基酸,其中号为人体不能合成的,必须由食物供给的氨基酸,通常称为“必需氨基酸”。人们食用的蛋白质并不是都含有全部必需氨基酸,含有全部必需氨基酸的为完全蛋白质。
表11.3 蛋白质中存在的氨基酸及其物理常数
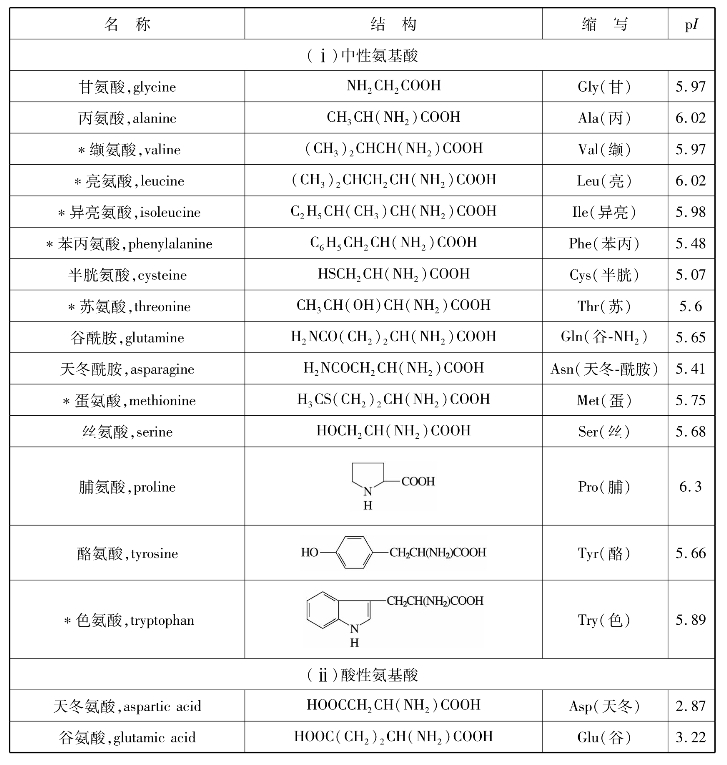
续表
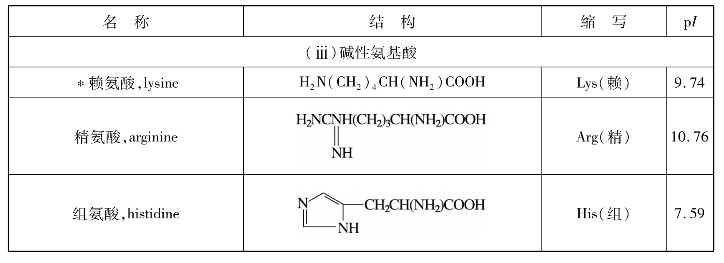
注:必需氨基酸。
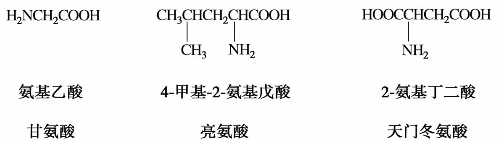
氨基酸的命名,是以羧酸为母体,氨基作为取代基命名的。但从蛋白质分离得到的20余种α-氨基酸,通常都有简单的俗名。例如
2)氨基酸的结构
常见的组成蛋白质的各种α-氨基酸,除了甘氨酸以外,都含有旋光性。其通式可以表示如下:
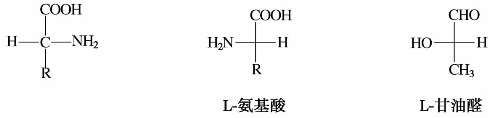
20种氨基酸中的烷基R,除一种R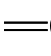 H外,其他均是不同的有机基团,因此,氨基酸的碳原子(除R
H外,其他均是不同的有机基团,因此,氨基酸的碳原子(除R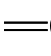 H外)都是手性碳原子。α-氨基酸的构型习惯上用D或L表示,天然的氨基酸多数都是L型的,构型与L-甘油醛中羟基的向位类似。
H外)都是手性碳原子。α-氨基酸的构型习惯上用D或L表示,天然的氨基酸多数都是L型的,构型与L-甘油醛中羟基的向位类似。
3)氨基酸的重要理化性质
(1)物理性质
大多数天然氨基酸为无色晶体,熔点较高,少数为黏稠液体,易溶于水,不溶于醚等非极性有机溶剂,加热至熔点则分解,这些性质与一般的有机物是有较大区别的。
(2)化学性质
由于氨基酸分子中同时含有羧基和氨基,因此具有羧基和氨基的典型性质。
①两性和等电点。氨基酸分子不仅能与外来的酸或碱作用生成盐,而且分子内部的氨基与羧基也能相互作用生成盐,称为内盐或偶极离子,氨基酸与酸碱的反应可表示如下:
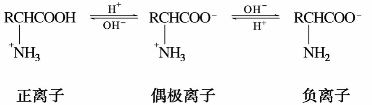
氨基酸在酸性溶液中,呈正离子形式存在,在碱溶液中,呈负离子形式存在。在某一特定的pH时完全以偶极离子形式存在,当正、负离子浓度相等,即净电荷等于零,在电场中不移向任何一极,这时溶液的pH值称为该氨基酸的等电点,通常以p I表示。
②与水合茚三酮反应。α-氨基酸水溶液与水合茚三酮反应生成蓝紫色物质。由于生成的紫色溶液在570 nm有吸强收峰,其强度与参加反应的氨基酸的量成正比,因而可以定量测定α-氨基酸的含量。
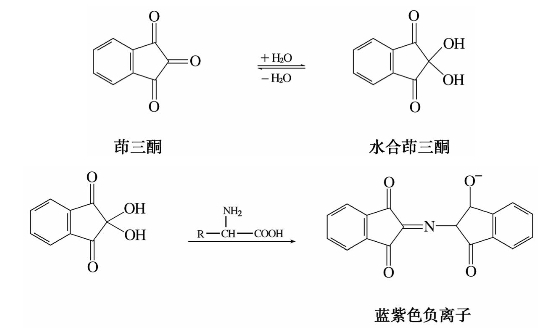
由于脯氨酸的α-亚氨基是五元环的一部分,因此与茚三酮的反应不是上述方式进行的。但是,反应可得到黄棕色化合物,故此法也可用于它们的定性和定量的鉴定试验。
③与亚硝酸的反应。α-氨基酸中的氨基与亚硝酸作用时放出氮气,这和伯胺的反应相同:
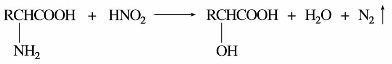
在标准状态下测定所生成氮气的体积,便可计算出分子中氨基的含量。这个方法称为范斯莱克(Van Slyke)氨基测定法。
④与甲醛的反应。氨基酸分子在水溶液中是以偶极离子状态存在,故不能用酸碱滴定法测定其含量。如果向氨基酸水溶液中加入甲醛,则其氨基与甲醛的羰基发生加成反应,释放H+。
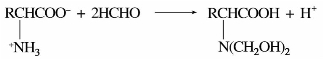
以酚酞作指示剂,用NaOH滴定可间接测定氨基的含量。
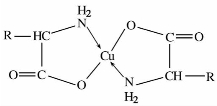
⑤与金属离子的络合。氨基酸中的羧基可与金属离子作用成盐,同时,氨基氮上的孤对电子可与某些金属离子形成配价键,因此,氨基酸能与某些金属离子形成稳定的络合物。例如,与二价铜能形成蓝色络合物(晶体),可用于分离或鉴定氨基酸。
⑥成肽。α-氨基酸的氨基与另一个氨基酸的羧基失水生成的酰胺键(—CO—NH—)相连接的缩合产物,称为肽。由两个氨基酸缩合而成的肽,称为二肽;由3个氨基酸缩合而成的肽,称为三肽;由多个(3~50)氨基酸缩合而成的肽,称为多肽。肽分子中的酰胺键(—CO—NH—)称为肽键。
多肽链的表示方法,一般把有氨基的一端(N-端)写在左边,有羧基的一端(C-端)写在右边。多肽和氨基酸一样也是两性离子。
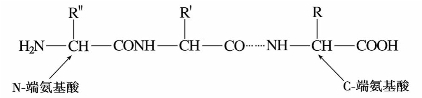
多肽的命名是以保留有游离羧基的(C-端)的氨基酸为母体,肽链中其他氨基酸从保留有游离氨基的(N-端)氨基酸开始,将它们的酰基名称依次从左到右写在母体名称之前。例如:
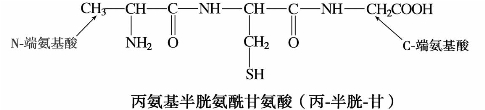
练习11.7
1.什么是中性氨基酸、酸性氨基酸和碱性氨基酸?
2.为什么说氨基酸具有两性?
11.3.2 蛋白质
蛋白质是存在于一切细胞中的高分子化合物之一,是构成生物体最基本的结构物质和功能物质。蛋白质的相对分子质量在1万以上,水解生成α-氨基酸,另外有些蛋白质水解后除生成α-氨基酸外,还生成糖类、核酸、含磷或含铁等非蛋白质物质。
1)蛋白质的分类
蛋白质的组成元素主要是C、H、O、N 4种,大多数含有S元素,有些还含有P、Fe、I等元素。因构成蛋白质的氨基酸数量和排列不同,所以蛋白质的结构复杂,种类繁多。其分类方法有以下两种。
(1)根据蛋白质的形状分类
①球形蛋白质。它们的多肽链自身扭曲折叠,外形接近球形或椭圆形,溶解性较好,能形成结晶,大多数蛋白质属于这一类。例如酶、血红蛋白、蛋清蛋白等。
②纤维状蛋白质。它们的多肽链扭在一起或平行排列,分子类似纤维或细棒。例如角蛋白、丝蛋白、骨胶蛋白等。
(2)根据蛋白质的化学组成分类
①单纯蛋白质。这类蛋白质水解最终产物只有α-氨基酸。如蛋清蛋白、角蛋白等。
②结合蛋白质。这类蛋白质由单纯蛋白质和非蛋白质(如含铁化合物、脂肪等)两部分结合而成。非蛋白质部分又称辅基。根据辅基的不同,又可将结合蛋白质分为脂蛋白、糖蛋白、色蛋白、核蛋白、金属蛋白等。
2)蛋白质的结构
蛋白质的结构很复杂,不仅有多肽链内氨基酸的种类和排序问题,也有肽链本身或几条肽链之间的空间结构问题。常将蛋白质结构分为一级、二级、三级和四级,以表示不同层次的结构,如图11.4所示。
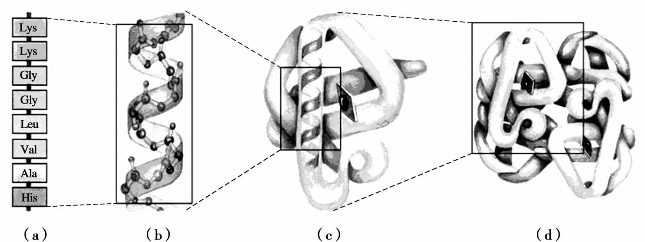
图11.4 蛋白质的结构层次
(a)一级结构;(b)二级结构;(c)三级结构;(d)四级结构
①蛋白质的一级结构。蛋白质分子中的氨基酸按一定的排列顺序构成蛋白质的肽链骨架是最基本的结构,称为一级结构,如图11.4所示,一级结构又称初级结构或基本结构,多肽链是蛋白质分子内的主要连接方式,所以又称主键。
②蛋白质的二级结构。由于肽链不是直线形的,价键之间有一定角度,而且分子中又含有许多酰胺键,因此一条肽链可以通过一个酰胺键中羰基的氧原子与另一酰胺键中氨基的氢原子形成氢键而绕成螺旋形,称为α-螺旋,这是蛋白质的一种二级结构,见图11.4,图11.5;蛋白质的另一种二级结构是由链间的氢键将肽链拉在一起形成折叠状,称为β-褶片,如图11.5所示。
③蛋白质的三级结构。蛋白质的三级结构是多肽链借助于各种副键(氢键、二硫键等)或肽链间的范德华力在空间进一步的折叠、卷曲、盘旋的形状,见图11.4。在扭折时,蛋白质分子中疏水的非极性基团趋向于脱离分子表面的水溶液,在分子内部紧密相邻,彼此吸引,使得蛋白质三级结构趋于稳定。
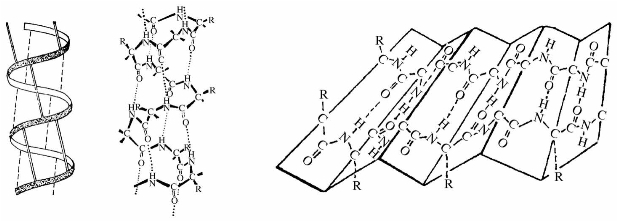
图11.5 蛋白质的α-螺旋、β-褶结构
3)蛋白质的四级结构
每一个具有三级结构的多肽链称为亚基。把几个亚基借助于各种副键的作用而构成的一定空间结构形态,称为蛋白质的四级结构,见图11.4。只有一条多肽链的蛋白质无四级结构。只有两条或大于两条多肽链的蛋白质才有四级结构。
4)蛋白质的性质
蛋白质是由α-氨基酸组成的,所以它具有与氨基酸某些类似的化学性质(如两性性质、等电点及某些类似的显色反应等)。但蛋白质毕竟不同于氨基酸,它是具有复杂空间结构的生物大分子,因此它又具有许多新的特性(如盐析、变性及水解等),还可以形成胶体。
(1)蛋白质的两性和等电点
与氨基酸相似,蛋白质也是两性物质,与强酸强碱都能生成盐。如果调节溶液的pH值,蛋白质所带正负电荷相等,净电荷为零,这时溶液的pH值就是该蛋白质的等电点。在等电点时,蛋白质的溶解度、黏度、渗透压、膨胀性及导电能力等都最小,利用该性质可进行分离提纯蛋白质。
(2)蛋白质的沉淀
在蛋白质溶液中加入无机盐(如NaCl、Na2SO4、(NH4)2SO4、MgCl2等)溶液,蛋白质则从溶液中沉淀析出,这种作用称为盐析。盐析属于可逆沉淀,利用这个性质可以分离不同的蛋白质。
在蛋白质溶液中加入乙醇、丙酮等极性较强的有机溶剂时,这些有机溶剂与水的亲和力较大,也会破坏蛋白质颗粒的水化膜,使其沉淀析出。该法如果不注意有机溶剂的用量,往往会使蛋白质生理活性消失。
当蛋白质溶液pH高于等电点时,向该蛋白质溶液中加入重金属离子(盐),如Hg2+、Ag+、Pb2+等,可以和带负电荷的羧基阴离子结合,生成不溶性的盐而沉淀。当蛋白质溶液pH低于等电点时,向该蛋白质溶液中加入某些酸类,如苦味酸、硝酸、三氯乙酸、磺基水杨酸等,可以和带正电荷的氨基阳离子结合,生成沉淀而析出。
(3)蛋白质的变性
在热、紫外线、超声波等物理因素和在强酸、强碱、重金属盐、生物碱试剂等化学因素的作用下,可改变或破坏蛋白质分子空间结构,导致蛋白质丧失活性、溶解度降低,甚至凝固,使其理化性质发生变化,这种现象称为蛋白质的变性。
蛋白质的变性在实际中具有重要的意义。例如将溶于水中的鸡蛋白进行煮沸,则很快就出现蛋白质的凝固现象;用高温、紫外线和酒精等物理或化学方法进行消毒,可促使细菌或病毒的蛋白质变性而死亡;临床上急救重金属盐中毒病人,常先服用牛奶和蛋清,使蛋白质和重金属盐结合并发生变性,从而阻止重金属离子被人体吸收。
(4)蛋白质的显色反应
蛋白质分子虽大,但是性质活泼,能发生多种显色反应,这些反应可用来鉴别蛋白质。
①缩二脲反应。与缩二脲一样,在蛋白质溶液中加入氢氧化钠和硫酸铜稀溶液时会显粉红色或紫色的反应称为缩二脲反应。生成的颜色与蛋白质种类有关。二肽以上的多肽都有此显色反应。
②茚三酮反应。蛋白质加入茚三酮水溶液生成蓝紫色物质;α-氨基酸与多肽均有此性质。此反应在蛋白质鉴定上也极为重要,色层分析时用这个试剂。
③黄蛋白反应。某些含有苯环的α-氨基酸构成蛋白质后,仍保持苯环的性质,与硝酸作用,能生成硝基化合物而显黄色。皮肤、指甲接触浓硝酸变黄就是这个缘故。
(5)蛋白质的胶体性质
蛋白质是高分子化合物,分子量大,其分子三维空间尺寸为1~100 nm,属于胶体分散体系,因此蛋白质具有胶体溶液的特性,如布朗运动、丁达尔效应、不能透过半透膜,具有吸附性等。利用蛋白质分子胶体颗粒不能透过半透膜的性质可将蛋白质分离提纯,这种方法称为透析法。
(6)酶
酶是一类由细胞产生的,对特定的生物化学反应有催化作用的蛋白质,是生物化学反应的催化剂,所有的酶都是单纯的或结合蛋白质。酶催化反应在常温、常压下迅速进行,并且具有高度的区域选择性和立体选择性,显现出了两个主要的特点:强大的催化能力和专一性。
酶的催化速度是惊人的,例如体内的过氧化氢酶每一分子在1 min内就可分解5×107个过氧化氢分子。有些酶的专一性是非常强的,例如胰蛋白酶只水解由碱性氨基酸如赖氨酸和精氨酸的羧基形成的肽键;但也有些酶专一性不太强,例如胃蛋白酶几乎可以水解一切肽键。酶的相对分子质量也大小不等,例如糜蛋白酶和核糖核酸酶分别由241个和124个氨基酸组成,它们的一级及高级结构均已被测定,后者已通过固相及液相接肽法合成。
练习11.8
下列化合物属于蛋白质的是( )。
A.性激素 B.纤维素 C.结晶牛胰岛素 D.胆固醇
综合练习11
1.选择题
(1)下列化合物能使溴水褪色的是( )。
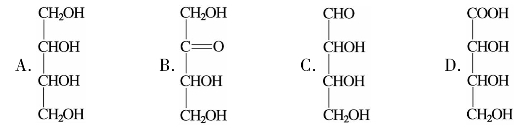
(2)下列化合物不能发生银镜反应的是( )。
A.葡萄糖 B.果糖 C.蔗糖 D.麦芽糖
(3)下列化合物完全水解后生成不同物质的是( )。
A.淀粉 B.纤维素 C.蔗糖 D.麦芽糖
(4)可用于区别还原糖和非还原糖的试剂是( )。
A.溴水 B.斐林试剂 C.羰基试剂 D.碘-碘化钾
(5)下列化合物水解前能发生银镜反应的是( )。
A.淀粉 B.纤维素 C.蔗糖 D.麦芽糖
2.写出下列化合物的构造式。
(1)葡萄糖 (2)葡萄糖酸 (3)果糖 (4)葡萄糖脎
(5)氨基乙酸(甘氨酸)(6)2-氨基丁二酸(天门冬氨酸)
3.写出葡萄糖与下列试剂作用的化学反应式,并指出主要产物。
(1)溴水 (2)HNO3 (3)NaBH4 (4)苯肼
4.写出丙氨酸与下列试剂作用的化学反应式,并指出主要产物。
(1)NaOH (2)HCl溶液 (3)水合茚三酮 (4)加热
5.用简单的化学方法区别下列各组化合物。
(1)葡萄糖与果糖 (2)麦芽糖与蔗糖
(3)纤维素与淀粉 (4)果糖与水溶性淀粉
6.解释下列各词。
(1)氨基酸的等电点 (2)蛋白质的盐析及变性
(3)蛋白质的三级结构 (4)肽键
7.简答下列问题。
(1)什么是碘值、皂化值? (2)举例说明糖、蛋白质、油脂的主要用途。
8.已知A、B、C是3个D-戊醛糖。当它们分别用硝酸氧化时,A和B生成无旋光活性的戊糖二酸,C则生成有旋光活性的戊糖二酸。当它们分别与过量苯肼反应时,B和C能生成相同的肼。写出A、B、C费歇尔投影式及有关反应式。






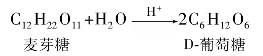



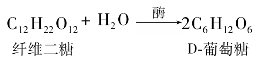






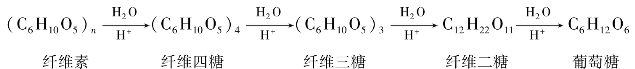



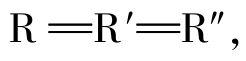 ,称为单纯甘油酯,而R≠R′≠R″,则称为混合甘油酯,天然的油脂大多为混合的甘油酯。
,称为单纯甘油酯,而R≠R′≠R″,则称为混合甘油酯,天然的油脂大多为混合的甘油酯。









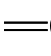 H外,其他均是不同的有机基团,因此,氨基酸的碳原子(除R
H外,其他均是不同的有机基团,因此,氨基酸的碳原子(除R