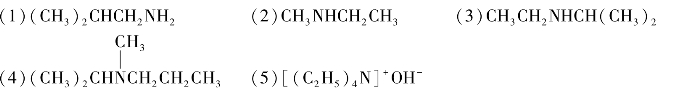2)苯环上的取代反应
由于硝基的强吸电子诱导和共轭效应的影响,苯环上电子云密度降低较多(尤其是邻位和对位),因此亲电取代反应发生在间位,且比苯难进行,以致与弱的亲电试剂不发生反应。如硝基苯不能发生傅-克反应。所以硝基苯可用做这类反应的溶剂。
3)硝基对苯环上其他基团的影响
(1)使卤原子活化
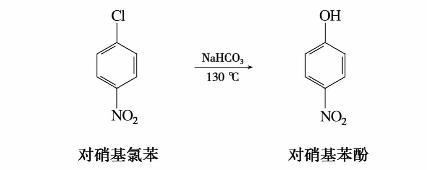
通常情况下,卤苯很难发生水解反应,但卤素邻位或对位上的硝基使与卤原子直接相连的碳原子上电子云密度大大降低,从而带有部分正电荷,有利于亲核试剂OH-的进攻,水解反应变得容易发生。硝基越多,反应越容易进行。例如:
(2)对酚类酸性的影响
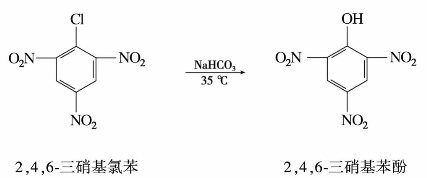
苯酚的酸性较弱,而2,4-二硝基苯酚的酸性与甲酸相近,2,4,6-三硝基苯酚(苦味酸)的酸性几乎与强的无机酸相近。这是因为酚羟基的邻位或对位有强吸电子的硝基时,酚羟基中氧原子上的未共用电子对所在p轨道,通过苯环与硝基的π轨道形成共轭体系。吸电子的硝基通过共轭效应的传递,使氧原子上的电子云密度更偏向苯环,降低了酚羟基上氧原子的电子云密度,从而增加了氢解离成质子的能力,使酚羟基的酸性增强。随着硝基数目的增多,这种影响加大,酸性更强。
4)重要的硝基化合物
(1)硝基苯
硝基苯为浅黄色油状液体,熔点5.7℃,沸点210.8℃,相对密度1.197,具有苦杏仁气味,有毒,不溶于水,而易溶于乙醇、乙醚等有机溶剂。硝基苯可通过苯的硝化反应制备。它是生产苯胺及制备染料和药物的重要原料。
此外,它还可用做溶剂和缓和的氧化剂。
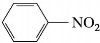
硝基苯
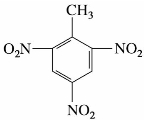
2,4,6-三硝基甲苯
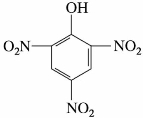
2,4,6-三硝基苯酚
(2)2,4,6-三硝基甲苯
2,4,6-三硝基甲苯俗称TNT。为黄色晶体,熔点80.1℃,不溶于水,可溶于苯、甲苯和丙酮,有毒,由甲苯直接硝化制得。
TNT是一种重要的军用炸药。因其熔融后不分解,受震动也相当稳定,所以装弹运输比较安全。经起爆剂引发,就会发生猛烈爆炸。原子弹、氢弹的爆炸威力常用TNT的万吨级来表示。TNT也可用在民用筑路、开山、采矿等爆破工程中,此外还可用于制造染料和照相用药品等。
(3)2,4,6-三硝基苯酚
2,4,6-三硝基苯酚为黄色晶体。熔点122℃,味苦,俗称苦味酸。不溶于冷水,可溶于热水、乙醇和乙醚中,有毒,并有强烈的爆炸性。苦味酸是一种强酸,其酸性与强无机酸相近。由2,4-二硝基氯苯经水解再硝化制得。苦味酸是制造硫化染料的原料,也可作为生物碱的沉淀剂,医药上用作外科收敛剂。
任务9.2 胺
氨分子中氢原子被烃基取代而生成的一系列衍生物称为胺。蛋白质、核酸、许多激素、抗生素和生物碱都含氨基,掌握胺的结构、性质和合成方法是研究这些复杂天然产物的基础。
9.2.1 胺的结构与分类
1)胺的结构
胺的结构与氨相似,呈三角锥形,分子中氮原子为sp3杂化,4个杂化轨道中,有一个为电子对所占据,其他3个sp3轨道与氢或碳原子生成σ键。
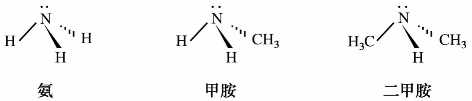
2)胺的分类
(1)根据分子中烃基的结构不同,胺可分为脂肪胺和芳香胺。例如:
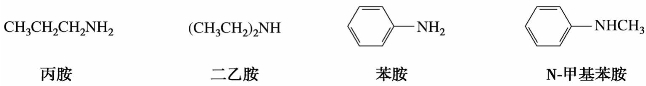
(2)根据分子中所含氨基的数目不同,又分为一元胺、二元胺和多元胺。例如:
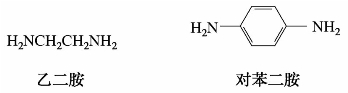
(3)根据氮原子上连接烃基的数目,可将胺分成伯胺(一级胺)、仲胺(二级胺)、叔胺(三级胺)。例如:
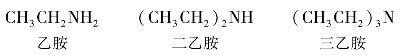
应该注意,伯、仲、叔胺和伯、仲、叔醇的涵义是不同的。伯、仲、叔醇是指羟基分别与伯、仲、叔碳相连的醇,而伯、仲、叔胺是根据氮原子所连烃基的数目而定的。例如:
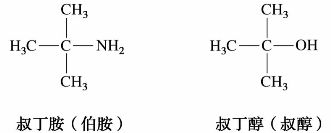
(4)相应于氢氧化铵和铵盐的氨的四烃基衍生物,分别称为季铵碱和季铵盐。例如:
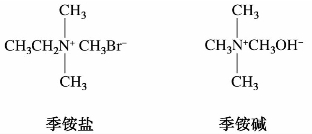
9.2.2 胺的命名
①习惯命名法。结构简单的胺在胺之前加上烃基的名称来命名。当多个烃基相同时,在前面用“二”或“三”表示烃基的数目;当烃基不同时,则按次序规则,较优基团名称放在后面。当氮原子上同时连有烷基和芳基时,则以芳胺为母体,命名时烷基名称前加英文字母“N”,表示烷基是连在氮原子上。对于季铵盐或季铵碱,其命名与上相同,在铵之前加上负离子的名称。例如:
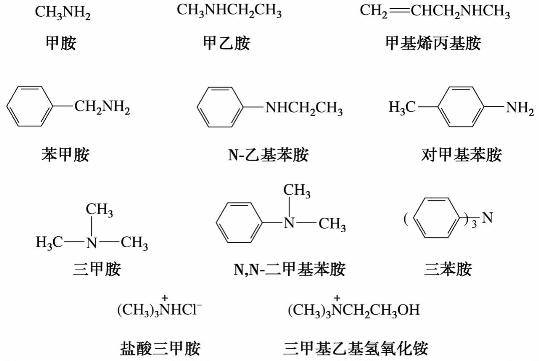
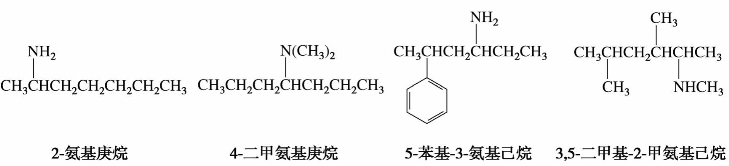
②系统命名法。复杂的胺以将氨基作为取代基,以烃基或其他官能团作母体,取代基按次序规则排列,较优基团后列出。例如:
在有机化学中,氨、胺、铵3个字用法常易混淆。本书的用法为:作为取代基时称氨基,如—NH2称氨基,—NHCH3称甲氨基;作为官能团时称胺,如CH3NH2称甲胺;氮上带正电荷时称铵,如CH3NH+3Cl-称为氯化甲铵,如写成CH3NH3·HCl时称为甲胺盐酸盐。
9.2.3 胺的物理性质
胺是中等极性的物质。伯胺与仲胺分子间可以形成氢键,叔胺因氮上无氢原子,自身分子间不能形成氢键,所以相同分子量的化合物的沸点是伯胺>仲胺>叔胺>烷烃。因为胺分子间的氢键不如醇、羧酸的氢键强,所以胺的沸点比相近分子量的醇、羧酸低。
低级胺易溶于水,因为它们可与水形成氢键。叔胺虽然分子间不能形成氢键,但仍可与水形成氢键。
胺有难闻的气味,许多脂肪胺有鱼腥臭,丁二胺和戊二胺有腐烂肉的臭味,它们又分别称为腐胺和尸胺。
许多胺有一定生理作用,气态胺对中枢神经系统有轻微抑制作用。很多药物都含胺的结构,同时胺(芳香伯胺)是合成药物的重要中间体。苯胺是有毒的,可使皮肤起疹、恶心、视力不清、精神不安,使用时要小心。有些芳香胺是致癌物质。
9.2.4 胺的化学性质
1)胺的碱性
胺中的氮原子和氨一样,有未共用电子对能接受质子,所以胺有碱性。

胺的水溶液和氨水一样呈碱性。其碱性强度可用电离常数K b(或p K b)来表示,胺的K b值越大(或p K b值越小)则碱性越强。
(1)脂肪胺的碱性比氨大
脂肪胺中仲胺碱性最强,伯胺次之,叔胺最弱;但它们的碱性都比氨强。例如:
二甲胺>甲胺>三甲胺
这是因为影响碱性的因素很多,除诱导效应外,还有空间效应、溶剂化效应。从空间效应看,由于烷基数目的增加,在空间所占的位置也增大,这样给氮原子以屏蔽作用,阻碍了氮原子的未共用电子对与质子的结合,因此叔胺的碱性降低。从溶剂化效应看,胺分子中的氮上的氢原子越多,则与水形成氢键的机会就越多,溶剂化的程度就越大,形成的铵正离子就越稳定,碱性就越强。因此,胺的碱性强弱是诱导效应、空间效应和溶剂化效应综合影响的结果。
(2)芳香胺的碱性比氨小
芳香胺的碱性比氨弱,是由于苯环和氨基之间存在p-π共轭效应,氮原子上的电子云向苯环方向偏移,氮原子电子云密度减小,接受质子的能力也随之减小,碱性减弱。同时苯环又占据较大的空间,阻止质子和氨基接近,故苯胺的碱性比氨弱得多,这和实际测定的p K b大小顺序完全一致。同理,苯基越多,芳胺的碱性越弱。例如,N,N-二甲基苯胺>N-甲基苯胺>苯胺>二苯胺>三苯胺。由于胺是弱碱,铵盐中加入强碱后,胺游离出来。例如:

此性质可用于混合物中胺的分离和精制。
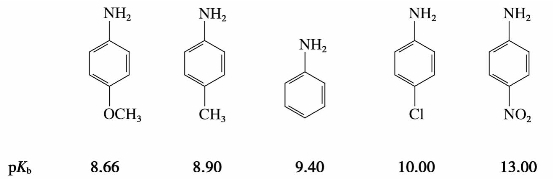
(3)取代苯胺的碱性
取代苯胺的碱性强弱,取决于取代基的性质,取代基为供电子基团时,使碱性略增;取代基为吸电子基团时,则碱性降低。例如:
练习9.1
按碱性强弱排列下列化合物。
二苯胺、N-甲基苯胺、氨、乙酰二苯胺、乙胺、三乙胺、二乙胺、苯胺
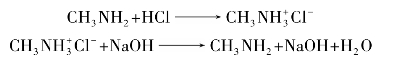
(4)胺与酸成盐
胺属弱碱,只能与强酸形成稳定的盐。胺盐是结晶性固体,有一定的熔点,易溶于水而不溶于非极性溶剂。其水溶液呈酸性,遇碱游离出胺。例如:
利用这些性质,可提纯分离胺类。例如,苯胺与硝基苯混合物的分离:
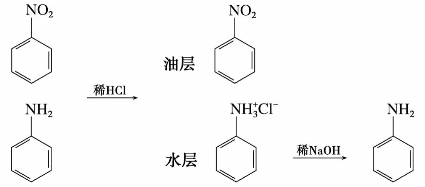
2)胺的烷基化反应
胺和氨一样,可与卤代烃或醇等烷基化剂作用,氨基上的氢原子被烷基取代。脂肪族或芳香族伯胺与卤代烷作用,发生烷基化反应生成仲胺、叔胺和季铵盐。
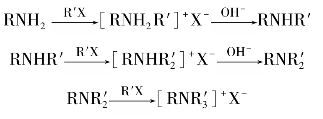
胺的烷基化反应实质上是胺作为亲核试剂进行的取代反应,所以亲核性(碱性)弱或空间位阻大的胺都很难使反应正常进行。卤代烃通常选用1°或2°卤代烃,3°卤代烃在此条件下主要发生消除反应。
3)胺的酰基化反应
伯胺或仲胺与酰基化剂(如酰卤、酸酐)发生酰基化反应,氨基上的氢原子被酰基取代而生成N-烷基酰胺。叔胺的氮原子上没有氢,不起酰化反应。
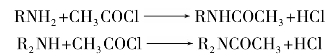
胺的酰基衍生物多数为结晶固体,具有一定的熔点,可用于鉴定伯胺和仲胺。N-烷基酰胺呈现中性,不与酸成盐,因此在醚溶液中,伯、仲、叔胺的混合物经乙酸酐酰化后,再加稀盐酸,则只有叔胺仍能与盐酸成盐,利用这个性质可使叔胺从混合物中分离出来,而伯、仲胺的酰化产物经水解后又得到原来的胺。反应式如下:
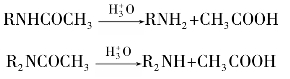
芳胺的酰基衍生物不像芳胺那样容易被氧化,它们容易由芳胺酰化制得,又容易水解转变成原来的芳胺,所以在有机合成上,常利用酰基化来保护氨基以避免芳胺在发生某些反应时被破坏。例如:
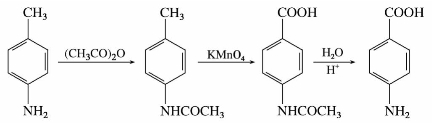
练习9.2
完成下列反应式,并写出产物名称。
4)胺的磺酰化反应
用芳香族磺酰氯如苯磺酰氯或对甲基苯磺酰氯,在氢氧化钠或氢氧化钾溶液存在下,与伯胺或仲胺反应,则生成相应的磺酰胺;叔胺氮上无氢原子,不发生此反应。
苯磺酰基是较强的吸电子基,由伯胺生成的苯磺酰胺受它的影响,氮上的氢原子具有一定的酸性,能与氢氧化钠作用生成盐而溶于碱的水溶液中。仲胺生成的苯磺酰胺,其氮上没有氢原子,故不呈酸性,不能溶解于碱的水溶液中,利用这个性质可以鉴别或分离伯、仲、叔胺。这个反应称为兴斯堡(Hinsberg)反应,是胺的分析鉴定方法之一。
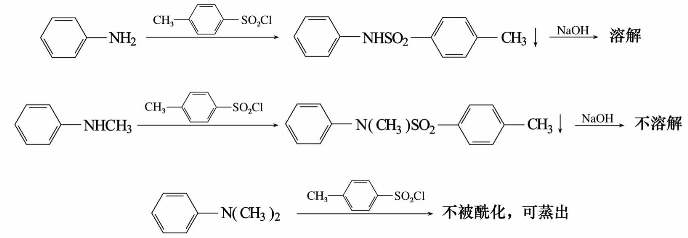
练习9.3
完成下列反应。
5)与亚硝酸反应
胺与亚硝酸的反应比较复杂,但很重要。由于亚硝酸的不稳定性,在反应中实际使用的是亚硝酸钠与盐酸的混合物。

(1)伯胺与亚硝酸的反应
①脂肪族伯胺与亚硝酸反应,定量地放出氮气,可用于氨基的含量测定。
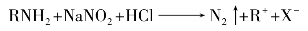
②芳香族伯胺与亚硝酸在低温下生成重氮盐。
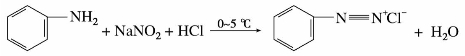
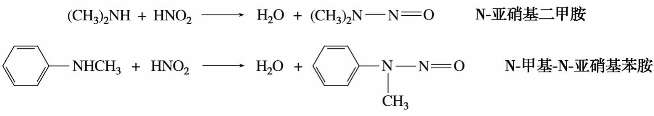
(2)仲胺与亚硝酸的反应
仲胺与亚硝酸反应生成的N-亚硝基胺,为黄色不溶于水的油状物,有强烈的致癌作用,它与稀硝酸共热时,水解而成原来的仲胺,此性质可用来分离或提纯仲胺。
(3)叔胺与亚硝酸的反应
①脂肪族叔胺的氮原子上没有氢,不能亚硝基化,只能与亚硝酸形成不稳定的盐。

②芳香族叔胺的氮上虽无氢原子,但芳香环上的氢可被亚硝基取代。
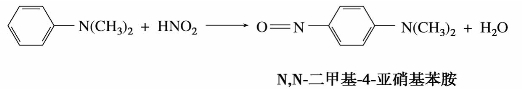
亚硝基化合物通常是有颜色的,在不同介质中,其结构不同,故颜色也不同。

练习9.4
1.己胺与亚硝酸完全反应生成氮气,在标准状态下为22.4毫升,求己胺的质量。
2.提纯含有少量三乙胺的二乙胺。
6)胺的氧化
芳香胺很易被氧化,氧化产物很复杂,其中包含了聚合、氧化水解等反应的产物。例如,纯苯胺是无色透明液体,在空气中被逐渐氧化颜色变为黄色至红棕色,故芳胺应避光保存。在酸性条件下,苯胺用二氧化锰氧化生成对苯醌,对苯醌还原后生成对苯二酚,对苯醌易挥发,有毒,气味与臭氧相似。

7)苯环上的取代反应
(1)卤化反应
常温下苯胺与溴水作用,立即生成不溶于水的2,4,6-三溴苯胺的白色沉淀,可用于苯胺的定性和定量分析。
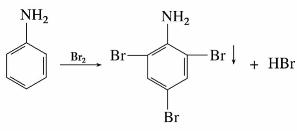
制取一溴苯胺时,可由苯胺经酰基化转化为乙酰苯胺,降低氨基的活性,再溴化,最后水解去掉乙酰基。乙酰氨基比氨基活性弱,且空间障碍大,取代主要在乙酰氨基的对位。
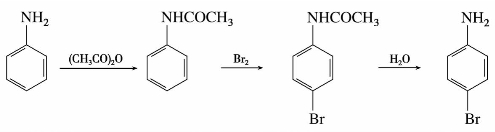
(2)硝化
苯胺容易被氧化,硝化反应前应先将氨基保护起来。如制备对硝基苯胺,需将苯胺转变为乙酰苯胺,然后再硝化、水解。由于乙酰氨基空间障碍大,主要产物是对硝基苯胺。
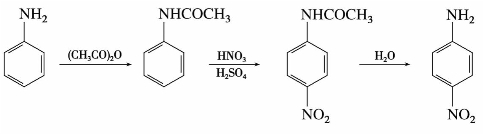
制备间硝基苯胺,可先将苯胺溶于浓硫酸中,使之转变为苯胺硫酸盐以保护氨基,然后再进行硝化。由于生成的—NH+3是间位定位基,故主要产物为间位取代物。
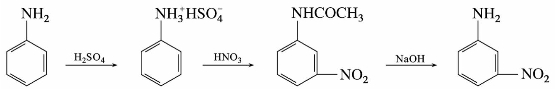
要制备邻硝基苯胺,可将乙酰苯胺用磺基占位法来制备。
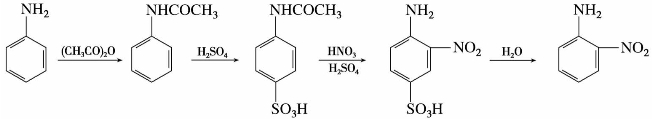
(3)磺化
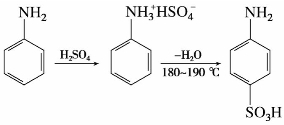
苯胺与浓硫酸混合,生成苯胺硫酸盐,然后在高温下将此盐加热脱水,则重排为对氨基苯磺酸。对氨基苯磺酸,俗称磺胺酸,白色晶体,熔点288℃,微溶于冷水,几乎不溶于乙醇、乙醚、苯等有机溶剂,是制备偶氮染料和磺胺药物的原料。对氨基苯磺酸分子内同时含有碱性的氨基和酸性的磺基,是两性化合物,可以形成内盐。
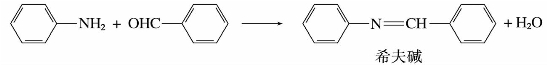
8)与醛反应
苯胺与芳香醛缩合,生成希夫碱。
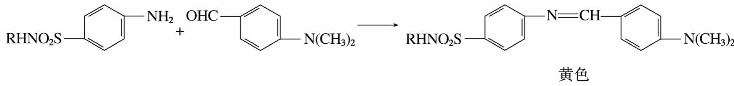
磺胺药物中的氨基可与许多芳香醛(如对二甲胺基苯甲醛)缩合成希夫碱,且呈黄色,此反应很灵敏,常用作磺胺药物薄层层析时的显色剂。
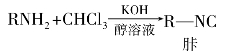
9)异腈反应
伯胺与三氯甲烷、氢氧化钾的醇溶液共热生成有毒及特臭的异腈(胩),可利用这个反应鉴别伯胺。异腈可在稀酸中水解,因此可用稀酸解除异腈的毒性和臭味。
9.2.5 季铵盐和季铵碱
季铵盐是白色晶体,易溶于水,难溶于非极性的有机溶剂,熔点高,常在熔融时分解,分解产物为叔胺和卤代烷。季铵盐与湿氧化银反应,得到碘化银沉淀,并获得较纯的季铵碱。
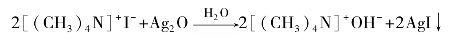
季铵碱碱性与氢氧化钠或氢氧化钾相当,能吸收空气中的二氧化碳,易潮解,易溶于水;可和酸发生中和作用形成季铵盐。加热时(>125℃)季铵碱分解,分解产物和烃基有关。例如氢氧化四甲铵受热时分解成甲醇和三甲胺。

烃基β-碳上含有氢的季铵碱加热则分解成烯烃、叔胺和水。例如:
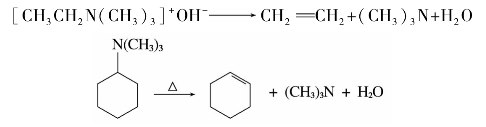
产生的烯烃是由烃基脱β-氢而成的。当烃基结构较复杂时,反应总是主要生成双键上有较少烷基的烯烃,称为霍夫曼(Hofmann)规则。例如:
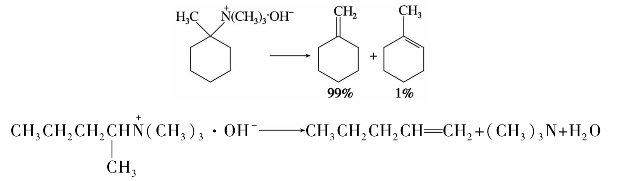
季铵碱的消除取向正好与卤代烷的消除取向(札依采夫规则)相反,称为霍夫曼消除反应,常用于测定铵的结构及烯烃的制备。
练习9.5
试写出下列化合物的热分解产物。

(3)[(CH3)3NCH2CH3]+OH-(4)[CH3CH2CH2CH(CH3)N(CH3)3]+OH-
9.2.6 重要的胺
1)甲胺、二甲胺、三甲胺
甲胺(CH3NH2)、二甲胺[(CH3)2NH]、三甲胺[(CH3)3N]在常温下都是无色气体,易溶于水,有氨和鱼腥样臭味,有碱性。在一些植物中有甲胺存在,蛋白质腐败往往有甲胺生成。在动物组织尤其鱼肉中含有三甲胺,鱼腐败时它就游离出来,它是生物体内含氮有机物的降解产物。甲胺、二甲胺和三甲胺都是有机合成原料,用于制造农药、药物、染料、离子交换树脂等。
2)乙二胺(H2N—CH2CH2—NH2)
乙二胺是最简单的二元胺。为无色黏稠状液体,沸点116.5℃,易溶于水。乙二胺与氯乙酸在碱性溶液中生成乙二胺四乙酸盐,再酸化得乙二胺四乙酸,简称EDTA。
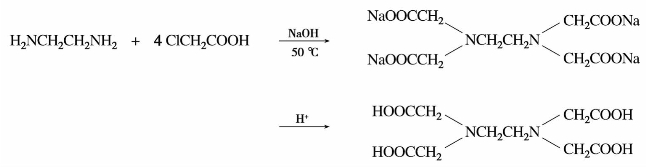
EDTA及其盐是分析化学中常用的金属螯合剂,用于配合和分离金属离子。EDTA二钠盐还是重金属中毒的解毒药。乙二胺是有机合成原料,主要用于制造药物、农药和乳化剂等。
3)己二胺(H2N—(CH2)6—NH2)
己二胺为无色片状晶体,熔点42℃,微溶于水,溶于乙醇、乙醚和苯。
丙烯腈在一定条件下电解、还原二聚,在阴极产生己二腈,再经催化加氢得到己二胺。
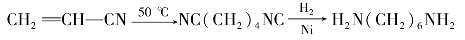
该方法工艺流程短,杂质少,产率高。世界上已趋向于采用这种方法生产己二胺。
己二胺主要用于合成高分子化合物,是尼龙-66、尼龙-610、尼龙-612的单体。
4)苯胺
苯胺(C6H5NH2)最初从煤焦油中分离得到,现在用硝基苯还原制得。苯胺是油状液体,微溶于水,易溶于有机溶剂。纯净的苯胺无色,在空气中放置逐渐变为黄、红、棕色,甚至黑色。苯胺有毒,中毒症状是头晕、皮肤苍白和四肢无力等。
苯胺广泛地用于制药和染料工业,是重要的有机合成原料。
5)萘胺
萘胺有α-萘胺和β-萘胺两种异构体,其中α-萘胺比较重要,α-萘胺是无色针状晶体,熔点50℃,有令人不愉快的气味,不溶于水,可溶于乙醇和乙醚,有毒,工业上由α-硝基萘还原制得。α-萘胺主要用于制造染料,也可用于制造农药、橡胶防老剂等。β-萘胺为无色、有光泽的片状晶体,熔点110℃,不溶于冷水,可溶于热水、乙醇和乙醚。有毒,并且有致癌作用,使用时要特别小心。工业上由β-萘酚与氨水在亚硫酸铵存在下,经加热、加压制得。
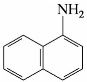
α-萘胺
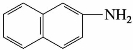
β-萘胺
6)胆碱[HOCH2CH2N(CH3)3]+OH-(氢氧化三甲基羟乙基铵)
胆碱广泛分布于生物体内,是卵磷脂的组成部分,属季铵碱。为白色晶体,吸水性强,可成为无色黏稠的强碱性液体,能吸收空气中的二氧化碳。溶于水,不溶于乙醚、氯仿等非极性溶剂。胆碱是维生素B族之一,能调节肝中脂肪代谢,有抗脂肪肝作用,临床上用来治疗肝炎、肝中毒等。乙酰胆碱,[CH3COOCH2CH2N(CH3)3]+OH-,是胆碱分子中羟基的乙酰化产物,是相邻的神经细胞之间通过神经节传导神经刺激的重要物质。
任务9.3 重氮化合物和偶氮化合物
9.3.1 重氮化合物偶和氮化合物的结构与命名
重氮化合物与偶氮化合物两者的结构不同。重氮基(—N+帒N)中一个氮原子是正五价,是离子化合物;偶氮基(—N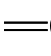 N—)的两个氮原子都是三价的,是共价化合物。
N—)的两个氮原子都是三价的,是共价化合物。

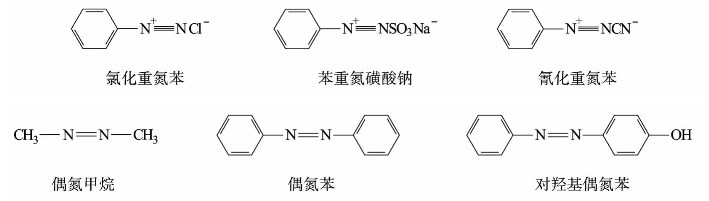
重氮和偶氮化合物的命名如下:
9.3.2 芳香族重氮化合物
1)重氮化反应
芳伯胺在低温和过量强酸(盐酸或硫酸)溶液中与亚硝酸作用,生成重氮盐的反应,称重氮化反应。例如:
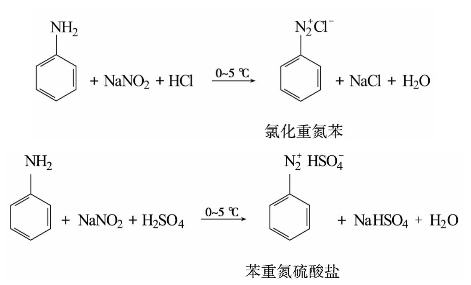
重氮化反应一般是先将芳伯胺溶于强酸溶液中,冷至低温(0~5℃),慢慢滴加亚硝酸钠溶液,同时搅拌,使亚硝酸钠与强酸作用生成亚硝酸,再与芳伯胺进行重氮化。反应必须在强酸性介质(pH≤2)中进行,酸的用量为芳伯胺的2.5倍,过量强酸的存在,可防止生成的重氮盐与未反应的芳伯胺发生偶合反应。加入亚硝酸钠的量要适当,过量的亚硝酸会促使重氮盐分解。反应终点可用碘化钾-淀粉试纸检验。亚硝酸已过量,可加入尿素使其分解。当芳环上连有—Cl、—NO2、—SO3H等吸电子基时,重氮盐的稳定性增加,可适当提高重氮化温度。例如对硝基苯胺可在30~40℃进行重氮化。
2)重氮盐的取代反应
重氮盐可溶于水,其水溶液能导电,不溶于有机溶剂。干燥的重氮盐极不稳定,受热或振动时容易发生爆炸,但在低温水溶液中比较稳定,因此重氮化反应一般在水溶液中进行,且不须分离,可直接用于有机合成。
重氮盐的性质很活泼,重氮盐的取代反应,有其特殊的重要性,是制备芳香族多取代物的一种较普遍的方法。重氮基可被羟基、氢原子、卤素或氰基等取代,同时放出氮气。
(1)被羟基取代
重氮盐在强酸性溶液中煮沸,发生水解反应。重氮基被羟基取代,同时放出氮气。例如:
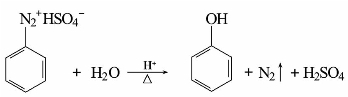
这个反应一般是用重氮硫酸盐,在较浓的强酸溶液(如40%~50%)中进行,这样可以避免反应生成的酚与未反应的重氮盐发生偶合反应。如果用重氮苯盐酸盐,则时常有副产物氯苯生成。
在有机合成上常通过生成重氮盐的途径而使氨基转变成羟基。例如,用间溴苯胺经重氮化、水解制得间溴苯酚。
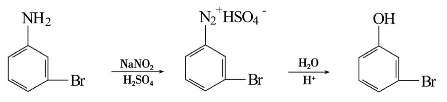
由苯制取间硝基苯酚,可以先从苯制成间二硝基苯,然后再经过部分还原、重氮化、水解等从而得到。
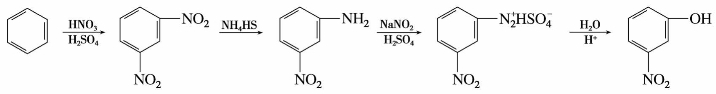
(2)被氢原子取代
重氮盐与某些还原剂如次磷酸(H3PO2)或乙醇作用,则重氮基可被氢原子取代,生成相应的芳香族化合物,同时有氮气放出。该反应可将氨基从芳环上除去。例如:
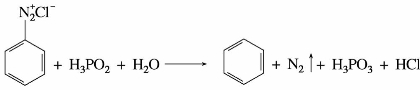
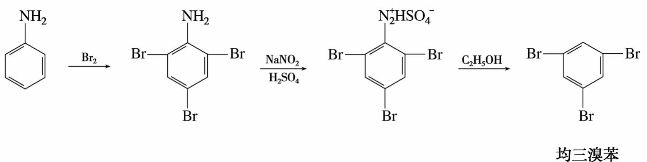
利用重氮盐的脱氨基反应,可以合成一些用直接合成法无法得到的芳烃衍生物。例如合成均三溴苯,由于3个溴互为间位,因此由苯直接溴化是得不到这个化合物的。然而通过硝基苯还原先得到苯胺,苯胺经溴化后再通过重氮盐除去氨基,这样就可以达到合成均三溴苯的目的。
以甲基苯胺为原料,制取间甲基苯胺。
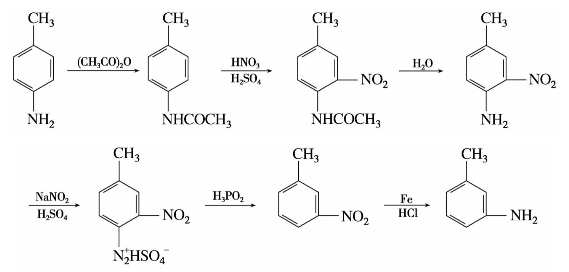
(3)被卤原子取代
重氮盐与氯化亚铜的浓盐酸溶液或溴化亚铜的浓氢溴酸溶液共热,重氮基被卤素原子取代,生成氯苯或溴苯,同时放出氮气,称为桑德迈尔(Sadmeyer)反应。例如:
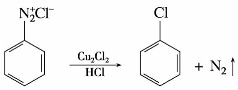
芳香族碘代物可由重氮盐与碘化钾水溶液共热制备,反应不需要加催化剂就能生成产率较高的产物。这是制备碘代芳烃的简便方法。
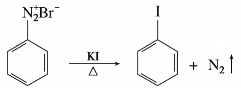
在有机合成上,这类反应可制备某些不能直接用卤代法合成的芳卤代化合物。
例如,对碘苯甲酸的合成可以按以下步骤进行:
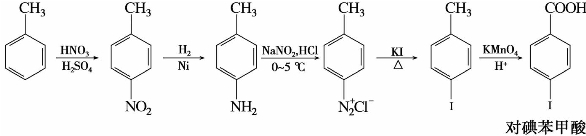
又如间二氯苯也不能由苯直接氯代得到,须经下列步骤间接制得:
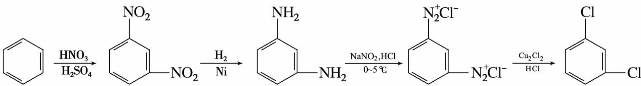
(4)被氰基取代
重氮盐与氰化亚铜的氰化钾溶液共热,重氮基被氰基取代,生成芳香腈,同时放出氮气,此反应也属于桑德迈尔反应。例如:
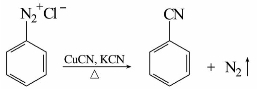
在有机合成上此反应是在芳环上引入氰基的较好方法。氰基进一步水解可转变为羧基,也可以还原成氨甲基,继续合成许多衍生物。
3)还原反应
用氯化亚锡和盐酸,或用亚硫酸氢钠还原重氮盐,可得到芳香族肼。
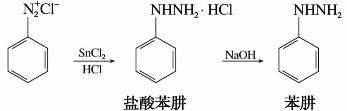
苯肼是含氮有机化合物,结晶性固体,熔点19.8℃,沸点242℃,是常用的羰基试剂。
9.3.3 偶氮化合物
1)偶合反应
重氮盐与酚或芳胺作用,生成有颜色的偶氮化合物的反应,称为偶合反应。例如:
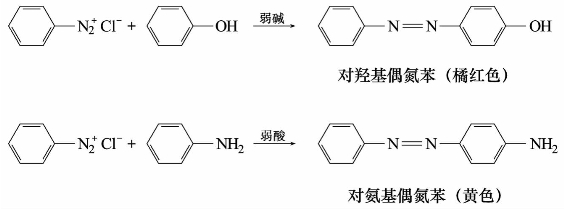
酚和芳香胺分别在弱碱性(PH=7~10)溶液和弱酸性(PH=5~7)溶液中反应较快。
偶合反应中的重氮盐称为重氮组分,酚或芳胺称为偶联组分。重氮正离子ArN+是弱的亲电试剂,只能与酚或芳胺这类活泼的芳香族化合物作用。受电子效应和空间效应的影响,偶合反应通常发生在羟基或氨基的对位,如对位被其他基团占据,则发生在邻位。例如:
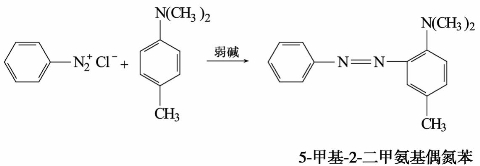
偶氮化合物一般为有颜色的固体物质,相对分子质量较大,即使分子内有氨基或羟基等亲水基团,也难溶于水,而溶于有机溶剂。
2)发色团和助色团
物质都能够吸收一定波长的可见光,吸收光的波长与物质的分子结构有关。有机化合物分子内的共轭体系越长,吸收光的波长越长。偶氮苯中偶氮基(—N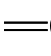 N—)把两个苯环连接起来,形成一个较长的共轭体系,使π电子运动范围扩大,吸收光的波长移到可见光区,从而显色。
N—)把两个苯环连接起来,形成一个较长的共轭体系,使π电子运动范围扩大,吸收光的波长移到可见光区,从而显色。
一些不饱和基团可使有机化合物的共轭体系增长而显色,这种基团称为发色团(或生色团),如C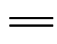 C、C
C、C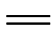 O、—CO—CO—、—COOH、—CHO、—NO2、—NO、—N
O、—CO—CO—、—COOH、—CHO、—NO2、—NO、—N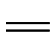 N—、
N—、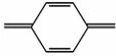 、
、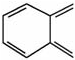 等。含有发色团的有机物称为色原体。
等。含有发色团的有机物称为色原体。
一些酸性或碱性基团,连接在色原体分子的共轭链或发色团上,使共轭体系增长,颜色变深,这样的基团叫助色团(或深色团)。它们的—OH(酚羟基)、—NH2、—SO3H、—NHR(烃代氨基)等。助色团能使有色物质易于与纤维结合,并使有色物质的水溶性增大。
分子中有助色团的偶氮化合物不仅有色,还能牢固地附着在纤维织品上,耐洗耐晒,经久而不褪色,所以常作染料使用,称为偶氮染料。有色物质并非都可用作染料,有的物质虽也符合染料的条件,但随着溶液pH值改变而灵敏地变色,可作为酸碱指示剂使用。有的可凝固蛋白质,而作为杀菌消毒的药品等。下面简要介绍几个常见的偶氮化合物。
3)甲基橙
甲基橙是对氨基苯磺酸重氮盐与N,N-二甲基苯胺发生偶联反应制得的,是一种酸碱指示剂,其变色范围为pH 3.1~4.4。在pH<3.1的酸性溶液中显红色;在pH为3.1~4.4的溶液中呈橙色;在pH>4.4的溶液中显黄色。
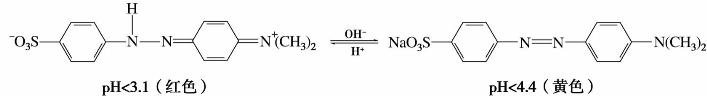
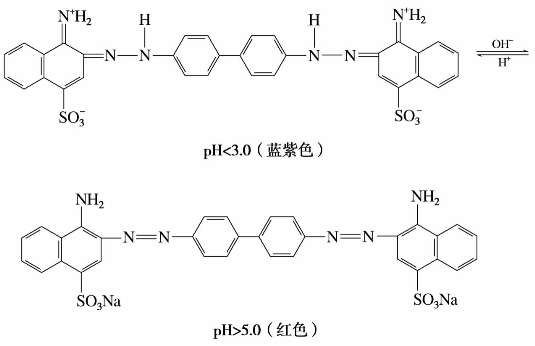
4)刚果红
刚果红是4,4’-联苯二胺的双重氮盐与4-氨基-1-萘磺酸发生偶联反应制得的。刚果红是一种可以直接使丝毛和棉纤维着色的红色染料。同时,也是一种酸碱指示剂,变色范围为pH 3.0~5.0。在pH<3.0的溶液中显蓝紫色,在pH>5.0的溶液中显红色。
5)偶氮染料
偶氮染料数目繁多,它们在结构上的共同特点是分子中含有一个或几个偶氮基。
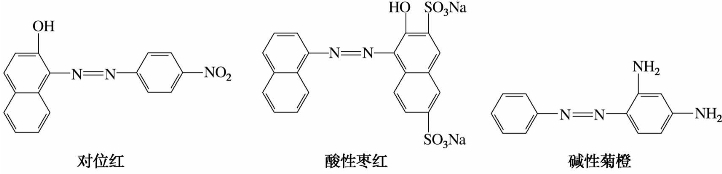
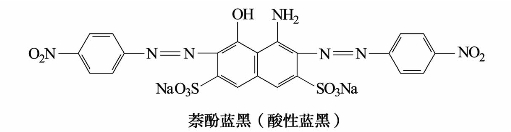
值得注意的是,研究发现,偶氮染料在分解过程中能产生对人体或动物有致癌作用的芳香胺化合物。许多国家对偶氮染料都有严格的限制,其中大部分被禁止使用。
任务9.4 腈
1)腈的结构与分类
腈分子中含有官能团氰基(—CN),可看做是氢氰酸分子中的氢原子被烃基取代所生成的化合物。根据所连烃基结构分为脂肪族腈(R—CN))和芳香族腈(Ar—CN)。
氰基为碳与氮以叁键相连,与炔烃的碳碳叁键相似。碳和氮都是sp杂化。碳氮之间除形成一个Csp—Nspσ键外,还有两个由平行的p轨道形成的Cp—Npπ键,氮原子的另一个sp杂化轨道被一对未共用的电子对占据。
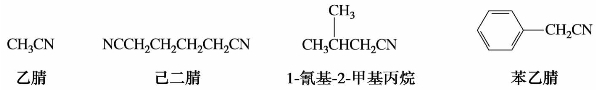
2)腈的命名
腈的命名是根据所含碳原子数(包括氰基的碳)称为某腈;或以烃为母体,把氰基作为取代基,称为“氰基某烷”。例如:
3)腈的物理性质
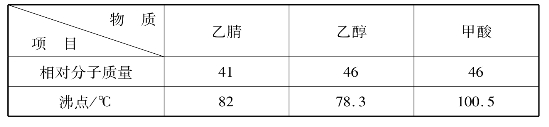
氰基是强极性基团,腈分子的极性较大。低级腈为无色液体,高级腈为固体。
由于腈分子间引力较大,因此其沸点较高。比相对分子质量相近的烃、醚、醛、酮和胺的沸点高,与醇相近,比相应的羧酸沸点低。例如:
低级腈易溶于水,随着相对分子质量的增加,在水中溶解度逐渐降低。例如乙腈能与水混溶,戊腈以上难溶于水。腈也能溶解多种极性和非极性物质,并能溶解许多盐类,故腈是一类优良的溶剂。
表9.1 腈与其他物质比较
4)腈的化学性质
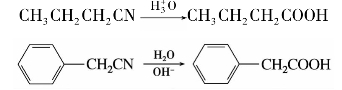
(1)水解反应
腈在酸或碱催化下与水加热至较高温度,可水解生成羧酸。
如果控制在比较温和的条件下水解,例如在含有6%~12%H2O2的NaOH溶液中水解,可以使反应停留在生成酰胺阶段:
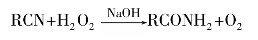
(2)醇解反应
腈在酸催化下醇解,可生成酯。例如:
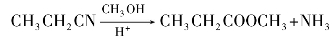
(3)还原反应
腈催化加氢或用LiAlH4还原,生成相应的伯胺,这是制备伯胺的一种方法。例如:
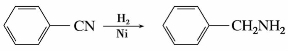
5)重要的腈
(1)乙腈(CH3CN)
乙腈为无色液体,沸点80~82℃,有芳香气味,有毒。可溶于水和乙醇。水解生成乙酸,还原时生成乙胺,能聚合成二聚物和三聚物。
工业上腈由碳酸二甲酯与氰化钠作用或由乙炔与氨在催化剂存在下反应制得。也可由乙酰胺脱水制得。
乙腈可用于制备维生素B1等药物及香料,也用做脂肪酸萃取剂、酒精变性剂等。
(2)丙烯腈(CH2 CHCN)
CHCN)
丙烯腈为无色液体。沸点77.3~77.4℃,微溶于水,易溶于有机溶剂。其蒸汽有毒,能与空气形成爆炸性混合物,爆炸极限为3.05%~17.0%(体积)。
工业上利用丙烯腈在磷钼酸铋催化下和470℃温度下生产丙烯腈,主要采用丙烯的氨氧化法。

此法的优点是原料便宜易得,且对丙烯纯度的要求不高。工艺流程简单,成本低,收率高,约65%等。
丙烯腈在引发剂(如过氧化苯甲酰)存在下,聚合生成聚丙烯腈。

聚丙烯腈可以制成合成纤维,商品名为“腈纶”,它类似羊毛,俗称“人造羊毛”,它具有强度高、密度小、保暖性好,耐光、耐酸及耐溶剂等特性。
综合练习9
1.命名下列化合物。
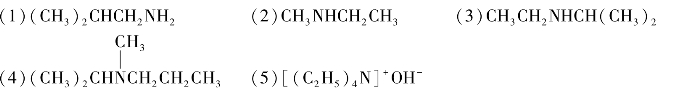
(6)[(CH3)2CHCH2N+(CH3)3]I-

2.写出下列化合物的结构式。
(1)邻苯二胺 (2)邻甲基苯胺 (3)对氨基苯甲酸 (4)仲丁胺
(5)1-苯基乙胺 (6)2,4-二甲基苯胺 (7)盐酸甲乙胺
(8)2,7-二硝基萘 (9)氢氧化四丁铵 (10)氯化甲基乙基正丙基苯基铵
3.比较下列各组化合物的碱性,并依从强到弱顺序排列。
(1)甲胺、二甲胺、苯胺、N-甲基苯胺、二苯胺
(2)氢氧化四甲铵、乙酰胺、二甲胺、苯胺、对甲苯胺
(3)乙胺、三乙胺、N-乙基-对甲基苯胺、N-乙基苯胺、N,N-二乙基苯胺
4.用化学方法区别下列各小组化合物。
(1)苄胺、苯胺 (2)对甲基苯胺、N-甲基苯胺、N,N-二甲基苯胺
(3)苯胺、对氨基苯甲酸、苯酚 (4)苯乙酮、苯酚、苯胺
5.完成下列反应式。
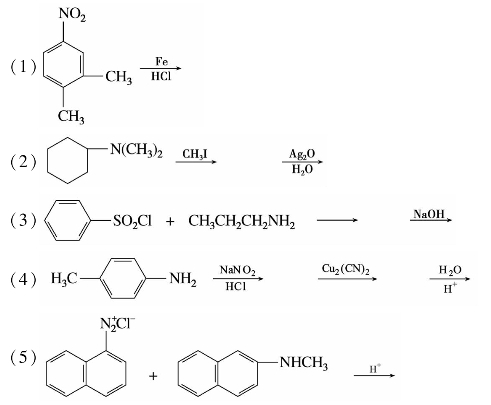

6.用化学方法分离下列各组化合物。
(1)对甲苯酚、对甲苯胺 (2)环己烷、环己胺 (3)二乙胺、三乙胺
(4)苯甲酸、对甲苯酚、对甲苯胺 (5)苯胺、苯酚 (6)硝基苯、苯胺
7.以苯为原料及所需的无机试剂合成下列化合物。
(1)2,4,6-三溴苯甲酸 (2)3,5-二溴甲苯 (3)苯甲腈
(4)间氨基苯酚 (5)乙酰苯胺 (6)间二氯苯
8.下列化合物能否与重氮盐发生偶合反应?用反应式表示反应的结果。
(1)乙酰苯胺 (2)N,N-二甲基苯胺
(3)3-羟基-N-甲基苯胺 (4)1-甲基-2-萘酚
9.推断结构。
(1)有一种胺,分子式为C2H9N,此胺在0℃与HNO2作用,有黄色油状液体析出。试写出此胺的结构式及其与HNO2作用的反应式。
(2)化合物A的分子式为C6H15N,能溶于稀盐酸,室温时与亚硝酸作用得到氮气和B,B能进行碘仿反应,与浓硫酸共热得到C;C能使高锰酸钾溶液褪色,并氧化分解为乙酸和2-丁酮试推定A、B、C的结构,并以反应式说明推理过程。
(3)某化合物的分子式为C7H7O2N(A),无碱性,还原后得C7H9N(B),具有碱性。B在低温下及硫酸存在下,和亚硝酸作用生成C7H7N2HSO4(C)。加热C放出氮气,并生成对甲苯酚。在碱性溶液中,化合物C与苯酚作用生成具有颜色的化合物C13H12ON2。试推出A的结构,并写出各步的反应式。






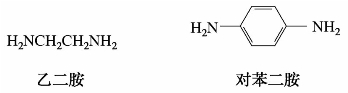
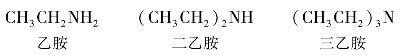

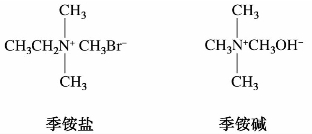





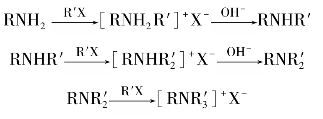

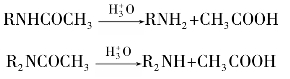




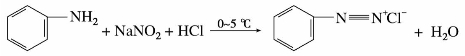



















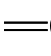 N—)的两个氮原子都是三价的,是共价化合物。
N—)的两个氮原子都是三价的,是共价化合物。















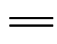 C、C
C、C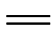 O、—CO—CO—、—COOH、—CHO、—NO
O、—CO—CO—、—COOH、—CHO、—NO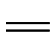 N—、
N—、 、
、 等。含有发色团的有机物称为色原体。
等。含有发色团的有机物称为色原体。







 CHCN)
CHCN)