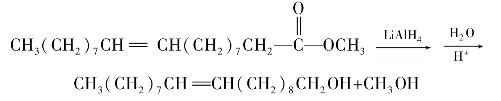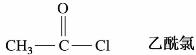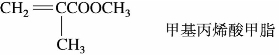-
1.1高职高专生物技术类专业系列规划教材※编委会※
-
1.2高职高专生物技术类专业系列规划教材※参加编写单位※
-
1.3总 序
-
1.4前 言
-
1.5目录
-
1.6项目1 有机化合物概述
-
1.6.1任务1.1 有机化学的研究对象和任务
-
1.6.2任务1.2 有机化合物的特性
-
1.6.3任务1.3 有机化合物的结构
-
1.6.4任务1.4 有机化学反应
-
1.6.5综合练习1
-
1.7项目2 链 烃
-
1.7.1任务2.1 烷 烃
-
1.7.2任务2.2 烯 烃
-
1.7.3任务2.3 炔 烃
-
1.7.4任务2.4 二烯烃
-
1.7.5综合练习2
-
1.8项目3 环 烃
-
1.8.1任务3.1 脂环烃
-
1.8.2任务3.2 单环芳烃
-
1.8.3任务3.3 多环芳烃和非苯系芳烃
-
1.9项目4 旋光异构
-
1.9.1任务4.1 物质的旋光性
-
1.9.2任务4.2 分子的手性和对映体
-
1.9.3任务4.3 含一个手性碳原子化合物的对映异构体
-
1.9.4任务4.4 含两个手性碳原子化合物的对映异构体
-
1.9.5综合练习4
-
1.10项目5 卤代烃
-
1.10.1任务5.1 卤代烃的分类、命名及同分异构现象
-
1.10.2任务5.2 卤代烃的性质
-
1.10.3任务5.3 卤代烯烃和卤代芳烃
-
1.10.4任务5.4 重要的卤代烃
-
1.10.5综合练习5
-
1.11项目6 醇、酚、醚
-
1.11.1任务6.1 醇
-
1.11.2任务6.2 酚
-
1.11.3任务6.3 醚
-
1.11.4任务6.4 硫醇、硫酚和硫醚
-
1.12项目7 醛、酮、醌
-
1.12.1任务7.1 醛和酮的分类及命名
-
1.12.2任务7.2 醛和酮的物理性质
-
1.12.3任务7.3 醛和酮的化学性质
-
1.12.4任务7.4 重要的醛和酮
-
1.12.5任务7.5 醌
-
1.12.6综合练习7
-
1.13项目8 羧酸及其衍生物
-
1.13.1任务8.1 羧 酸
-
1.13.2任务8.2 羧酸衍生物
-
1.13.3综合练习8
-
1.14项目9 含氮化合物
-
1.14.1任务9.1 硝基化合物
-
1.14.2任务9.2 胺
-
1.14.3任务9.3 重氮化合物和偶氮化合物
-
1.14.4任务9.4 腈
-
1.14.5综合练习9
-
1.15项目10 杂环化合物和生物碱
-
1.15.1任务10.1 五元杂环化合物
-
1.15.2任务10.2 六元杂环化合物
-
1.15.3任务10.3 生物碱
-
1.15.4综合练习10
-
1.16项目11 生命有机化合物
-
1.16.1任务11.1 糖类化合物
-
1.16.2任务11.2 脂类化合物
-
1.16.3任务11.3 氨基酸和蛋白质
-
1.16.4综合练习11
-
1.17项目12 萜类和甾体化合物
-
1.17.1任务12.1 萜类化合物
-
1.17.2任务12.2 甾体化合物
-
1.17.3综合练习12
-
1.18有机化学实验模块
-
1.18.1模块一 有机化学实验的一般知识
-
1.18.2模块二 基本操作和实验技术
-
1.18.2.1实验1 简单玻璃管操作
-
1.18.2.2实验2 测定熔点
-
1.18.2.3实验3 蒸馏和沸点测定
-
1.18.2.4实验4 重结晶
-
1.18.2.5实验5 萃 取
-
1.18.2.6实验6 简单分馏
-
1.18.3模块三 有机化合物的性质实验
-
1.18.3.1实验1 烃的性质
-
1.18.3.2实验2 醇、酚、醚的性质
-
1.18.3.3实验3 醛、酮的性质
-
1.18.3.4实验4 羧酸及其衍生物的性质
-
1.18.3.5实验5 胺的性质
-
1.18.3.6实验6 糖的性质
-
1.18.3.7实验7 糖的旋光度测定
-
1.18.4模块四 有机化合物的制备实验
-
1.18.4.1实验1 乙酸乙酯的制备
-
1.18.4.2实验2 乙酰水杨酸的制备
-
1.18.4.3实验3 乙酰苯胺的制备
-
1.18.4.4实验4 无水乙醇的制备及折光率的测定
-
1.18.5附 录 常用有机试剂及其配制方法
-
1.19参考文献
1
有机化学
1.13.3
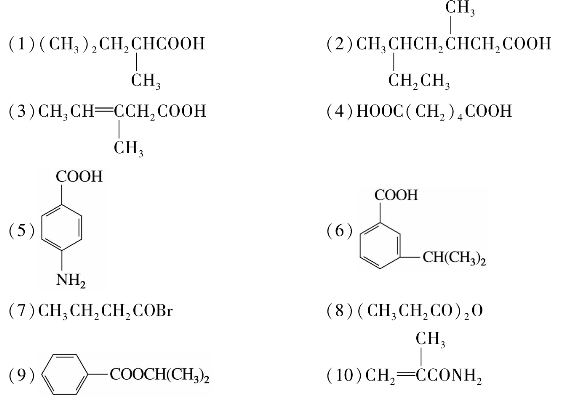
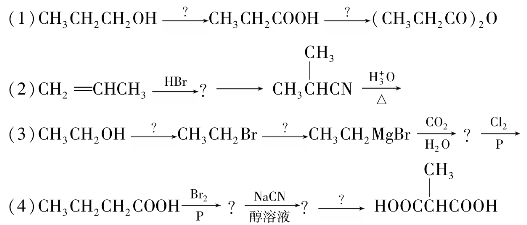
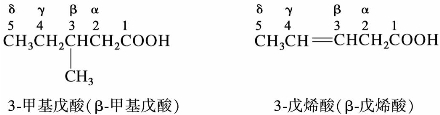
综合练习8
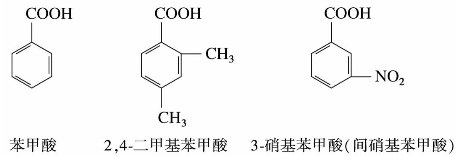
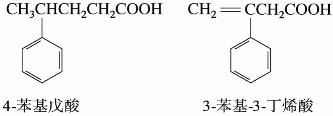
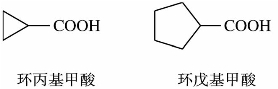
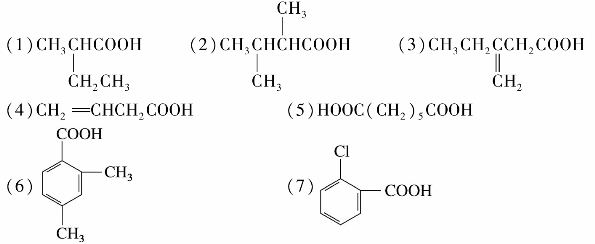
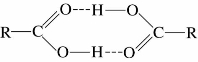
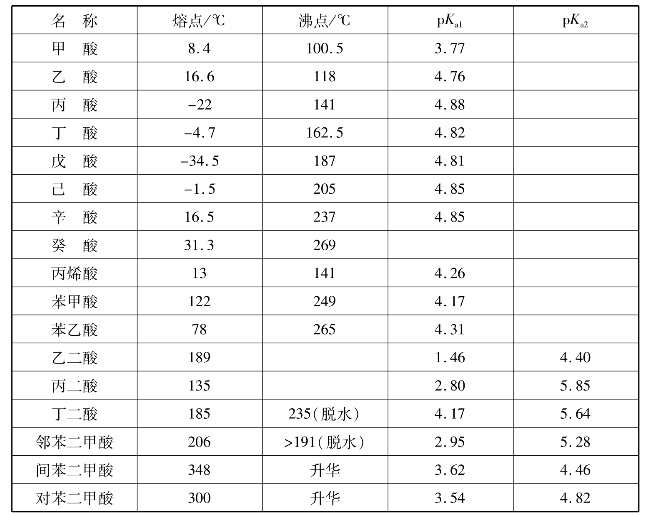
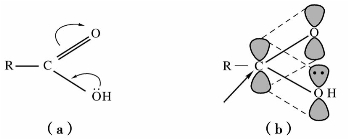

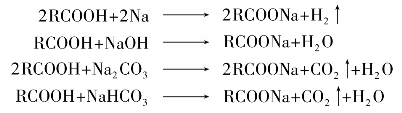
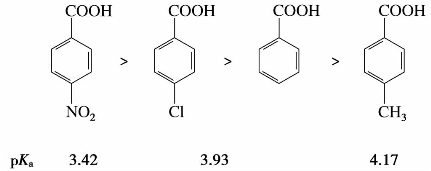
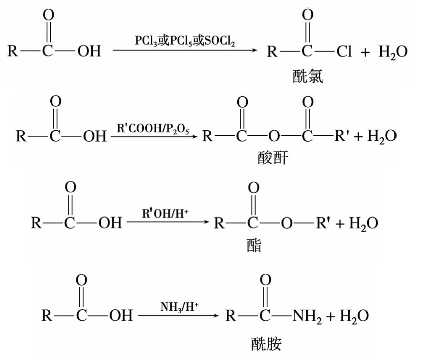
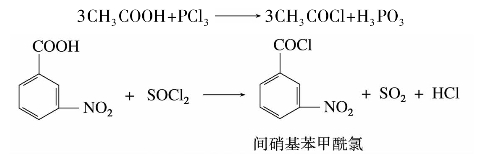
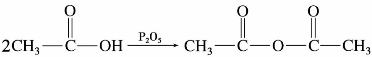
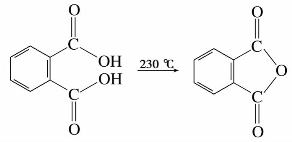
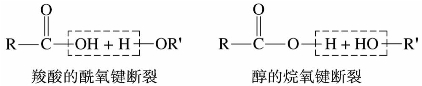
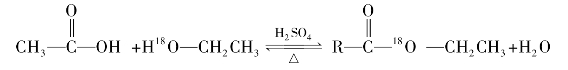
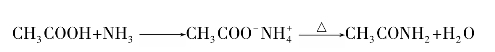
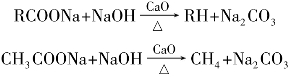

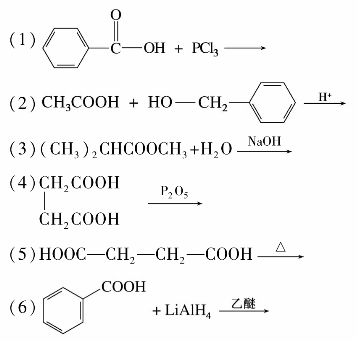
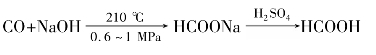

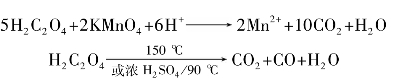
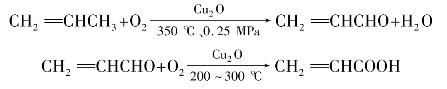

 )称为酰基。
)称为酰基。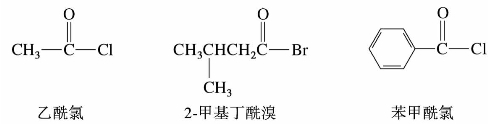
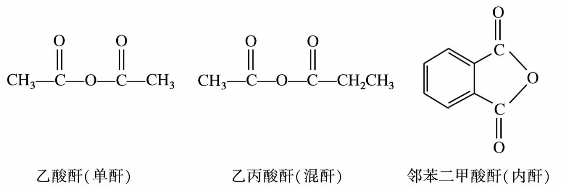

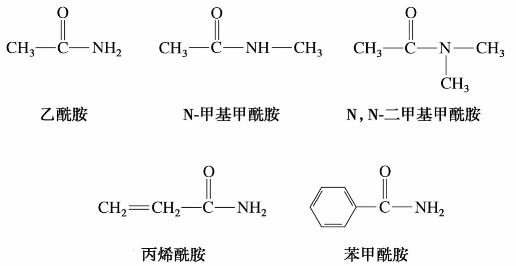
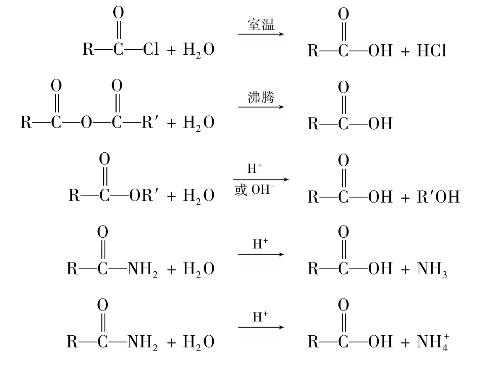
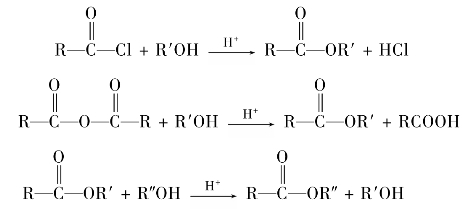

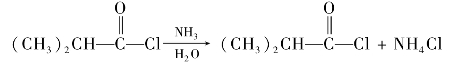
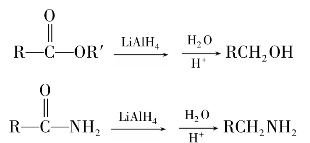
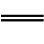 C双键,因此在有机合成中常被采用,利用酯的还原反应,可以用高级脂肪酸的酯制备高级脂肪醇。例如:
C双键,因此在有机合成中常被采用,利用酯的还原反应,可以用高级脂肪酸的酯制备高级脂肪醇。例如: