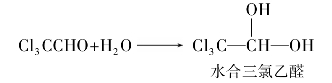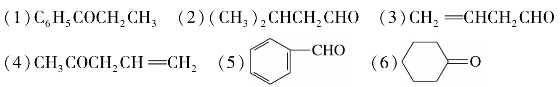4)醛、酮的同分异构
醛分子中,由于醛基总是位于碳链的链端,所以醛只有碳链异构体;而酮分子中,由于酮基位于碳链中间,除碳链异构外,还有酮基的位置异构。例如:
a.戊醛有4种同分异构体,它们均为碳链异构体:
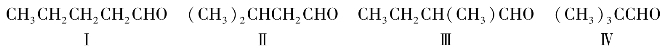
b.戊酮有3种构造异构体:
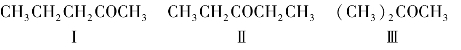
其中,戊酮Ⅰ与Ⅲ互为碳链异构体,Ⅰ与Ⅱ互为位置异构体。
含有相同碳原子数的饱和一元醛、酮,具有共同的分子式C nH2nO,它们互为同分异构体。这种异构体属于官能团不同的构造异构体。例如,丙醛(CH3CH2CHO)和丙酮(CH3COCH3)互为构造异构体。
7.1.2 醛和酮的命名
1)习惯命名法
醛的习惯命名和伯醇相似,只要把“醇”字改成“醛”字便可。

命名酮时,只需在羰基所连接的两个烃基名称后加上“酮”字。脂肪混酮命名时,要把“次序规则”中较优的烃基写在后边;但芳基和脂基的混酮要把芳基写在前面。例如:
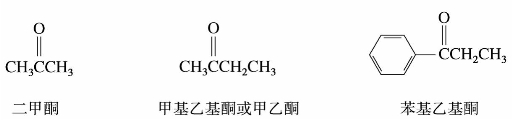
2)系统命名法
按照IUPAC命名法,选择含有羰基的最长碳链为主链,从醛基一端或从靠近羰基一端给主链编号。醛基因处在链端,编号总是1,在命名醛时没有必要标出其位次,可以省略,而酮分子中的羰基位置必须标出。
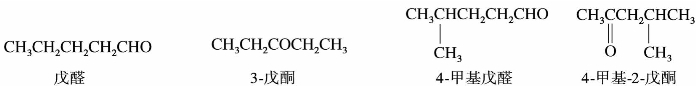
不饱和醛、酮的命名时,应选择同时含有羰基和不饱和键的最长碳链作为主链,主链编号时是从靠近羰基一端给主链编号,称为某烯醛或某烯酮,并在名称中标明不饱和键的位次。
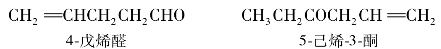
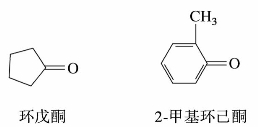
脂环酮称为环某酮。
练习7.1
命名或写出下列化合物的结构式。
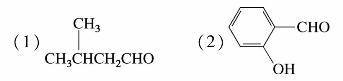
(3)新戊醛 (4)邻羟基苯甲醛 (5)苯基甲基酮 (6)3-甲基丁醛
任务7.2 醛和酮的物理性质
常温下除甲醛是气体外,12个碳原子以下的脂肪醛、酮都是液体,高级脂肪醛、酮为固体。
羰基是极性基团,故醛、酮分子间引力大。与相对分子质量相近的烷烃和醚相比,醛酮的沸点较高。又由于醛、酮分子间不能形成氢键,所以沸点比相对分子质量相近的醇低。
由于醛、酮的羰基是亲水基,能与水中的氢原子形成氢键,所以低级的醛、酮在水中有一定的溶解度,如甲醛、乙醛、丙醛和丙酮可与水混溶,其他醛、酮随分子量增大,水溶性降低。醛、酮都易溶于有机溶剂。
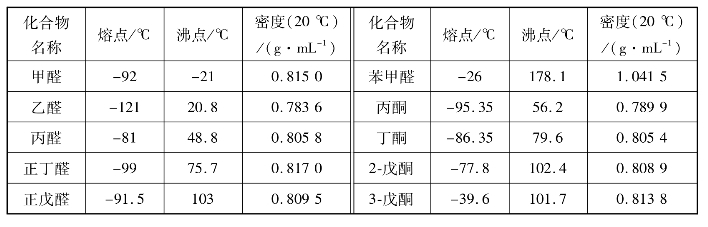
低级醛具有强烈刺激性气味,中级(C8~C13)醛、酮在较低浓度时往往具有香味,常用于香料工业中。有些天然香料中都含有酮基,如樟脑、麝香等。一些常见的一元醛、酮的物理常数见表7.1。
表7.1 一元醛酮的物理常数
任务7.3 醛和酮的化学性质
羰基是醛、酮的官能团。羰基上的碳氧双键和烯烃中的碳碳双键相似,能起加成反应。但是,烯烃中的碳—碳双键极性很小或没有极性,而醛、酮中的碳氧双键,由于氧原子吸电子效应,使得π电子云变形,氧原子带部分负电荷,碳原子上带部分正电荷。所以羰基有较大极性。
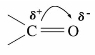
由于醛、酮化合物中羰基的极性,使得它们化学性质非常活跃,除了羰基的加成反应之外,还能发生多种化学反应。
7.3.1 羰基上的加成反应
烯烃中,碳—碳双键的加成反应是亲电加成反应,即亲电试剂(正电部分)先进攻π键,形成碳正离子,后者再与试剂的负电部分结合生成最终产物。
羰基的加成反应,首先是亲核试剂(负电部分)进攻带有部分正电荷的碳原子,形成较稳定的氧负离子,后者再与试剂的正离子部分结合生成最终产物。因此,醛、酮中羰基上的反应属于亲核加成反应,该反应受酸碱催化。
酸催化:当存在酸时,羰基氧首先质子化。

其结果则是增加了羰基碳的正电性,使它更容易受亲核试剂进攻。即酸催化是增大羰基化合物的活性。
碱催化:当存在碱时,则是增大亲核试剂的活性或浓度,从而加大羰基亲核加成的速率。例如,氢氰酸是弱酸,溶液中CN-浓度很低,氢氰酸与羰基的亲核加成反应很慢。当加入1滴氢氧化钠溶液或氢氧化钾溶液则反应很快,可在几分钟内完成。其原因是碱促使氢氰酸电离,从而增大了CN-的浓度,加酸则相反。作为亲核试剂,CN-的活性显然比氢氰酸要大得多。
醛和酮进行亲核加成的难易程度是不同的。酮羰基连有两个烃基,使过渡态更拥挤,而两个烃基的推电子性也使过渡态不稳定,由于电子效应和立体阻碍两个因素,亲核加成反应活性酮比醛小,且羰基所连烃基的体积越大,立体阻碍越大,越不利于亲核加成。综上所述,亲核加成反应活性次序大致如下:
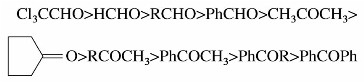
1)与含碳亲核试剂的加成反应
(1)与格氏试剂加成
格氏试剂中,与金属镁相连的碳原子集中了比较多的负电荷。镁带有正电荷,C—Mg键是强极性键。
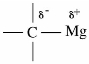
碳作为亲核试剂进攻羰基。
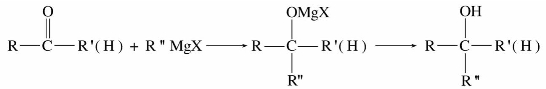
烃基不太大的酮和所有的醛都可以发生上述反应,选择不同的羰基化合物最终可得不同类型的醇。甲醛与格式试剂反应,然后水解可以得到伯醇;其他醛与格式试剂反应,然后水解得到仲醇;而酮与格式试剂反应,然后水解得到叔醇。
(2)与氢氰酸加成
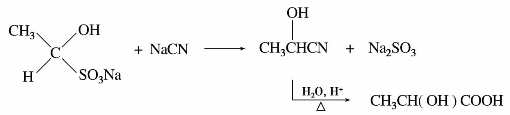
氢氰酸解离后产生的氰基负离子(-CN)有亲核性。但氢氰酸是弱酸,往往加入碱,促使它解离,以产生更多的氰基负离子。醛、大多数甲基酮和少于8个碳原子的环酮都可以与氢氰酸发生亲核加成反应,产物α-羟基腈(氰醇)。
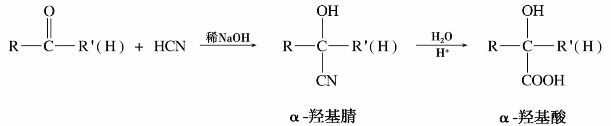
产物α-羟基腈在酸性条件下水解,得到α-羟基酸。有机合成中可以利用这个反应制备多一个碳原子的羧酸。
由于氢氰酸剧毒,又易挥发(沸点26℃),为了安全起见,可将醛或酮与氰化钠或氰化钾水溶液混合,然后慢慢加入硫酸,使生成的氢氰酸立即和醛或酮反应。虽然氰化钠或氰化钾的毒性也很大,但不易挥发,容易控制。即使这样,实验仍需在通风橱进行。
(3)醇醛缩合(羟醛缩合)
在稀碱的作用下,两分子含有α-氢的醛(酮)可以相互作用,生成α、β-不饱和醛(酮)的反应,称为羟醛缩合反应。

在形成β-羟基醛(酮)后,羟基和α-H很快以水的形成脱除,最终产物是α,β-不饱和醛(酮)。酮发生此反应要比醛难一些。
这个反应表现出羰基化合物的两个特性,一个是α-H的活泼性,另一个就是羰基上的亲核加成。反应中用的碱通常是稀氢氧化钠水溶液,也可以用醇钠,作为亲核试剂的醛必须具有α-H,这是该反应的前提。
2)与含氧亲核试剂的加成
(1)与醇的加成
醛在无水氯化氢的催化剂存在下,与醇发生加成,生成半缩醛。
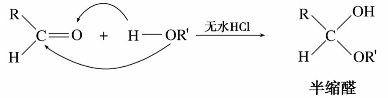
半缩醛既是醚又是醇,结构很不稳定。在无水强酸存在下,与另一分子醇缩合,失去一分子水形成相对稳定的缩醛。半缩醛容易分解为原来的醛。
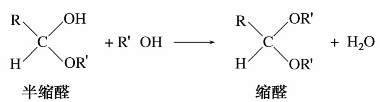
缩醛具有二醚结构,对碱和氧化剂稳定。但在稀酸溶液中,室温下就可以水解,生成原来的醛和醇。
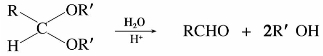
在有机合成中常用生成缩醛来保护醛基。
酮在一般情况下与醇的加成反应很慢,生成缩酮很困难。即便是在酸催化下,酮一般也不和一元醇反应,但可与某些二元醇反应,生成环状缩酮。为使平衡向右进行,需不断除去水。
(2)与水加成
水也可以作为亲核试剂,但它的亲核性比醇弱。只有个别羰基化合物可以与之加成,例如:
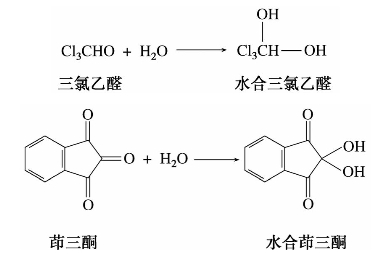
α-碳上基团的强吸电子效应,大大降低了羰基原子上的电子云密度,这就使亲核性很弱的试剂也能发生反应。
3)与含氮亲核试剂的加成
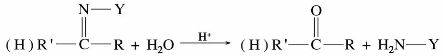
氨及某些衍生物是含氮的亲核试剂。一般的羰基化合物与氨反应,得不到稳定的加成产物,而氨的某些衍生物,如伯胺、羟胺、苯肼等能与羰基加成,继而分子内脱水,生成稳定的加成缩合产物。通式如下:
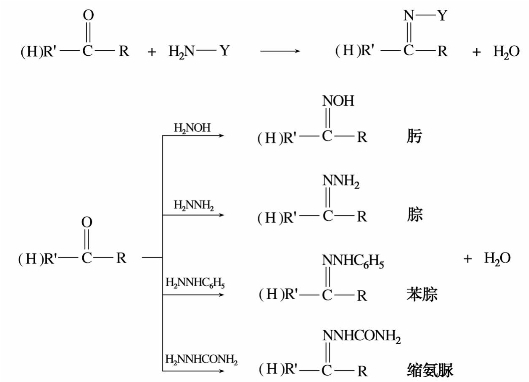
醛、酮与氨衍生物反应后的生成物大部分是固体,且具有一定的熔点,在化学手册或是文献上可以查到。因此只要测定反应产物的熔点,与文献手册上的相比较,就能确定原来是何种醛、酮。
当醛或酮滴加到2,4-二硝基苯肼溶液中时,生成的腙通常是橙黄色结晶,因此可利用此反应来鉴别醛、酮。上述这些氨的衍生物也称之为羰基试剂。羰基试剂的亲核性来源于氮上的未共用电子对,其亲核能力弱于带负电荷的离子。因此可通过加弱酸增加羰基的亲电性,使其有利于亲核试剂进攻。但不能加强酸,因强酸与氮上未共用电子对结合,使氨基失去亲核性。
醛、酮与氨衍生物的反应是可逆的,肟、腙在稀酸或稀碱条件下可水解生成原来的醛、酮。因此,这些反应又可用来分离提纯醛、酮。例如:
4)与含硫亲核试剂的加成
亚硫酸氢钠中硫原子上的未共用电子对具有亲核性,可以与某些羰基化合物起加成反应。
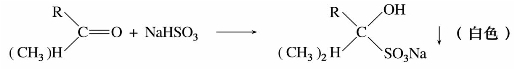
例如:
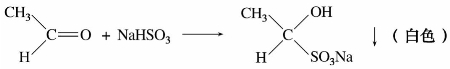
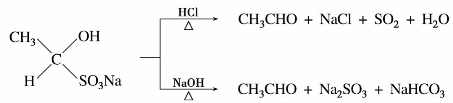
醛、脂肪族甲基酮和少于8个碳原子的环酮可以和饱和亚硫酸氢钠溶液(约40%)发生亲核加成反应。产物α-羟基磺酸钠能溶于水,但不溶于饱和的亚硫酸氢钠水溶液,而以无色结晶析出,与酸或碱共热,又得到原来的醛、酮,所以此反应可用于醛、酮的鉴别与分离提纯。例如:
加成物还可与等量氰化钠作用生成α-羟腈,用这种方法制备的α-羟腈可以避免直接使用挥发性大、毒性高的HCN。
将α-羟基腈进一步水解得到α-羟基酸。
如:
7.3.2 醛和酮的其他反应
1)α-卤代反应及卤仿反应
在酸碱催化下,醛、酮分子中的α-氢原子可以逐步被卤原子取代,生成α-卤代醛酮。
酸催化易控制在一元卤代。碱催化,卤代反应很快,一般不易控制生成一元、二元卤代物,而是生成三卤代物。
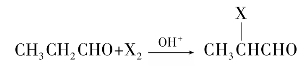
如果羰基连有甲基,如乙醛、丙酮、丁酮等,在卤素碱性溶液或次卤酸钠的作用下,甲基上的3个α-氢均被卤原子所取代。生成的三卤代物,由于羰基和三个卤原子的强吸电子作用,使得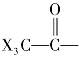 中碳—碳键不再牢固,使碳—碳键电子云密度大大下降而变得很弱,在碱的作用下发生断裂,生成卤仿和相应的羧酸盐。因为反应最终生成卤仿,故称卤仿反应。如:
中碳—碳键不再牢固,使碳—碳键电子云密度大大下降而变得很弱,在碱的作用下发生断裂,生成卤仿和相应的羧酸盐。因为反应最终生成卤仿,故称卤仿反应。如:
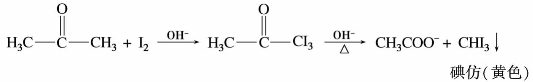
如果使用碘的氢氧化钠溶液(即次碘酸钠溶液)进行反应,生成的是碘仿(CHI3)。碘仿是不溶于水的亮黄色晶体,熔点119℃,常利用碘仿反应来鉴别醛、甲基酮。
次卤酸钠或卤素的氢氧化钠溶液具有一定的氧化性,它可将含有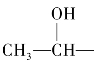 结构的醇氧化成相应的醛、甲基酮,因此用碘仿反应也可以鉴别这种结构的醇。碘仿反应时缩短碳链的反应之一,也可用来制取某些羧酸。
结构的醇氧化成相应的醛、甲基酮,因此用碘仿反应也可以鉴别这种结构的醇。碘仿反应时缩短碳链的反应之一,也可用来制取某些羧酸。
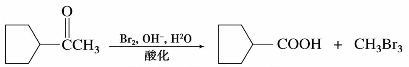
2)氧化反应
醛的羰基碳上有氢,可以进一步被氧化成相应的羧酸。某些弱氧化剂如托伦(Tollen)试剂或斐林(Fehling)试剂等,就可把醛氧化为羧酸,空气中的氧也能将醛氧化,所以存放时间较长的醛中常含有少量的羧酸。但是在相同条件下酮不被氧化,所以利用此反应可以区别醛和酮。
托伦试剂是氢氧化银氨溶液,其中含有银络离子,它由硝酸银、氢氧化钠水溶液和氨水配制而成,银离子可将醛氧化为羧酸,本身被还原为黑色悬浮的金属银,如果反应用的试管壁非常清洁,则生成的银就附着在管壁上,形成光亮的银镜,所以这个反应也叫银镜反应。这是个弱氧化剂,有较好的选择性,醛烃基中的双键不受其影响。
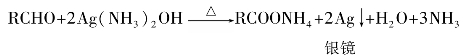
斐林溶液是碱性铜络离子的溶液。硫酸铜的铜离子和碱性酒石酸钾钠成为一个深蓝色的络离子溶液。酒石酸钾钠可以和Cu2+形成络离子,从而避免生成Cu(OH)2沉淀。在反应中,Cu2+络离子被还原成红色的氧化亚铜,从溶液中沉淀出来,蓝色消失,而醛氧化成酸。斐林溶液只还原脂肪醛,对芳香醛不起作用,所以?林试剂既可以用来鉴别脂肪醛与酮,又可以用来区别脂肪醛和芳香醛。

甲醛的还原性比其他醛强,与斐林溶液反应将碱性铜络离子还原成金属铜,附着在管壁上,形成光亮的铜镜,也称为铜镜反应。
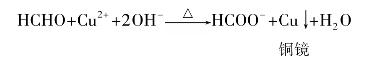
酮虽不被弱氧化剂氧化,但在强烈的氧化条件下,羰基与两侧碳原子间的键可分别断裂,生成几种小分子羧酸的混合物。
托伦试剂与斐林试剂都不能氧化醛分子中的碳碳双键和碳碳叁键,在有机合成上可以用来使不饱和醛氧化成不饱和羧酸,是良好的选择性氧化剂。
3)还原反应
在不同的条件下,某些还原剂可将醛、酮还原为相应的醇、烃。
(1)催化氢化
醛或酮经催化氢化可分别还原为伯醇或仲醇:
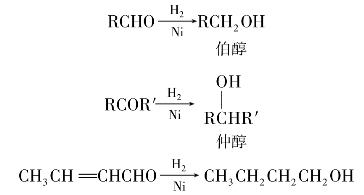
用催化氢化的方法还原羰基化合物时,若分子中还有其他可被还原的基团,如C C等,则也可能被加氢成为饱和键。例如:
C等,则也可能被加氢成为饱和键。例如:
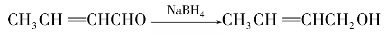
(2)用金属氢化物还原
常用的金属氢化物是硼氢化钠(NaBH4)、四氢化铝锂(LiAlH4)和异丙醇铝(Al[OCH(CH3)2]3)。它们是选择性还原剂,只还原醛、酮生成相应的醇。例如:
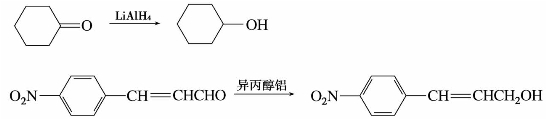
(LiAlH4极易水解,反应要在无水条件下进行。)
(3)还原成烃
醛、酮在酸性条件下与锌汞齐共热,可把羰基还原为亚甲基,这一反应又称克莱门森(Clemmensen)还原法,此法只适用于对酸稳定的化合物。
克莱门森反应中间并不经过醇的阶段,反应的最后结果生成了亚甲基。对于酮,特别是芳香酮。这个反应具有重要的意义,在有机合成中,常用来合成直链烷基苯。
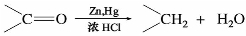
例如:

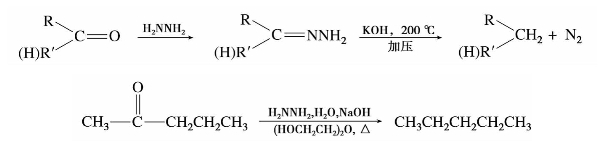
克莱门森反应是在强酸条件下进行,仅适用于对酸稳定的化合物。对酸不稳定而对碱稳定的醛、酮,可以使用沃尔夫-凯惜纳还原法。该法是将醛或酮与无机肼反应生成腙,然后将腙在乙醇钠或氢氧化钾中,与高压下加热,使之分解,放出氮气,羰基还原为亚甲基。
我国有机化学家黄鸣龙对这个方法进行了改进。他把醛或酮与氢氧化钠或氢氧化钾、85%水合肼(有时可用50%水合肼)以及一种高沸点的水溶性溶剂二甘醇或三甘醇一起回流加热生成腙,然后蒸出水和过量的肼,继续在200℃加热回流,使腙分解放出氮气,羰基变为亚甲基。这一改进,称为沃尔夫-凯惜纳(Wolft-Kishner)-黄鸣龙还原法。此法适用于对酸不稳定而对碱稳定的化合物还原。它不需要使用难以制备和价格昂贵的无水肼,可以在常压下反应,反应由几十个小时缩短至1小时便可完成,并且大幅提高了产率(80%~95%)。其另一优点是反应一步完成,无需分离出腙,因而在有机合成中被广泛应用。
4)歧化反应
没有α-氢的醛与强碱共热,则一分子醛氧化成酸,另一分子醛还原为醇,这种氧化还原反应称为歧化反应,或称康尼查罗(Cannizzaro)反应。
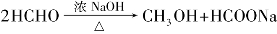
两种不同的无α-H的醛可以进行交叉的歧化反应。生成4种产物,不易分离,在合成上通常没有什么实际意义。但是,如果甲醛和另一种不含α-H的醛进行交叉歧化反应,由于甲醛具有较强的还原性,总是被氧化为甲酸,另一种醛总是被还原成醇。这一反应在有机合成上却是很有用的——把芳醛还原成芳醇。
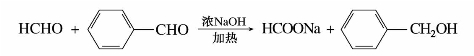
往往甲醛氧化成酸,苯甲醛还原成醇。
练习7.2
1.用简便合理的方法除去正丁醇中含有的少量正丁醛。
2.用指定原料合成指定化合物。

3.以乙醛为原料合成2-乙基-1-己醇。
4.用简便的化学方法鉴别下列化合物。
(1)甲醛、乙醛、丙酮和苯乙醛 (2)1-丁醇、2-丁醇、丁醛和丁酮
任务7.4 重要的醛和酮
7.4.1 甲醛
甲醛又名蚁醛,在常温下是无色、对黏膜有刺激性的气体,易溶于水,沸点-21℃,与空气混合后遇火爆炸,爆炸范围为7%~73%(体积分数)。含8%甲醇的40%甲醛水溶液通常称为福尔马林(Formalin),福尔马林可使蛋白质变性,对皮肤有强腐蚀性,常用作消毒剂和动物标本及尸体防腐剂。农业上用福尔马林来拌种,以防止稻瘟病。
甲醛分子中只有两个氢原子和一个羰基,这种特殊的构造导致甲醛具有一些特殊化学性质。和其他醛相比,它的立体阻碍很小,性质更活泼,有较强的还原性,易氧化成甲酸,并进一步氧化成二氧化碳和水。
甲醛容易发生自身的羰基加成生成聚合度不同的各类聚合物。例如,在常温下,甲醛气体能自动聚合为环状三聚甲醛。60%~65%的甲醛水溶液在少量硫酸存在下煮沸,也可聚合为三聚甲醛。
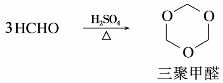
三聚甲醛为无色晶体,熔点62℃,在中性和碱性条件下相当稳定。三聚甲醛没有醛的性质,但在酸性环境下加热,容易解聚重新生成甲醛。
小心蒸发甲醛水溶液,甲醛水合物分子之间失水,可以生成多聚甲醛。多聚甲醛和三聚甲醛为白色的无定形固体。多聚甲醛的聚合度在12以下是水溶性的,大于12时是不溶于水的。通常聚合度为8~100。仍具甲醛的刺激气味,受热后又可分解为甲醛。将甲醛制成聚合体,便于贮存和运输,是气态甲醛的方便来源。甲醛的高聚物是重要的合成树脂和工程塑料的原料。
福尔马林溶液即使在低温下,放置时间过久,也会因析出多聚甲醛而变混浊。
纯甲醛在三正丁胺催化下,可以聚合为相对分子质量高达数万至数十万的线性高分子化合物——聚甲醛。聚甲醛是一种性能优良的工程塑料,化学稳定性好,又有较高的机械强度。
甲醛是一种非常重要的化工原料,大量用于制造酚醛、脲醛、聚甲醛和三聚氰胺等树脂以及各种粘结剂。甲醛还可以用来生产季戊四醇、乌洛托品以及其他药剂及染料。
甲醛很容易与氨或铵盐作用,缩合成六亚甲基四胺,俗称乌洛托品(Urotropine)。
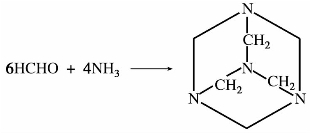
六亚甲基四胺是无色晶状固体,熔点263℃,易溶于水,具有甜味。可用做酚醛塑料的固化剂,氨基塑料的催化剂,织品的防缩剂及橡胶硫化的促进剂。在医药上可用做泌尿系统消毒剂。乌洛托品与浓硝酸作用,可以制取强烈的炸药。
工业上采用甲醇空气氧化法生产甲醛。以甲醛蒸气和空气的混合物为原料,在600℃高温下,通过银催化剂,使甲醇转化为甲醛。
7.4.2 乙醛和三氯乙醛
乙醛又名醋醛,是一种无色,具有挥发性并有刺激气味的液体,沸点20.8℃。易溶于水和乙醇等有机溶剂中。乙醛蒸气与空气形成爆炸性混合物,爆炸极限40%~57%(体积分数),厂房空气中乙醛最大允许浓度为0.1 mg/L。
乙醛是有机合成的重要原料,工业上可由乙炔加水制得。乙醛与甲醛一样,易发生聚合反应,在少量浓硫酸作用下,室温下聚合生成三聚乙醛。三聚乙醛在酸性加热条件下,解聚生成乙醛。
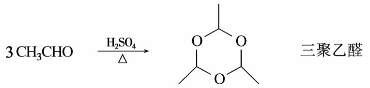
三聚乙醛是一种沸点124℃的液体,不易挥发,难溶于水,具有醚和缩醛的性质,很稳定,不易氧化。加酸蒸馏时,可以解聚成乙醛。由于乙醛的沸点太低,因此,工业上常制成三聚乙醛来贮存乙醛。在0℃或0℃以下,用干燥氯化氢处理,乙醛则聚合成四聚乙醛。
四聚乙醛是无色固体,不溶于水,溶于乙醚,熔点246℃,但在112~115℃可以升华,在升华的同时部分分解。在酸中加热能完全解聚为乙醛。四聚乙醛的化学性质也很稳定,和三聚乙醛一样,四聚乙醛也没有醛的性质。
乙醛是重要的有机化工原料,主要用于生产醋酸、醋酐、醋酸乙酯、正丁醇、季戊四醇等。
工业上用乙炔水合法生产乙醛。此法工艺成熟,收率亦高,但汞盐催化剂毒性较大,存在污染环境问题,原料乙炔价格亦较昂贵。随着石油化学工业的发展,以乙烯为原料,氯化钯和氯化铜的水溶液为催化剂,用空气或氧气可将乙烯氧化为乙醛,反应的收率很高。
三氯乙醛是具有刺激性的无色液体,沸点98℃。由于在三氯乙醛分子中,α-碳上3个氯原子的吸电子诱导效应,使得它在水溶液中易生成水合三氯乙醛。
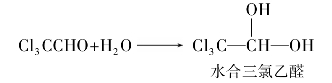
水合三氯乙醛俗称水合氯醛,为无色透明晶体,熔点57℃。它有快速催眠作用,在兽医上常用作催眠剂和麻醉剂。
三氯乙醛在工业上是制备敌百虫、敌敌畏等有机磷农药的原料。
7.4.3 丙酮
丙酮是无色有愉快香味的液体,沸点56.2℃,易挥发、易燃烧,易溶于水和乙醇、乙醚等各种有机溶剂中,是工业和实验室常用的有机溶剂之一,能溶解许多树脂、油脂、涂料、炸药、胶片、化学纤维等。丙酮也是各种维生素和激素生产过程中的萃取剂。
丙酮可由糖类经丙酮-丁醇发酵制得,也可由异丙苯氧化制备。
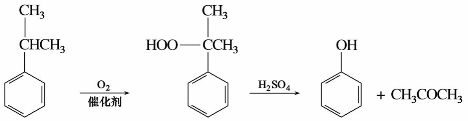
丙酮具有典型的酮的化学性质,是重要的有机化工原料,用来制造有机玻璃、环氧树脂、碘仿、氯仿、乙烯酮等重要的有机原料。
7.4.4 苯甲醛
苯甲醛是有苦杏仁味的无色液体,沸点178.1℃。它常与糖类物质结合存在于杏仁、桃仁等许多果实的种子中,尤以苦杏仁中含量最高,所以又将苯甲醛称为苦杏仁油。苯甲醛在空气中放置易被氧化成苯甲酸,光对自动氧化反应起催化作用,长期贮存苯甲醛时,应避光,应隔绝空气。苯甲醛有毒。
苯甲醛是制备香料和染料等的原料。同时,苯甲醛也可以用于制造肉桂酸、苯甲酸苄酯、合成香料等。
在气相或液相中,将甲苯氧化为苯甲醛是工业上生产苯甲醛的办法。例如,在气相中,用五氧化二钒做催化剂,400℃,用空气氧化甲苯;或者在液相中,用二氧化锰的浓硫酸溶液氧化甲苯。
7.4.5 环己酮
环己酮是无色油状液体,有丙酮的气味,沸点是155.6℃,微溶于水,较易溶于乙醇、乙醚等的溶剂。如果皮肤经常与环己酮接触会引起皮炎,其蒸气对人的视网膜和上呼吸道黏膜也具有刺激性。
环己酮具有典型的酮的化学性质,所以环己酮既是溶剂,又是合成己二酸和己内酰胺的原料。
环己酮通常以环己烷氧化所得环己酮与环己醇的混合物为原料,用氧化锌为主的催化剂,在常压和400℃左右高温下进行催化脱氢制得。
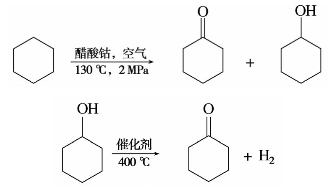
任务7.5 醌
7.5.1 醌的命名
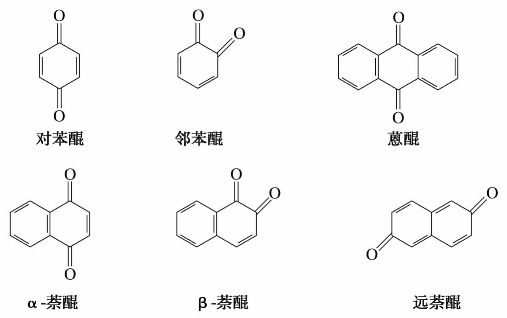
醌是一类共轭的环状不饱和二酮,通常把含有共轭环己二烯二酮构造的一类有机化合物称为醌,它是根据其相应的芳烃进行分类的,常见的醌类有苯醌、萘醌和蒽醌。
醌的命名是将其作为芳烃的衍生物来命名的。由苯得到的醌称为苯醌,由萘得到的醌称为萘醌,由蒽得到的醌称为蒽醌等。例如:
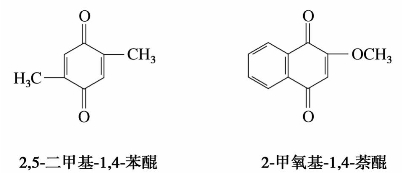
醌的衍生物是以醌作为母体,将支链看作取代基来命名的。例如:
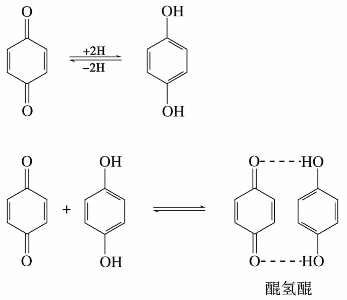
醌类化合物中最简单的是对苯醌和邻苯醌。下列结构称为醌式结构:
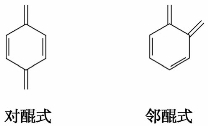
具有醌式结构的化合物都有颜色,对位醌多显黄色,邻位醌多显红色或橙色。在许多植物色素(如茜素)、染料(如品红)和指示剂(如甲基红)中都存在醌式结构。
7.5.2 醌的性质
1)物理性质
(1)性状
醌类化合物如果母核上没有酚羟基取代,基本上无色。但随着酚羟基等助色团的引入则表现有一定颜色。取代的助色团越多,颜色也就越深,有黄、橙、棕红色以至紫红色等。天然存在的醌类成分因分子中多有取代故为有色晶体。苯醌和萘醌多以游离态存在,而蒽醌一般结合成苷存在于植物体中,故极性较大难以得到晶体。
(2)升华性
游离的醌类化合物一般具有升华性。小分子的苯醌类及萘醌类还具有挥发性,能随水蒸气蒸馏,可据此进行分离和纯化工作。
(3)溶解性
游离醌类苷元极性较小,一般溶于乙醇、乙醚、苯、氯仿等有机溶剂,基本上不溶于水。和糖结合成苷后极性显著增大,易溶于甲醇、乙醇中,在热水中也可溶解,但在冷水中溶解度大大降低,几乎不溶于苯、乙醚、氯仿等极性较小的有机溶剂。
有些醌类成分含有易被氧化的取代基,对光不稳定,操作时应在暗处进行,并需避光贮存。
2)化学性质
醌不同于芳香的环闭共轭体系,所以醌不属于芳香族化合物,他们具有烯烃和羰基化合物的典型反应性能,可以进行多种形式的加成反应,下面以苯醌为例说明。
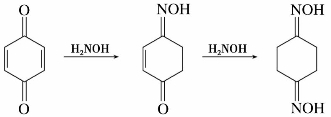
(1)与羟氨反应
醌中的羰基,能与某些亲核试剂加成,如对苯醌能分别与一分子或两分子羟胺作用得到单肟或双肟。
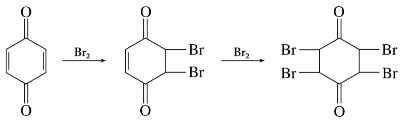
(2)烯键的加成
醌中的碳—碳双键可以和卤素、卤化氢等亲电试剂加成,如对苯醌与溴加成可生成二溴化物或四溴化物。
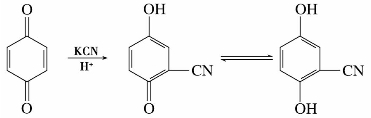
(3)共轭加成
苯醌中碳—碳双键与碳—氧双键共轭,所以能与一些亲核试剂发生1,4-加成反应,如对苯醌与氢氰酸加成后,生成对苯二酚的衍生物,例如:
(4)还原
醌经过还原得到酚。例如,对苯醌还原成对苯二酚(或称氢醌)。这是对苯二酚氧化的逆反应。在电化学上,利用二者之间的氧化-还原性质可以制成氢醌电极,并可以用来测定氢离子浓度。
将对苯醌与对苯二酚在乙醇溶液中混合,可生成深绿色的晶体——醌氢醌。由于出现明显的颜色变化,此反应常用于药物分析中。
7.5.3 重要的醌
1)苯醌
苯醌是结晶性固体,有两种异构体,邻苯醌和对苯醌。对苯醌可由苯胺或对苯二酚氧化得到。对苯醌为黄色,熔点115.7℃,微溶于水,可进行水蒸气蒸馏,受热升华,用于制造对苯二酚和燃料等。邻苯醌可由邻苯二酚用氧化银的纯醚溶液,在无水硫酸钠存在下,氧化得到。邻苯醌有两种形式,一种是不稳定的绿色针状结晶,一种是稳定的浅红色片状结晶。从苯醌的结构可以看出,它应具有α,β-不饱和酮的性质。
2)萘醌
萘醌有3种异构体:α-萘醌、β-萘醌和远萘醌。其中最重要的是α-萘醌。α-萘醌是黄色晶体,止血药维生素K是α-萘醌的衍生物。
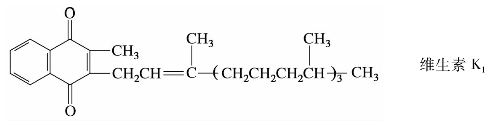
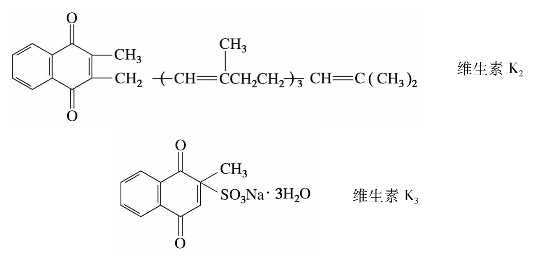
维生素K1、K2天然存在,在猪肝和苜蓿中含量最丰富。维生素K3是合成药,具有与维生素K1、K2相同的生理活性,其凝血功能比维生素K1、K2更强。
3)蒽醌
蒽醌中最重要的是9,10-蒽醌,通常简称为蒽醌,是浅黄色针状晶体。沸点379~381℃,约450℃分解,不溶于水,微溶于乙醇、乙醚、氯仿,但易溶于浓硫酸。蒽醌的化学性质较稳定,不易氧化。蒽醌可以被连二硫酸钠和氢氧化钠还原,酸化后生成9,10-二羟基蒽。
蒽醌的衍生物普遍存在于自然界,如茜草根中的茜素,中药大黄中的大黄酸、大黄素等。含蒽醌的染料叫蒽醌染料,蒽醌及衍生物可以制得多种染料,它是一类色泽鲜艳,用途广、性能良好的染料。据统计,蒽醌染料有400多个品种。
在工业上生产蒽醌的主要方法是:以邻苯二甲酸酐和苯为原料,首先在氯化铝存在的情况下进行傅瑞德尔-克拉夫茨酰基化反应,生成邻苯甲酰苯甲酸,然后在浓硫酸的作用下脱水生成蒽醌。

大黄素广泛存在于自然界中,是中药大黄的有效成分,具有致泻、抗菌、止血等多方面的生理活性。
综合练习7
1.用系统命名法命名下列化合物。
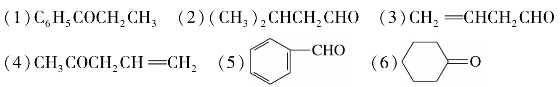
(7)OHCCH2CH(CH3)CH2CHO (8)CH3COCH2COCH2CH3
2.写出苯甲醛与下列试剂反应所得产物的结构,若不反应,请注明。
(1)Na2SO3 (2)CH3CH2MgBr,H2O/H+ (3)CH3CH2OH/H2SO4(浓)
(4)NH2OH (5)CH3COCH3/NaOH(浓) (6)HCHO/NaOH(浓)
(7)Zn,Hg/HCl(浓) (8)NaOI/NaOH
3.用化学方法鉴别下列各组化合物。
(1)丙醛、丙醇、异丙醇、丙酮 (2)甲醛、乙醛、乙醇、乙醚
(3)苯甲醇、苯甲醛、苯乙酮 (4)苯甲醛、2-苯基乙醛
4.试设计一个分离戊醇、戊醛、戊酸的化学方法,并写出各步反应式。
5.推测结构。
(1)分子式为C5H10O的化合物用锌汞浓盐酸还原生成正戊烷,另外它还可和苯肼反应生成苯腙,但不能发生碘仿反应,也不与托伦试剂反应,试推测该化合物的结构式。
(2)有一化合物A,分子式为C8H14O,化合物A可以很快使溴褪色,还可以和苯肼发生反应,A氧化后得到一分子丙酮及另一化合物B,B具有酸性,和次碘酸钠反应生成碘仿和一分子二酸C,试写出A、B、C结构式。并请写出推导过程。
(3)有甲、乙、丙3种化合物,已知甲和乙与苯肼能发生反应而丙不能;甲能还原斐林试剂,而乙和丙不能;只有丙能与碘的碱溶液作用生成碘仿。试推测甲、乙、丙各为哪一类化合物。
(4)某醇A与氢碘酸反应生成B,B在无水三氯化铝存在下和C反应生成D,D在光照条件下发生一元氯化得到E,E经碱性水解生成F,F在酸性高锰酸钾溶液中氧化生成G。已知G的分子式为C8H8O,可给出下列实验结果:G与托伦试剂不反应;G与2,4-二硝基苯肼生成橙黄色沉淀;G与碘酸钠作用生成碘仿黄色沉淀;G与锌汞齐浓盐酸作用生成乙苯。试推测A、B、C、D、E、F、G的结构式。
(5)化合物A的分子式时C9H10O2,能溶于氢氧化钠溶液,既可以 与羟氨、氨基脲等反应,又能与三氯化铁溶液发生显色反应。但不与托伦试剂反应。A经四氢铝锂还原则生成化合物B,分子式为C9H12O2。A和B均能起卤仿反应。将A用锌汞齐在盐酸中还原,可以生成化合物C,分子式为C9H12O。将C与氢氧化钠溶液作用,然后与碘甲烷煮沸,得到化合物D,分子式为C10H14O。D用高锰酸钾溶液氧化,最后得到对甲氧基苯甲酸。写出A、B、C、D的构造式。
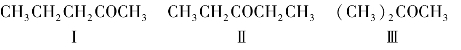

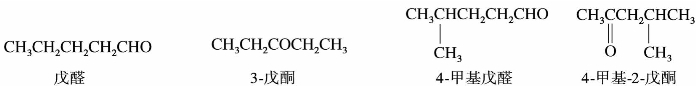

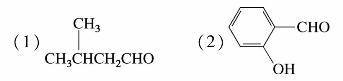

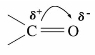

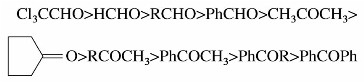
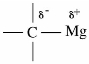





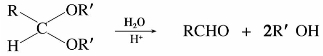



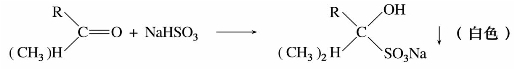



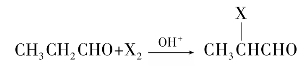
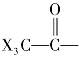 中碳—碳键不再牢固,使碳—碳键电子云密度大大下降而变得很弱,在碱的作用下发生断裂,生成卤仿和相应的羧酸盐。因为反应最终生成卤仿,故称卤仿反应。如:
中碳—碳键不再牢固,使碳—碳键电子云密度大大下降而变得很弱,在碱的作用下发生断裂,生成卤仿和相应的羧酸盐。因为反应最终生成卤仿,故称卤仿反应。如: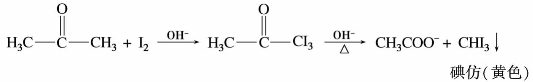
 结构的醇氧化成相应的醛、甲基酮,因此用碘仿反应也可以鉴别这种结构的醇。碘仿反应时缩短碳链的反应之一,也可用来制取某些羧酸。
结构的醇氧化成相应的醛、甲基酮,因此用碘仿反应也可以鉴别这种结构的醇。碘仿反应时缩短碳链的反应之一,也可用来制取某些羧酸。
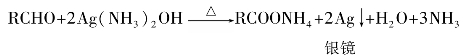

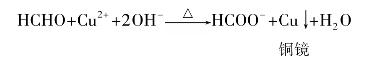

 C等,则也可能被加氢成为饱和键。例如:
C等,则也可能被加氢成为饱和键。例如: