-
1.1目录
-
1.2第一章 总 论
-
1.2.1第一节 绪 言
-
1.2.1.1一、药理学的性质与研究内容
-
1.2.1.2二、药物与药理学的发展简史
-
1.2.2三、学习与研究药理学的方法
-
1.2.3第二节 药物效应动力学——药效学
-
1.2.3.1一、药物作用
-
1.2.4二、药物不良反应
-
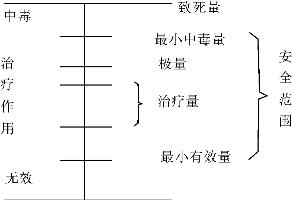
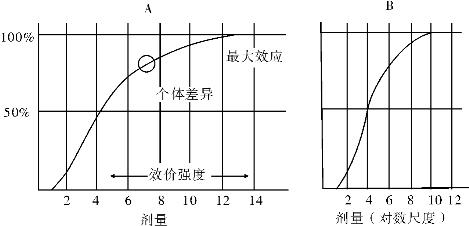
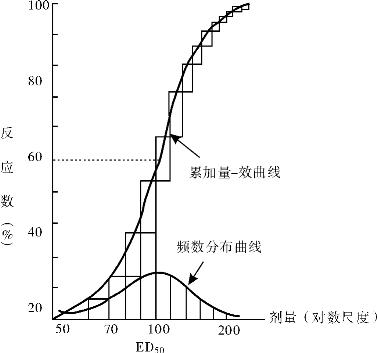
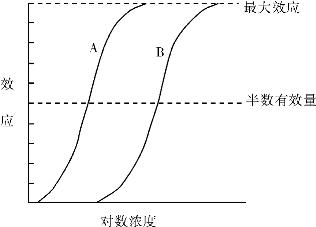
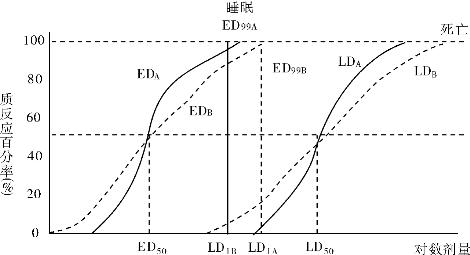
1.2.5三、药物剂量与效应关系
-
1.2.6四、药物作用机制
-
1.2.7第三节 药物代谢动力学——药动学
-
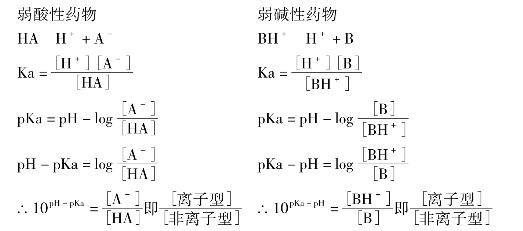
1.2.8一、药物跨膜转运
-
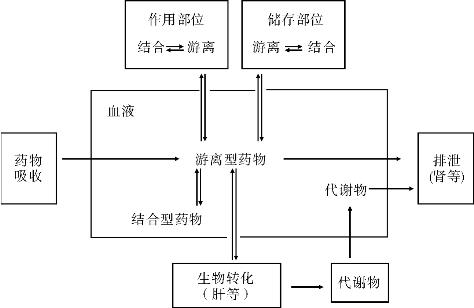
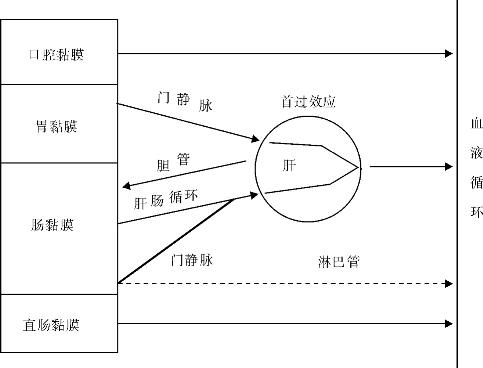
1.2.9二、药物体内过程
-
1.2.10三、药物在体内随时间变化过程的规律
-
1.2.11第四节 影响药物效应的因素及合理用药原则
-
1.2.12一、药物方面因素
-
1.2.13二、药物相互作用
-
1.2.14三、机体方面因素
-
1.2.15四、合理用药原则
-
1.3第二章 传出神经系统药理概论
-
1.3.1一、传出神经分类
-
1.3.2二、传出神经系统的递质及受体
-
1.3.3三、传出神经系统的生理功能
-
1.3.4四、传出神经系统药物作用机制
-
1.3.5五、传出神经系统药物分类
-
1.4第三章 胆碱受体激动药
-
1.4.1第一节 直接激动胆碱受体药
-
1.4.1.1一、M胆碱受体激动药
-
1.4.1.2二、M、N胆碱受体激动药
-
1.4.1.3三、N胆碱受体激动药
-
1.4.2第二节 间接激动胆碱受体药
-
1.4.2.1一、易逆性抗胆碱酯酶药
-
1.4.2.2二、难逆性抗胆碱酯酶药
-
1.5第四章 胆碱受体阻断药
-
1.5.1第一节 M胆碱受体阻断药
-
1.5.1.1一、阿托品和阿托品类生物碱
-
1.5.1.2二、阿托品的合成代用品
-
1.5.2第二节 N胆碱受体阻断药
-
1.5.2.1一、N<span title="pagenumber_ebook=61,pagenumber_boo...
-
1.5.2.2二、N<span title="pagenumber_ebook=62,pagenumber_boo...
-
1.6第五章 肾上腺素受体激动药
-
1.6.1第一节 α、β受体激动药
-
1.6.2第二节 α受体激动药
-
1.6.2.1一、α<span title="pagenumber_ebook=68,pagenumber_boo...
-
1.6.2.2二、α<span title="pagenumber_ebook=71,pagenumber_boo...
-
1.6.3第三节 β受体激动药
-
1.6.3.1一、β<span title="pagenumber_ebook=71,pagenumber_boo...
-
1.6.3.2二、β<span title="pagenumber_ebook=72,pagenumber_boo...
-
1.6.3.3三、β<span title="pagenumber_ebook=72,pagenumber_boo...
-
1.7第六章 肾上腺素受体阻断药
-
1.7.1第一节 α肾上腺素受体阻断药
-
1.7.1.1一、α<span title="pagenumber_ebook=74,pagenumber_boo...
-
1.7.1.2二、α<span title="pagenumber_ebook=76,pagenumber_boo...
-
1.7.1.3三、α<span title="pagenumber_ebook=76,pagenumber_boo...
-
1.7.2第二节 β肾上腺素受体阻断药
-
1.7.2.1一、β<span title="pagenumber_ebook=77,pagenumber_boo...
-
1.7.2.2二、β<span title="pagenumber_ebook=77,pagenumber_boo...
-
1.7.2.3三、α、β受体阻断药
-
1.8第七章 麻 醉 药
-
1.8.1第一节 局部麻醉药
-
1.8.2一、基本药理知识
-
1.8.3二、常用局麻药
-
1.8.4第二节 全身麻醉药
-
1.8.5一、吸入性麻醉药
-
1.8.6二、静脉麻醉药
-
1.8.7三、复合麻醉
-
1.9第八章 镇静催眠药
-
1.9.1第一节苯二氮 <img title="pagenumber_ebook=88,pagenumber_...
-
1.9.2第二节 巴比妥类
-
1.9.3第三节 其他镇静催眠药
-
1.10第九章 抗癫痫药和抗惊厥药
-
1.10.1第一节 常用抗癫痫药
-
1.10.2第二节 常用抗惊厥药
-
1.11第十章 抗帕金森病药
-
1.11.1第一节 拟多巴胺类药
-
1.11.2第二节 中枢性抗胆碱药
-
1.12第十一章 抗精神失常药
-
1.12.1第一节 抗精神病药
-
1.12.2一、吩噻嗪类
-
1.12.3二、硫杂蒽类
-
1.12.4三、丁酰苯类
-
1.12.5四、其他药物
-
1.12.6第二节 抗躁狂抑郁症药
-
1.12.7一、抗躁狂药
-
1.12.8二、抗抑郁症药
-
1.12.9第三节 抗焦虑药
-
1.13第十二章 镇 痛 药
-
1.13.1第一节 阿片生物碱类镇痛药
-
1.13.2第二节 人工合成镇痛药
-
1.13.3第三节 其他镇痛药
-
1.13.4第四节 阿片受体拮抗剂
-
1.14第十三章 中枢兴奋药
-
1.14.1第一节 大脑皮层兴奋药
-
1.14.2第二节 呼吸中枢兴奋药物
-
1.15第十四章 解热镇痛抗炎药
-
1.15.1第一节 概 述
-
1.15.2第二节 常用解热镇痛抗炎药
-
1.15.2.1一、水杨酸类
-
1.15.3二、苯胺类
-
1.15.4三、吡唑酮类
-
1.15.5四、其他抗炎有机酸类
-
1.16第十五章 抗心律失常药
-
1.16.1一、心律失常的电生理学基础
-
1.16.2二、抗心律失常的基本电生理作用及药物分类
-
1.16.3三、常用抗心律失常药
-
1.17第十六章 抗慢性心功能不全药
-
1.17.1第一节 强 心 苷
-
1.17.2第二节 非强心苷类的正性肌力作用药
-
1.17.3第三节 血管扩张药治疗慢性心功能不全
-
1.17.4第四节 血管紧张素Ⅰ转化酶抑制药
-
1.18第十七章 抗心绞痛药
-
1.18.1一、硝酸酯类及亚硝酸酯类药
-
1.18.2二、肾上腺素β受体阻断药
-
1.18.3三、钙拮抗药
-
1.19第十八章 抗动脉粥样硬化药
-
1.19.1第一节 调血脂药
-
1.19.2第二节 抗氧化剂
-
1.19.3第三节 多烯脂肪酸类
-
1.19.4第四节 保护动脉内皮药
-
1.20第十九章 抗高血压药
-
1.20.1一、抗高血压药物的分类
-
1.20.2二、常用抗高血压药
-
1.20.3三、抗高血压药物的应用原则
-
1.21第二十章 利尿药和脱水药
-
1.21.1第一节 利尿药
-
1.21.2一、利尿药的分类
-
1.21.3二、利尿药的作用与肾脏生理学基础
-
1.21.4三、常用的利尿药
-
1.21.5第二节 脱 水 药
-
1.22第二十一章 血液及造血系统疾病用药
-
1.22.1第一节 抗贫血药
-
1.22.2第二节 影响凝血过程药
-
1.22.3一、促凝血药
-
1.22.4二、抗凝血药
-
1.22.5第三节 纤维蛋白溶解药
-
1.22.6第四节 抗血小板药
-
1.22.7第五节 血容量扩充药
-
1.23第二十二章 组胺受体阻断药
-
1.23.1第一节 H<span title="pagenumber_ebook=178,pagenumber_...
-
1.23.2第二节 H<span title="pagenumber_ebook=179,pagenumber_...
-
1.24第二十三章 作用于消化系统的药物
-
1.24.1第一节 助消化药
-
1.24.2第二节 抗消化性溃疡药
-
1.24.2.1一、抗酸药
-
1.24.2.2二、胃酸分泌抑制药
-
1.24.2.3三、胃黏膜保护药
-
1.24.2.4四、抗幽门螺杆菌药
-
1.24.3第三节 泻药与止泻
-
1.24.3.1一、泻 药
-
1.24.3.2二、止泻药
-
1.24.4第四节 止吐药
-
1.25第二十四章 作用于呼吸系统的药物
-
1.25.1第一节 平喘药
-
1.25.1.1一、β<span title="pagenumber_ebook=190,pagenumber_bo...
-
1.25.1.2二、茶碱类药
-
1.25.1.3三、抗胆碱药
-
1.25.1.4四、过敏介质阻释药
-
1.25.1.5五、糖皮质激素类
-
1.25.2第二节 镇咳药
-
1.25.3一、中枢性镇咳药
-
1.25.4二、外周性镇咳药
-
1.25.5第三节 祛痰药
-
1.25.6一、痰液稀释药
-
1.25.7二、黏痰溶解药
-
1.26第二十五章 作用于子宫的药物
-
1.26.1第一节 子宫兴奋药
-
1.26.2一、缩宫素
-
1.26.3二、麦角生物碱类
-
1.26.4三、前列腺素类
-
1.26.5第二节 子宫抑制药
-
1.27第二十六章 性激素类药与抗生育药
-
1.27.1第一节 雌激素类药与抗雌激素类药
-
1.27.1.1一、雌激素类药
-
1.27.1.2二、抗雌激素类药
-
1.27.2第二节 孕激素类药与抗孕激素类药
-
1.27.3一、孕激素类药
-
1.27.4二、抗孕激素类药
-
1.27.5第三节 雄激素类药和同化激素类药
-
1.27.5.1一、雄激素类药
-
1.27.5.2二、同化激素类药
-
1.27.6第四节 抗生育药
-
1.27.7一、主要抑制排卵的避孕药
-
1.27.8二、抗着床避孕药
-
1.27.9三、抗早孕药
-
1.27.10四、男性避孕药
-
1.28第二十七章 肾上腺皮质激素类药物
-
1.28.1第一节 糖皮质激素类药
-
1.28.2第二节 盐皮质激素类药
-
1.28.3第三节 促皮质素及皮质激素抑制药
-
1.28.4一、促皮质素
-
1.28.5二、皮质激素抑制药
-
1.29第二十八章 甲状腺激素及抗甲状腺药物
-
1.29.1第一节 甲状腺激素
-
1.29.2第二节 抗甲状腺药
-
1.29.3一、硫脲类
-
1.29.4二、碘及碘化物
-
1.29.5三、放射性碘
-
1.29.6四、β肾上腺素受体阻断药
-
1.30第二十九章 胰岛素及口服降血糖药
-
1.30.1第一节 胰 岛 素
-
1.30.2第二节 口服降血糖药
-
1.30.3一、磺酰脲类
-
1.30.4二、双胍类
-
1.30.5三、α-葡萄糖苷酶抑制药
-
1.30.6四、胰岛素增敏药
-
1.31第三十章 抗菌药物概论
-
1.31.1第一节 常用术语
-
1.31.2第二节 抗菌药物作用机制
-
1.31.3第三节 细菌的耐药性
-
1.31.4第四节 抗菌药的合理使用
-
1.31.5一、严格掌握适应证
-
1.31.6二、抗菌药物的联合应用
-
1.32第三十一章 β-内酰胺类抗生素
-
1.32.1一、青霉素类
-
1.32.2二、头孢菌素类
-
1.32.3三、非典型β-内酰胺类抗生素
-
1.33第三十二章 大环内酯类、林可霉素类及其他抗生素
-
1.33.1第一节 大环内酯类抗生素
-
1.33.2第二节 林可霉素类抗生素
-
1.33.3第三节 万古霉素、去甲万古霉素、替考拉宁
-
1.34第三十三章 氨基糖苷类及多黏菌素类抗生素
-
1.34.1第一节 氨基糖苷类抗生素的共性
-
1.34.2第二节 常用氨基糖苷类药物
-
1.34.3第三节 多黏菌素类抗生素
-
1.35第三十四章 四环素类及氯霉素类抗生素
-
1.35.1第一节 四环素类抗生素
-
1.35.2第二节 氯 霉 素
-
1.36第三十五章 人工合成抗菌药
-
1.36.1第一节 喹诺酮类药物
-
1.36.1.1一、概 述
-
1.36.1.2二、主要喹诺酮类药物
-
1.36.2第二节 磺胺类药物
-
1.36.3一、磺胺类药物的分类
-
1.36.4二、磺胺类药物的共性
-
1.36.5第三节 其他合成抗菌药
-
1.36.5.1一、甲氧苄啶
-
1.36.5.2二、硝基呋喃类
-
1.37第三十六章 抗真菌药及抗病毒药
-
1.37.1第一节 抗真菌药
-
1.37.2一、抗表浅部真菌药
-
1.37.3二、抗深部真菌药
-
1.37.4三、抗表浅及深部真菌药
-
1.37.5第二节 抗病毒药
-
1.38第三十七章 抗结核病药及抗麻风病药
-
1.38.1第一节 抗结核病药
-
1.38.2第二节 抗麻风病药
-
1.39第三十八章 抗疟药
-
1.39.1第一节 概 述
-
1.39.2第二节 常用抗疟药
-
1.39.2.1一、主要用于控制症状的抗疟药
-
1.39.3二、主要用于控制疟疾复发和传播的药物
-
1.39.4三、主要用于病因性预防的抗疟药
-
1.40第三十九章 抗阿米巴病药及抗滴虫病药
-
1.40.1第一节 抗阿米巴病药
-
1.40.2第二节 抗滴虫病药
-
1.41第四十章 抗血吸虫病及抗丝虫病药
-
1.41.1第一节 抗血吸虫病药
-
1.41.2第二节 抗丝虫病药
-
1.42第四十一章 驱肠虫药
-
1.42.1一、常见驱肠虫药
-
1.42.2二、驱肠虫药的应用原则
-
1.43第四十二章 抗恶性肿瘤药
-
1.43.1第一节 抗恶性肿瘤药的作用和分类
-
1.43.2一、细胞增殖周期与抗恶性肿瘤药基本作用
-
1.43.3二、抗恶性肿瘤药的分类
-
1.43.4第二节 常用抗恶性肿瘤药
-
1.43.4.1一、烷化剂
-
1.43.5二、抗代谢药
-
1.43.6三、抗肿瘤抗生素类
-
1.43.7四、抗肿瘤植物药
-
1.43.8五、激素类
-
1.43.9六、其他药物
-
1.43.10第三节 联合应用抗肿瘤药物的原则
-
1.44第四十三章 影响免疫功能的药物
-
1.44.1第一节 免疫抑制药
-
1.44.2第二节 免疫增强药
-
1.45第四十四章 解毒药
-
1.45.1第一节 重金属及类金属中毒解毒药
-
1.45.2第二节 氰化物中毒解毒药
-
1.45.3第三节 灭鼠药中毒解毒药
-
1.45.4一、抗凝血类灭鼠药中毒解毒药
-
1.45.5二、磷毒鼠药中毒解毒药
-
1.45.6三、有机氟灭鼠药中毒解毒药
-
1.45.7四、毒鼠强中毒解毒药
-
1.45.8第四节 有机磷酸酯类中毒解毒药
-
1.45.9第五节 蛇毒中毒解毒药
-
1.46参考文献
1
药理学