-
1.1《中等卫生职业学校护理专业创新教材》
-
1.2序
-
1.3前 言
-
1.4第一章 绪 论
-
1.4.1一、生物化学的内容
-
1.4.2二、生物化学的发展史
-
1.4.3三、生物化学与医学的关系
-
1.4.4四、学习生物化学的方法
-
1.5第二章 蛋白质化学
-
1.5.1第一节 蛋白质的分子组成
-
1.5.1.1一、蛋白质的元素组成
-
1.5.1.2二、蛋白质的基本组成单位——氨基酸
-
1.5.1.3三、蛋白质分子中氨基酸的连接方式
-
1.5.2第二节 蛋白质的结构与功能
-
1.5.2.1一、蛋白质分子的一级结构
-
1.5.2.2二、蛋白质的空间结构
-
1.5.2.3三、蛋白质结构与功能的关系
-
1.5.3第三节 蛋白质的理化性质
-
1.5.3.1一、蛋白质的两性电离
-
1.5.3.2二、蛋白质的胶体性质
-
1.5.3.3三、蛋白质的沉淀
-
1.5.3.4四、蛋白质的变性
-
1.5.4第四节 蛋白质的分类
-
1.5.4.1一、按蛋白质组成分类
-
1.5.4.2二、按蛋白质形状分类
-
1.6第三章 核酸化学
-
1.6.1第一节 核酸的分子组成
-
1.6.1.1一、核酸的元素组成
-
1.6.1.2二、核酸的基本组成单位——核苷酸
-
1.6.2第二节 核酸的分子结构
-
1.6.2.1一、核酸的基本结构
-
1.6.2.2二、DNA的空间结构
-
1.6.2.3三、RNA的空间结构
-
1.6.3第三节 DNA的变性与复性
-
1.6.3.1一、DNA的变性
-
1.6.3.2二、DNA的复性与分子杂交
-
1.7第四章 维生素
-
1.7.1第一节 概 述
-
1.7.1.1一、维生素的基本概念
-
1.7.1.2二、维生素的分类与命名
-
1.7.1.3三、维生素缺乏的原因
-
1.7.2第二节 脂溶性维生素
-
1.7.2.1一、维生素A
-
1.7.2.2二、维生素D
-
1.7.2.3三、维生素E
-
1.7.2.4四、维生素K
-
1.7.3第三节 水溶性维生素
-
1.7.3.1一、维生素B
-
1.7.3.2二、维生素B
-
1.7.3.3三、维生素PP
-
1.7.3.4四、维生素B
-
1.7.3.5五、生物素
-
1.7.3.6六、泛 酸
-
1.7.3.7七、叶 酸
-
1.7.3.8八、维生素B
-
1.7.3.9九、维生素C
-
1.8第五章 酶
-
1.8.1第一节 概 述
-
1.8.1.1一、酶的概念
-
1.8.1.2二、酶催化作用的特点和机制
-
1.8.2第二节 酶的结构与功能
-
1.8.2.1一、酶的分子组成
-
1.8.2.2二、酶的活性中心
-
1.8.2.3三、酶原与酶原的激活
-
1.8.2.4四、同工酶
-
1.8.3第三节 影响酶促反应速度的因素
-
1.8.3.1一、酶浓度的影响
-
1.8.3.2二、底物浓度的影响
-
1.8.3.3三、温度的影响
-
1.8.3.4四、PH的影响
-
1.8.3.5五、激活剂的影响
-
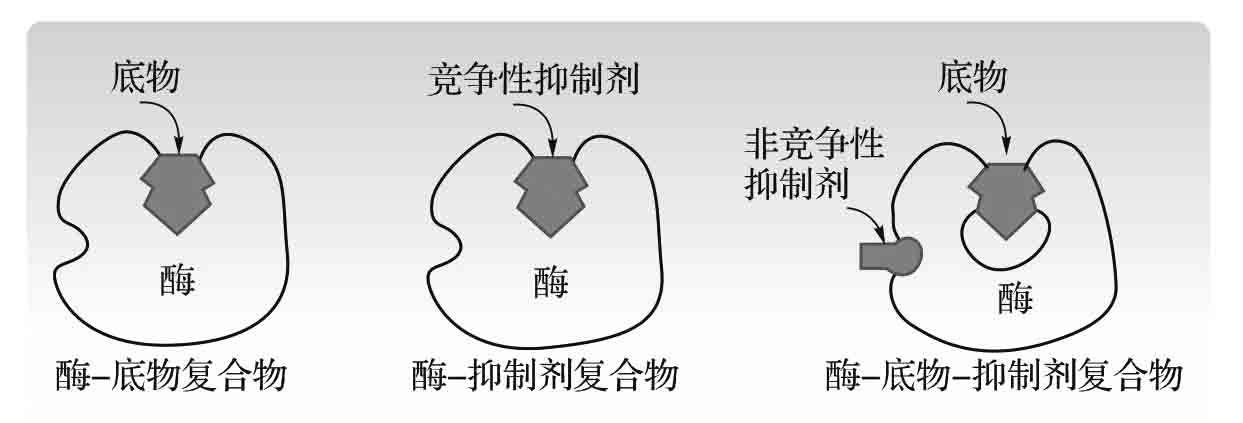
1.8.3.6六、抑制剂的影响
-
1.8.4第四节 酶的命名与分类
-
1.8.4.1一、酶的命名
-
1.8.4.2二、酶的分类
-
1.8.5第五节 酶在医药学上的应用
-
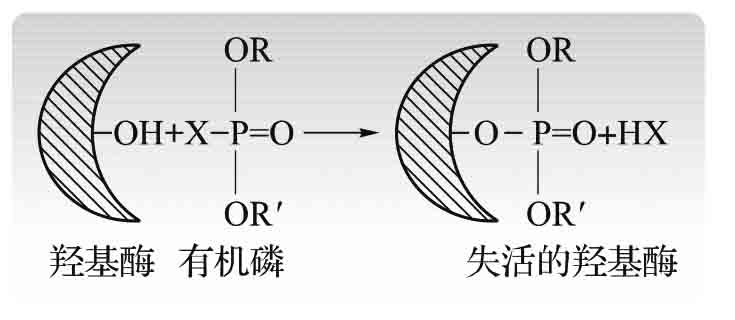
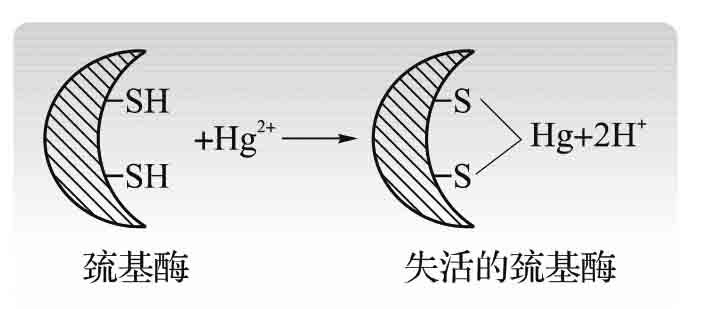
1.8.5.1一、酶与疾病的发生
-
1.8.5.2二、酶与疾病的诊断
-
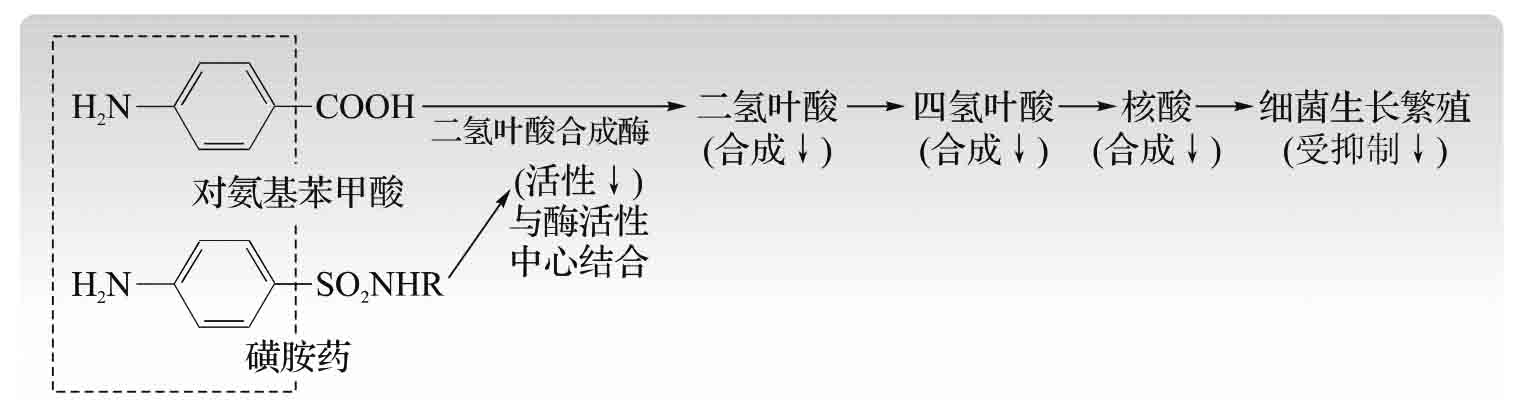
1.8.5.3三、酶与疾病的治疗
-
1.9第六章 糖代谢
-
1.9.1第一节 概 述
-
1.9.1.1一、糖的生理功能
-
1.9.1.2二、糖的分类
-
1.9.1.3三、糖的代谢概况
-
1.9.2第二节 糖的分解代谢
-
1.9.2.1一、糖的无氧氧化
-
1.9.2.2二、糖的有氧氧化
-
1.9.2.3三、磷酸戊糖途径
-
1.9.3第三节 糖原的合成与分解
-
1.9.3.1一、糖原合成
-
1.9.3.2二、糖原分解
-
1.9.3.3三、生理意义
-
1.9.4第四节 糖异生
-
1.9.4.1一、糖异生途径
-
1.9.4.2二、糖异生的生理意义
-
1.9.5第五节 血 糖
-
1.9.5.1一、血糖的来源与去路
-
1.9.5.2二、血糖浓度的调节
-
1.9.5.3三、高血糖与低血糖
-
1.10第七章 生物氧化
-
1.10.1第一节 概 述
-
1.10.1.1一、生物氧化的概念
-
1.10.1.2二、生物氧化的特点
-
1.10.2第二节 线粒体生物氧化体系
-
1.10.2.1一、呼吸链的概念
-
1.10.2.2二、呼吸链的组成成分
-
1.10.2.3三、体内重要的呼吸链
-
1.10.3第三节 ATP的生成与能量的利用和转移
-
1.10.3.1一、ATP的生成方式
-
1.10.3.2二、影响氧化磷酸化的因素
-
1.10.3.3三、ATP的利用及能量的转移
-
1.10.4第四节 二氧化碳的生成
-
1.10.5第五节 生物氧化过程中自由基的产生与清除
-
1.10.5.1一、自由基的概念及来源
-
1.10.5.2二、自由基对机体的影响及清除
-
1.11第八章 脂类代谢
-
1.11.1第一节 概 述
-
1.11.1.1一、脂类的分布及含量
-
1.11.1.2二、脂类的生理功能
-
1.11.2第二节 血脂及血浆脂蛋白代谢
-
1.11.2.1一、血 脂
-
1.11.2.2二、血浆脂蛋白
-
1.11.2.3三、血浆脂蛋白的代谢及功能
-
1.11.2.4四、高脂血症与高脂蛋白血症
-
1.11.3第三节 甘油三酯的代谢
-
1.11.3.1一、甘油三酯的分解代谢
-
1.11.3.2二、酮体的生成和利用
-
1.11.3.3三、甘油三酯的合成代谢
-
1.11.4第四节 磷脂代谢
-
1.11.4.1一、甘油磷脂的合成代谢
-
1.11.4.2二、甘油磷脂的分解代谢
-
1.11.5第五节 胆固醇代谢
-
1.11.5.1一、胆固醇的合成
-
1.11.5.2二、胆固醇的转化
-
1.12第九章 氨基酸代谢
-
1.12.1第一节 蛋白质的营养作用
-
1.12.1.1一、蛋白质的生理功能
-
1.12.1.2二、蛋白质的需要量和营养价值
-
1.12.2第二节 氨基酸的一般代谢
-
1.12.2.1一、氨基酸的代谢概况
-
1.12.2.2二、氨基酸的脱氨基作用
-
1.12.2.3三、氨的代谢
-
1.12.2.4四、α-酮酸的代谢
-
1.12.3第三节 某些氨基酸的特殊代谢
-
1.12.3.1一、氨基酸的脱羧基作用
-
1.12.3.2二、一碳单位代谢
-
1.12.3.3三、含硫氨基酸代谢
-
1.12.3.4四、芳香族氨基酸的代谢
-
1.13第十章 核酸代谢和蛋白质的生物合成
-
1.13.1第一节 核苷酸代谢
-
1.13.1.1一、核苷酸的合成代谢
-
1.13.1.2二、核苷酸的分解代谢
-
1.13.2第二节 DNA的生物合成
-
1.13.2.1一、DNA的半保留复制
-
1.13.2.2二、逆转录
-
1.13.3第三节 RNA的生物合成
-
1.13.3.1一、转录的概念
-
1.13.3.2二、转录的模板
-
1.13.3.3三、转录的过程
-
1.13.4第四节 蛋白质的生物合成
-
1.13.4.1一、三种RNA在蛋白质生物合成中的作用
-
1.13.4.2二、蛋白质生物合成过程
-
1.13.4.3三、蛋白质生物合成与医药学的关系
-
1.13.5第五节 基因工程在医药学中的应用
-
1.13.5.1一、基因工程与药物研制
-
1.13.5.2二、基因工程与基因治疗
-
1.13.5.3第六节 癌基因与抑癌基因
-
1.13.5.4一、癌基因
-
1.13.5.5二、抑癌基因
-
1.14第十一章 血液生物化学
-
1.14.1第一节 血液的化学组成
-
1.14.1.1一、血液的化学成分
-
1.14.1.2二、非蛋白含氮化合物
-
1.14.2第二节 血浆蛋白质
-
1.14.2.1一、血浆蛋白质的组成
-
1.14.2.2二、血浆蛋白质的功能
-
1.14.3第三节 红细胞的代谢
-
1.14.3.1一、血红蛋白的生物合成
-
1.14.3.2二、成熟红细胞的代谢特点
-
1.15第十二章 肝胆生物化学
-
1.15.1第一节 肝在物质代谢中的作用
-
1.15.1.1一、肝在糖代谢中的作用
-
1.15.1.2二、肝在脂类代谢中的作用
-
1.15.1.3三、肝在蛋白质代谢中的作用
-
1.15.1.4四、肝在维生素代谢中的作用
-
1.15.1.5五、肝在激素代谢中的作用
-
1.15.2第二节 肝的生物转化作用
-
1.15.2.1一、生物转化的概念
-
1.15.2.2二、生物转化的反应类型与特点
-
1.15.3第三节 胆汁酸代谢
-
1.15.3.1一、胆汁酸的分类
-
1.15.3.2二、胆汁酸的代谢
-
1.15.3.3三、胆汁酸的功能
-
1.15.4第四节 胆色素代谢
-
1.15.4.1一、胆红素的生成与转运
-
1.15.4.2二、胆红素在肝中的转化
-
1.15.4.3三、胆红素在肠道中的变化及胆素原的肠肝循环
-
1.15.4.4四、血清胆红素与黄疸
-
1.15.4.5第五节 常用肝功能试验及临床意义
-
1.16第十三章 水和无机盐代谢
-
1.16.1第一节 体 液
-
1.16.1.1一、体液的分布与含量
-
1.16.1.2二、体液电解质的含量及分布特点
-
1.16.1.3三、体液的交换
-
1.16.2第二节 水代谢
-
1.16.2.1一、水的生理功能
-
1.16.2.2二、水的来源与排出
-
1.16.3第三节 无机盐代谢
-
1.16.3.1一、无机盐的生理功能
-
1.16.3.2二、钠、氯代谢
-
1.16.3.3三、钾代谢
-
1.16.3.4四、钙、磷代谢
-
1.16.3.5五、微量元素代谢
-
1.17第十四章 酸碱平衡
-
1.17.1第一节 体内酸性和碱性物质的来源
-
1.17.1.1一、酸性物质的来源
-
1.17.1.2二、碱性物质的来源
-
1.17.2第二节 酸碱平衡的调节
-
1.17.2.1一、血液的缓冲作用
-
1.17.2.2二、肺对酸碱平衡的调节
-
1.17.2.3三、肾对酸碱平衡的调节
-
1.17.3第三节 酸碱平衡失常
-
1.17.3.1一、酸碱平衡失常的基本类型
-
1.17.3.2二、判断酸碱平衡的几项生化指标
-
1.18实验指导
-
1.18.1实验一 血清蛋白醋酸纤维薄膜电泳
-
1.18.2实验二 酶的专一性及影响酶促反应的因素
-
1.18.3实验三 肝中酮体的生成作用
-
1.18.4实验四 转氨基作用
-
1.19生物化学阶段性测试
-
1.19.1试卷一
-
1.19.2试卷二
-
1.19.3参考答案
-
1.20参考文献
1
生物化学基础