-
1.1前 言
-
1.2第一章 绪 论
-
1.2.1第一节 细胞生物学研究的内容
-
1.2.2第二节 细胞生物学发展简史
-
1.2.3第三节 细胞生物学与临床医学
-
1.3第二章 细胞的基本特征
-
1.3.1第一节 细胞的起源与进化
-
1.3.2第二节 细胞的分子基础
-
1.3.3第三节 细胞的基本特征
-
1.3.4第四节 细胞的大小、形态和数目
-
1.4第三章 真核细胞的基本结构
-
1.4.1第一节 细胞膜和细胞表面
-
1.4.2第二节 内膜系统
-
1.4.3第三节 线粒体
-
1.4.4第四节 核糖体
-
1.4.5第五节 细胞骨架
-
1.4.6第六节 细胞核
-
1.4.7第七节 细胞外基质
-
1.5第四章 细胞的物质运输
-
1.5.1第一节 离子和小分子的跨膜运输
-
1.5.2第二节 生物大分子和颗粒的跨膜转运
-
1.5.3第三节 细胞内蛋白质的转运
-
1.5.4第四节 细胞内蛋白质的加工和分泌
-
1.5.5第五节 细胞物质运输与医学
-
1.6第五章 细胞的信号转导
-
1.6.1第一节 胞外信号
-
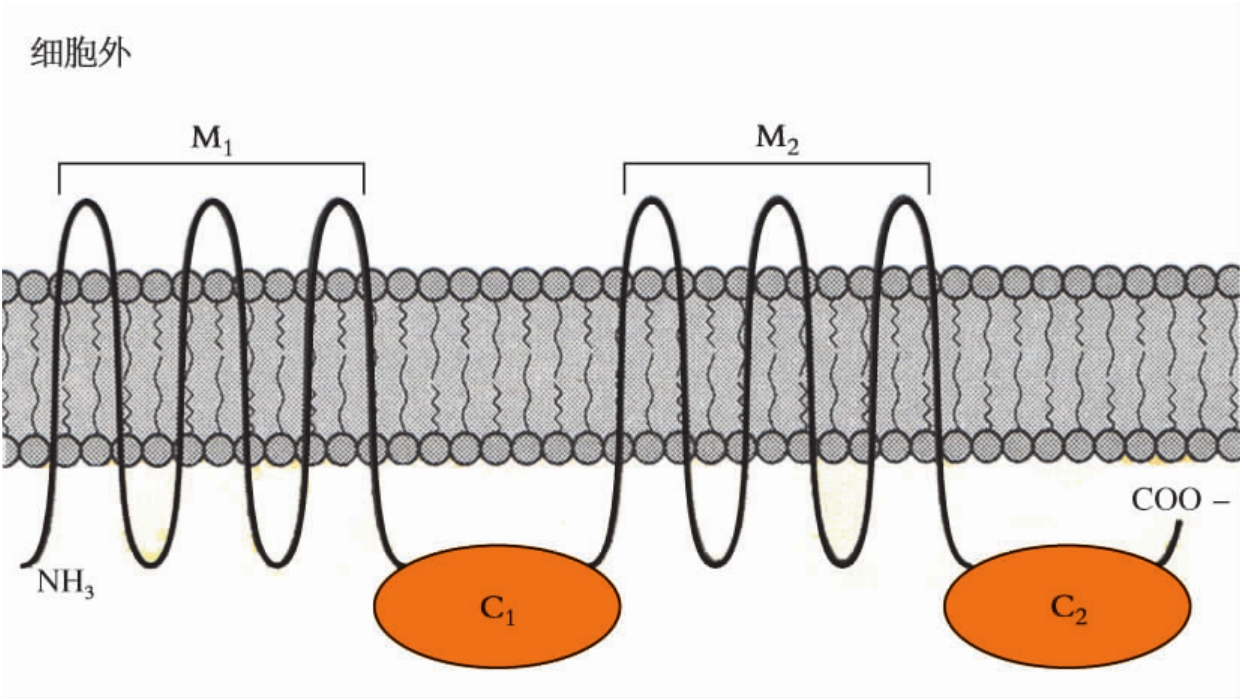
1.6.2第二节 受 体
-
1.6.3第三节 G蛋白
-
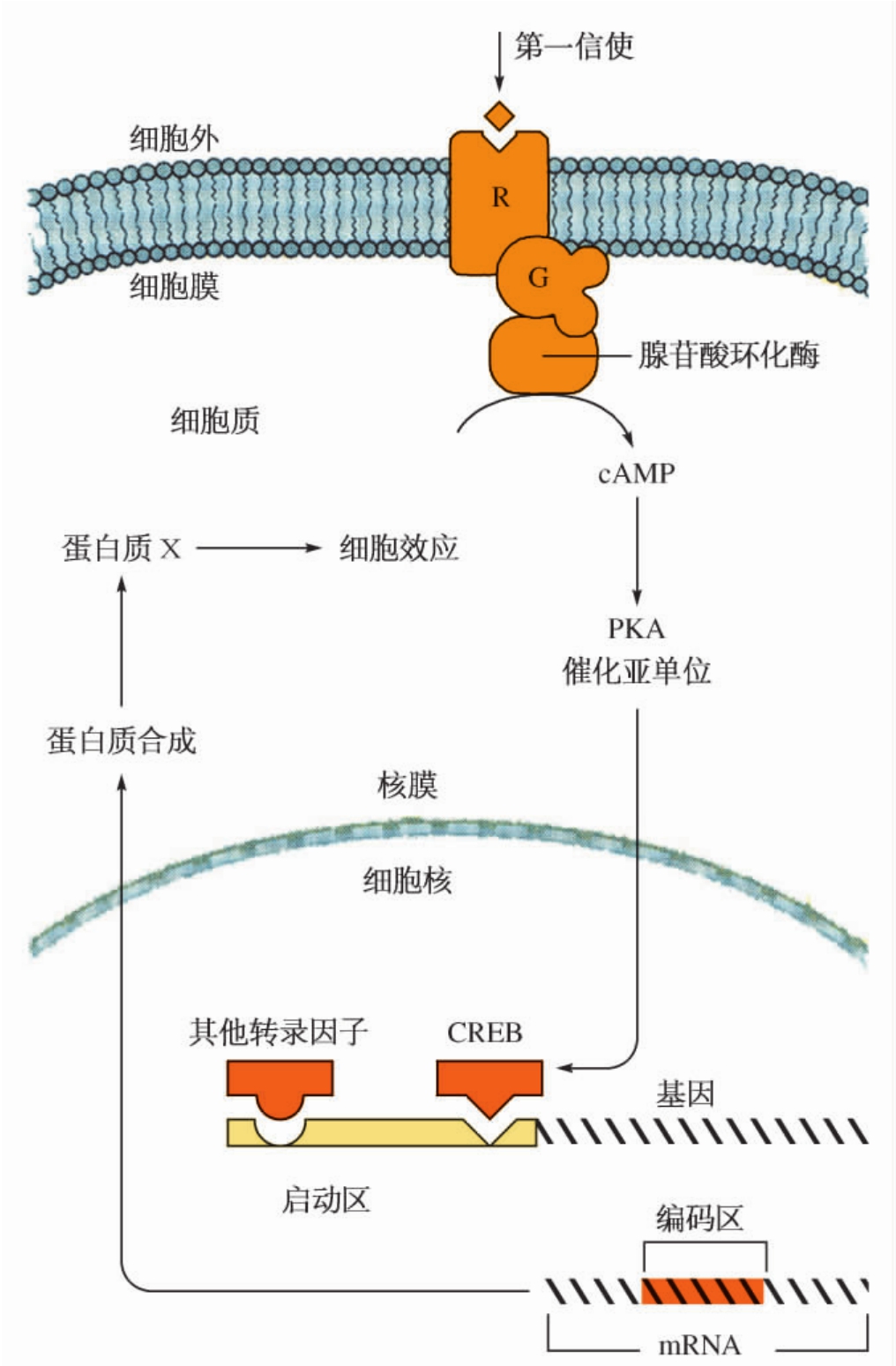
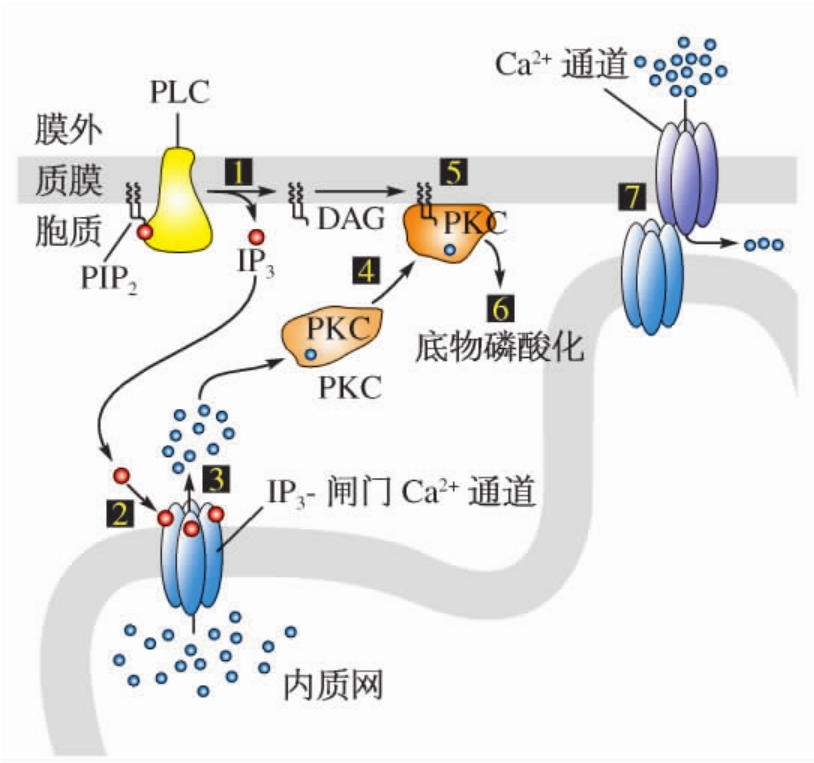
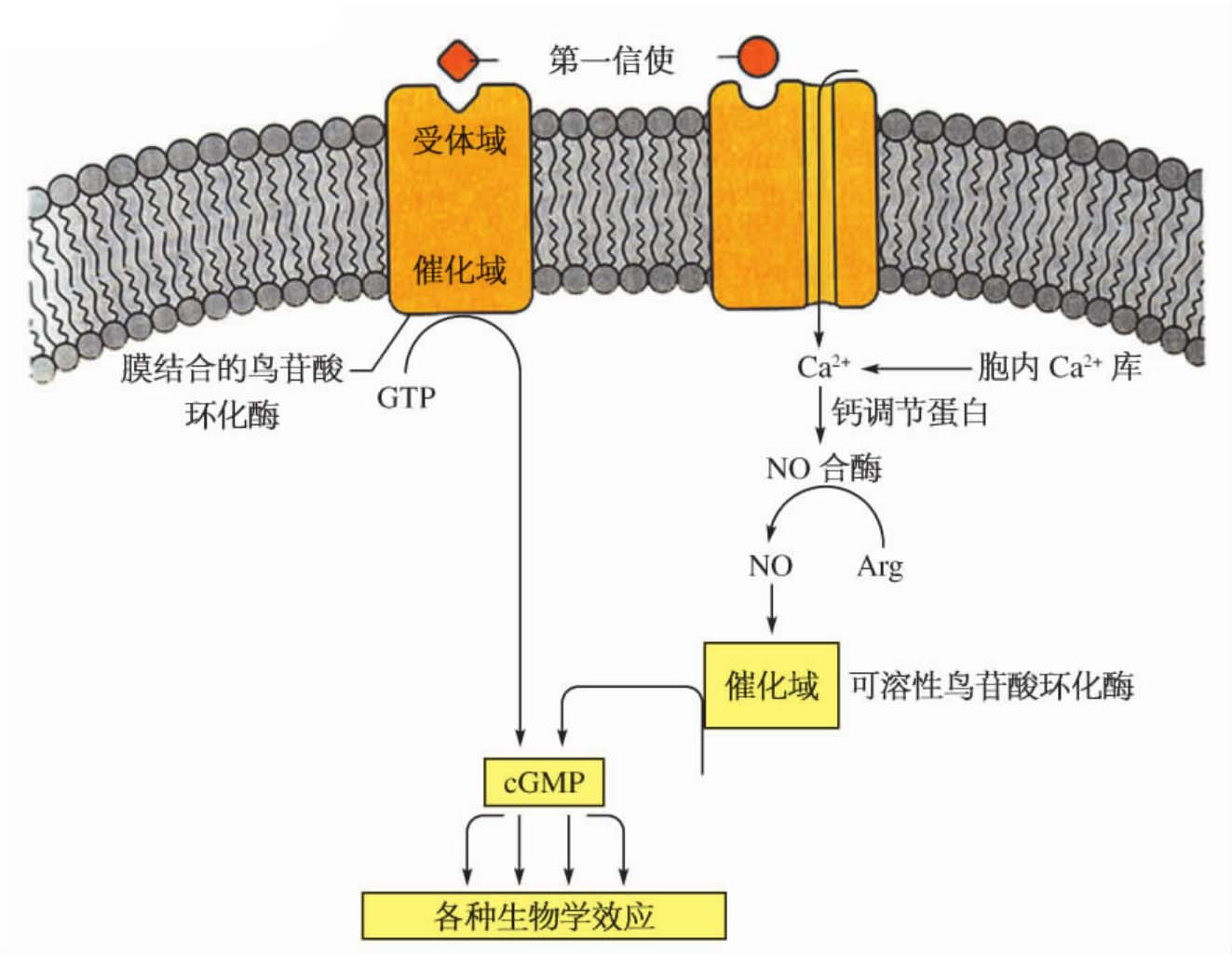
1.6.4第四节 第二信使及其介导的下游信号途径
-
1.6.5第五节 信号转导途径的主要特点
-
1.6.6第六节 细胞信号转导联盟
-
1.6.7第七节 信号转导与医学
-
1.7第六章 细胞的能量转换
-
1.7.1第一节 细胞呼吸与能量分子
-
1.7.2第二节 细胞的能量转换
-
1.7.3第三节 细胞能量代谢与医学
-
1.8第七章 细胞运动
-
1.8.1第一节 细胞运动的形式
-
1.8.2第二节 细胞运动的机制与实例
-
1.8.3第三节 细胞运动的调节
-
1.8.4第四节 细胞运动与医学
-
1.9第八章 细胞内遗传信息的流动
-
1.9.1第一节 基因的结构
-
1.9.2第二节 DNA复制
-
1.9.3第三节 转 录
-
1.9.4第四节 翻 译
-
1.9.5第五节 遗传信息流动与医学
-
1.10第九章 细胞增殖
-
1.10.1第一节 细胞增殖周期概述
-
1.10.2第二节 细胞周期各期的主要特征
-
1.10.3第三节 细胞增殖的调控因素
-
1.10.4第四节 减数分裂和生殖细胞的发生
-
1.10.5第五节 细胞周期与肿瘤
-
1.11第十章 细胞分化
-
1.11.1第一节 细胞分化的基本概念
-
1.11.2第二节 细胞的分化潜能
-
1.11.3第三节 细胞分化的调控
-
1.11.4第四节 影响细胞分化的因素
-
1.11.5第五节 细胞分化与肿瘤
-
1.12第十一章 干细胞与组织再生
-
1.12.1第一节 人体细胞的再生
-
1.12.2第二节 干细胞及其生物学特性
-
1.12.3第三节 胚胎干细胞
-
1.12.4第四节 成体干细胞
-
1.12.5第五节 组织的再生与医学
-
1.13第十二章 细胞衰老
-
1.13.1第一节 细胞的衰老
-
1.13.2第二节 细胞衰老机制
-
1.14第十三章 细胞死亡
-
1.14.1第一节 细胞死亡的概念及其基本特征
-
1.14.2第二节 细胞凋亡的机制
-
1.14.3第三节 细胞凋亡与疾病
-
1.15参考书目和进一步阅读书目
1
医学细胞生物学(第四版)