-
1.1前 言
-
1.2第一章 临床微生物学
-
1.2.1第一节 常见病原微生物的诊断及其临床意义
-
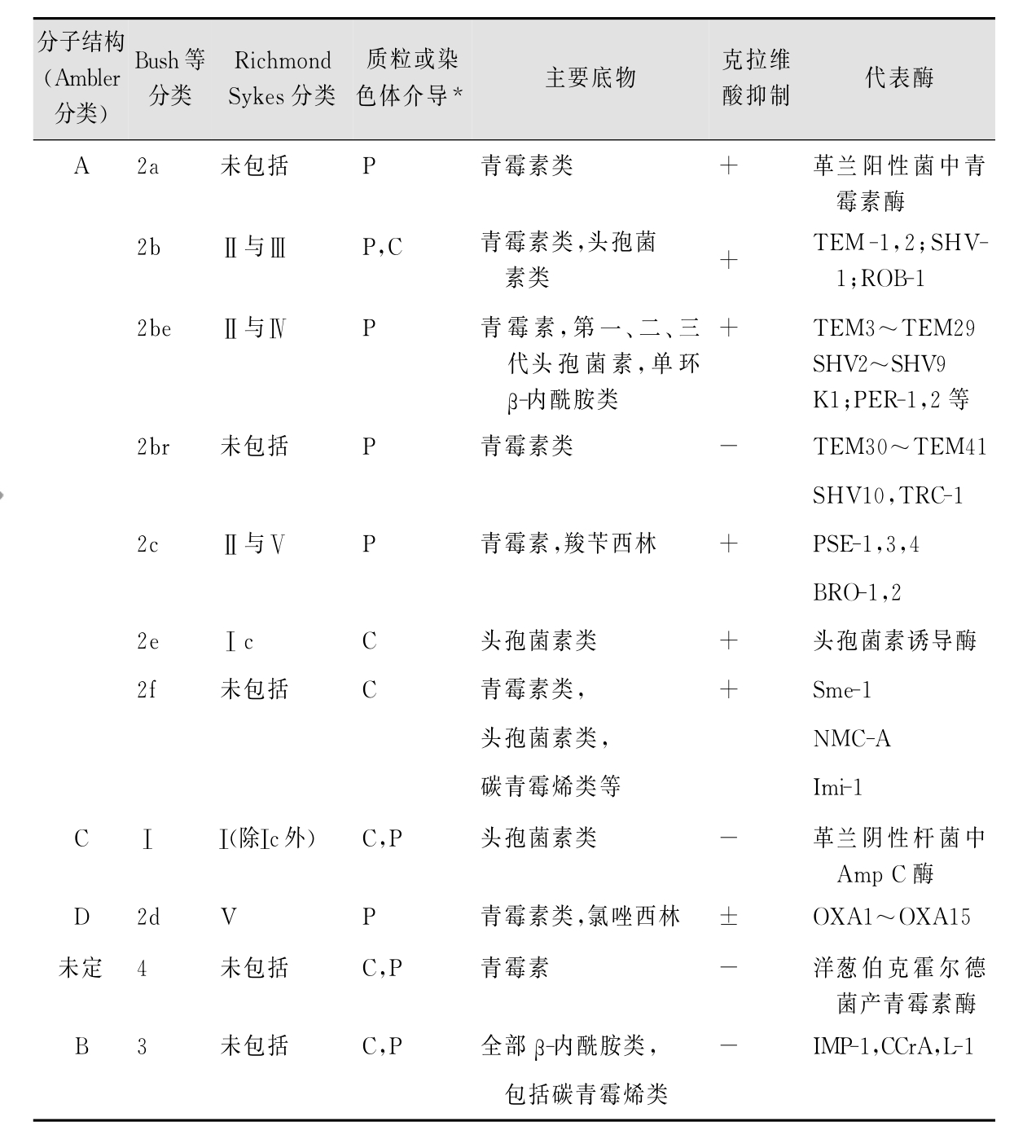
1.2.2第二节 细菌耐药性及其变迁
-
1.2.3第三节 与抗菌药物治疗有关的实验室检查
-
1.3第二章 抗感染药的临床药理学
-
1.3.1第一节 临床药物代谢动力学的基本概念
-
1.3.2第二节 治疗药物监测及个体化给药
-
1.4第三章 抗感染药的临床应用
-
1.4.1第一节 抗感染药的临床应用原则
-
1.4.2第二节 抗感染药的预防性应用
-
1.5外科手术后感染预防用药,见表3-2、3-3。
-
1.5.1第三节 抗感染药的治疗性应用
-
1.5.2第四节 抗感染药的不良反应及其防治
-
1.6第四章 抗感染药在特殊情况下的应用
-
1.6.1第一节 肝功能减退时抗感染药的应用
-
1.6.2第二节 肾功能减退时抗感染药的应用
-
1.6.3第三节 抗菌药物在老年人和新生儿患者中的应用
-
1.6.4第四节 抗感染药在妊娠期和哺乳期患者中的应用
-
1.7第五章 各类抗感染药简介
-
1.7.1第一节 青霉素类
-
1.7.2第二节 头孢菌素类
-
1.7.3第三节 其他β-内酰胺类
-
1.7.4第四节 氨基糖苷类
-
1.7.5第五节 大环内酯类
-
1.7.6第六节 四环素类
-
1.7.7第七节 氯霉素类
-
1.7.8第八节 林可霉素类
-
1.7.9第九节 其他抗生素
-
1.7.10第十节 喹诺酮类
-
1.7.11第十一节 呋 喃 类
-
1.7.12第十二节 磺胺类药与磺胺增效剂
-
1.7.13第十三节 甲硝唑及替硝唑
-
1.7.14第十四节 抗分枝杆菌药
-
1.7.15第十五节 抗真菌药
-
1.7.16第十六节 抗病毒药
-
1.7.17第十七节 抗 HIV 药
-
1.7.18第十八节 抗原虫药
-
1.8第六章 抗感染药的临床应用
-
1.8.1第一节 血流感染
-
1.8.2第二节 感染性心内膜炎
-
1.8.3第三节 中枢神经系统感染
-
1.8.4第四节 呼吸道感染
-
1.8.5第五节 尿路感染和前列腺炎
-
1.8.6第六节 急性感染性腹泻
-
1.8.7第七节 其他内科感染性疾病
-
1.8.8第八节 免疫缺陷者感染
-
1.8.9第九节 医院感染
-
1.8.10第十节 分枝杆菌感染
-
1.8.11第十一节 深部真菌病
-
1.8.12第十二节 厌氧菌感染
-
1.8.13第十三节 外科感染性疾病
-
1.8.14第十四节 骨、关节感染
-
1.8.15第十五节 妇产科感染性疾病
-
1.8.16第十六节 眼科、耳鼻喉科及口腔科感染
-
1.8.17第十七节 性传播性疾病
-
1.9附录一 常见感染的经验治疗
-
1.10附录三 感染性疾病的疗程
-
1.11附录三 抗菌药物的每日常用剂量
-
1.12附录四 不同病原菌感染的抗菌药物选择
-
1.13附录五 新生儿的抗菌药剂量和用法
-
1.14附录六 几种高度耐药菌感染的治疗
-
1.15附录七 常见细菌英汉名词对照
-
1.16附录八 常见细菌汉英名词对照
-
1.17附录九 常见真菌英汉名词对照
-
1.18附录十 常见真菌汉英名词对照
1
感染性疾病与抗微生物治疗