-
1.1前 言
-
1.2第5章 物质的制备及表征
-
1.2.1基本实验
-
1.2.1.1实验51 硫酸亚铁铵的制备及纯度检验
-
1.2.1.2实验52 聚合硫酸铁的制备及净水效果实验
-
1.2.1.3实验53 纳米氧化锌粉的制备及质量分析
-
1.2.1.4实验54 四碘化锡的制备
-
1.2.1.5实验55 磷酸锌的微波合成
-
1.2.1.6实验56 三草酸合铁(Ⅲ)酸钾的合成及配离子组成测定
-
1.2.1.6.1Ⅰ 三草酸合铁(Ⅲ)酸钾的合成
-
1.2.1.6.2Ⅱ 三草酸合铁(Ⅲ)酸钾配离子组成的测定
-
1.2.1.7实验57 三氯化六氨合钴(Ⅲ)的制备及其化学式的确定
-
1.2.1.8实验58 卤代烃的制备
-
1.2.1.8.1Ⅰ 正溴丁烷的合成
-
1.2.1.8.2Ⅱ 2-氯丁烷的合成
-
1.2.1.8.3Ⅲ 溴苯的制备(普通合成和超声合成)
-
1.2.1.9实验59 醚的合成
-
1.2.1.9.1Ⅰ 甲基叔丁基醚(无铅汽油抗震剂)的合成
-
1.2.1.9.2Ⅱ 苯乙醚的合成
-
1.2.1.9.3Ⅲ 正丁醚的合成
-
1.2.1.10实验60 格氏反应
-
1.2.1.10.1Ⅰ 2-甲基-2-己醇的合成
-
1.2.1.10.2Ⅱ 2-甲基丁酸的合成
-
1.2.1.11实验61 坎尼扎罗反应
-
1.2.1.11.1Ⅰ 呋喃甲酸与呋喃甲醇的合成
-
1.2.1.11.2Ⅱ 苯甲酸与苯甲醇的合成
-
1.2.1.12实验62 傅氏反应
-
1.2.1.12.1Ⅰ 苯乙酮的合成
-
1.2.1.12.2Ⅱ 对二叔丁基苯的制备
-
1.2.1.12.3Ⅲ 食品中抗氧剂TBHQ的制备
-
1.2.1.13实验63 酯化反应
-
1.2.1.13.1Ⅰ 苯甲酸乙酯的合成
-
1.2.1.13.2Ⅱ 增塑剂———邻苯二甲酸二丁酯的合成
-
1.2.1.14实验64 局部麻醉剂的制备
-
1.2.1.15实验65 乙酰水杨酸的合成(酰化反应)
-
1.2.1.16实验66 肉桂酸的制备(Perkin反应)
-
1.2.1.17实验67 乙酰乙酸乙酯的合成(Claisen酯缩合)
-
1.2.1.18实验68 环己酮的合成(氧化反应)
-
1.2.1.19实验69 甲基橙的制备(重氮化反应)
-
1.2.1.20实验70 喹啉的制备(Skraup反应)
-
1.2.1.21实验71 Diels-Alder环加成反应
-
1.2.1.22实验72 苯频那醇的光化学制备及重排反应
-
1.2.1.23实验73 微波制备苯甲酸
-
1.2.1.24实验74 苯胺的绿色合成
-
1.2.1.25实验75 超声合成苯氧乙酸
-
1.2.2综合性实验
-
1.2.2.1实验76 从印刷电路烂板液制备硫酸铜及间接滴定法测定产品中铜的含量
-
1.2.2.1.1Ⅰ 硫酸铜的制备
-
1.2.2.1.2Ⅱ 硫酸铜中铜含量的测定
-
1.2.2.2实验77 [Co(NH<sub>3</sub>)<sub>6</sub>]Cl<sub>3</sub...
-
1.2.2.3实验78 纳米TiO<sub>2</sub>的制备、表征及光催化性能测试
-
1.2.2.4实验79 107胶的制备及性能测定
-
1.2.2.5实验80 三乙酸甘油酯的合成及薄层色谱分析
-
1.2.2.6实验81 绿色能源———生物柴油的制备
-
1.2.2.7实验82 固体超强酸的制备及乙酸正丁酯的合成与表征
-
1.2.2.8实验83 α-苯乙胺的制备与拆分
-
1.2.2.9实验84 二茂铁及乙酰二茂铁的合成
-
1.2.2.10实验85 离子液体催化合成食品防腐剂———对羟基苯甲酸乙酯
-
1.2.3设计性实验
-
1.2.3.1实验86 磷系列化合物的制备
-
1.2.3.2实验87 丙交酯的制备研究
-
1.3第6章 基本物理量和化学参数的测定
-
1.3.1基本实验
-
1.3.1.1实验88 恒温槽装配和性能测试
-
1.3.1.2实验89 燃烧热的测定
-
1.3.1.3实验90 溶解热的测定
-
1.3.1.4实验91 差热分析法研究CuSO<sub>4</sub>·5H<sub>2</sub>O的热稳定性
-
1.3.1.5实验92 乙醇-乙酸乙酯双液系相图
-
1.3.1.6实验93 凝固点降低法测定萘的摩尔质量
-
1.3.1.7实验94 易挥发物质摩尔质量的测定
-
1.3.1.8实验95 化学反应速率与活化能的测定
-
1.3.1.9实验96 旋光度法测定蔗糖水解反应的速率常数
-
1.3.1.10实验97 电导法测定乙酸乙酯皂化反应的速率常数
-
1.3.1.11实验98 量气法测定一级分解反应的速率常数
-
1.3.1.12实验99 pH法、电导率法、滴定曲线法测定醋酸的电离平衡常数
-
1.3.1.12.1Ⅰ pH法测定醋酸的电离平衡常数
-
1.3.1.12.2Ⅱ 电导率法测定醋酸的电离平衡常数
-
1.3.1.12.3Ⅲ 滴定曲线法测定醋酸的电离平衡常数
-
1.3.1.13实验100 甲基红的酸电解平衡常数的测定———分光光度法
-
1.3.1.14实验101 铈(Ⅳ)-乙醇配合物组成及生成常数的测定
-
1.3.1.15实验102 硫酸钙溶度积常数的测定
-
1.3.1.16实验103 电解质溶液电导的测定
-
1.3.1.17实验104 电极制备及电池电动势的测定
-
1.3.1.18实验105 氢阴极析出极化曲线的测定
-
1.3.1.19实验106 金属钝化曲线的测定
-
1.3.1.20实验107 表面张力的测定
-
1.3.1.21实验108 溶液吸附法测定固体比表面
-
1.3.1.22实验109 黏度法测定高聚物的相对分子质量
-
1.3.1.23实验110 液体饱和蒸气压的测定
-
1.3.1.24实验111 偶极矩和介电常数的测定
-
1.3.1.25实验112 磁化率的测定
-
1.3.1.26实验113 联机测定B-Z化学振荡反应
-
1.3.2综合性实验
-
1.3.2.1实验114 磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数的测定
-
1.3.2.2实验115 Fe(OH)<sub>3</sub>溶胶的制备及聚沉值、ζ电位的测定
-
1.3.2.2.1Ⅰ 溶胶的制备及聚沉值的测定
-
1.3.2.2.2Ⅱ Fe(OH)<sub>3</sub>溶胶的电泳及ζ电位的测定
-
1.3.2.3实验116 液膜分离废水中的醋酸
-
1.3.2.4实验117 酪氨酸酶的提取及其催化活性研究
-
1.3.2.5实验118 硅铝酸钠沸石分子筛的制备及其物性测定
-
1.3.2.6实验119 明胶等电点的测定与明胶软胶的吸水膨胀
-
1.3.2.7实验120 电导法测定表面活性剂临界胶束浓度
-
1.4第7章 研究创新型实验
-
1.5附 录
-
1.5.1附录A 常用仪器操作技术
-
1.5.2附录B 常用数据表
-
1.5.3主要参考文献
1
大学化学实验(下)
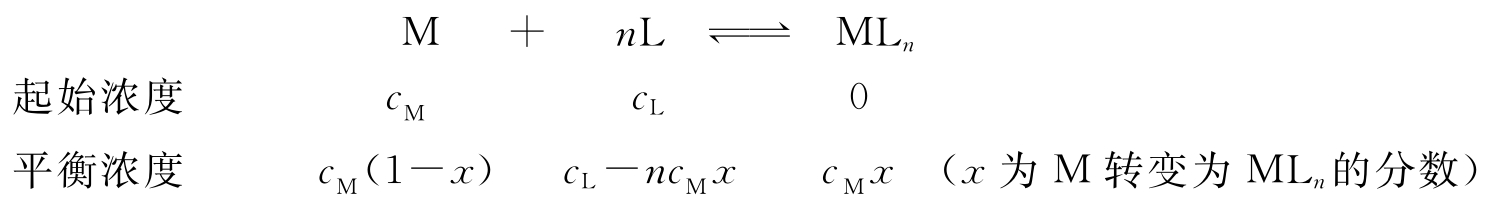
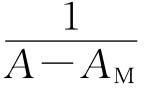 对
对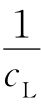 作图,如果是一直线,则证明n=1,按式(3)从直线的斜率和截距可求得K。
作图,如果是一直线,则证明n=1,按式(3)从直线的斜率和截距可求得K。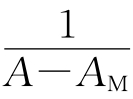 (A用各条件下测得的最大值,为什么?)对
(A用各条件下测得的最大值,为什么?)对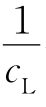 作图,验证是否为直线。如不为直线,则用
作图,验证是否为直线。如不为直线,则用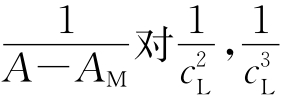 ,…作图再行验证,直到得出直线即可确定出n值。
,…作图再行验证,直到得出直线即可确定出n值。