第一节 粪便检查和肛门拭子法
粪便检查是寄生虫感染病原学检查的重要组成部分。肠道寄生虫及部分非肠道寄生虫病原体均可随粪便排出。少数寄生虫(如蛲虫)主要在肛门周围排卵,则须采用肛门拭子法进行检查。
一、粪便检查注意事项
粪便检查结果的可靠性与标本的采集、检查时间及检查方法密切相关,以下注意事项至关重要。
1.送检粪便应新鲜,以自然排出的粪便为佳。储存标本的容器应干净,无水、尿及化学药品等污染。容器上应有标签,写明受检者单位、姓名及编号等。
2.送检粪量一般为5~10g(约为白果大小);若作自然沉淀、尼龙袋集卵、血吸虫毛蚴孵化,则粪量应不少于30g(约为鸡蛋大小);若检查成虫(如淘虫),尚需留取患者的24小时内全部粪便。
3.要及时检查粪便标本,特别是在检查原虫滋养体时,须在粪便排出后半小时内检查;气温较低时,还应注意保温;若暂时不能检查,则应将标本保存在冰箱内(4℃),或将部分标本用福尔马林固定保存。
4.应注意粪便的硬度、颜色等物理性状以及有无黏液、脓血等,并及时予以记录。
5.混在粪便中的酵母菌、白细胞或脓细胞、巨噬细胞、上皮细胞、脂肪滴、气泡、植物细胞及纤维等易与原虫包囊、滋养体或蠕虫的虫卵、幼虫等混淆,在检查时应注意加以鉴别(图17-1)。
6.在检查过程中应避免粪便污染设备或环境,查完的标本片和剩下的粪便标本应投入消毒缸内消毒处理。
二、常用粪检方法
(一)湿涂片法(Wet smearmethod)
湿涂片检查法为粪便薄涂片检查技术,为检查粪便中蠕虫卵和幼虫、原虫包囊和滋养体等病原的常用方法。
1.生理盐水直接涂片法(Direct saline smearing)。
本法是粪便检查最常用的一种方法。其原理是用生理盐水稀释粪便,病原体在等渗环境中可保持其固有性状及活力,便于观察、识别和鉴定。该法尤适用于蠕虫卵、原虫滋养体的检查,也是适用范围最广的一种方法;对检查活的虫体,更是不可少的一种检验手段。但因取粪量少,容易漏诊,此为其不足之处。若每份粪便连续检查3张涂片,则可大大提高其检出率。
【蠕虫卵检查】
滴1~2滴生理盐水在洁净的载玻片中央,然后用竹签挑取火柴头大小的粪便,在生理盐水中捣碎、调匀涂开,并剔除粗大的粪渣及纤维。粪膜呈椭圆形或长条状,其大小范围为玻片长、宽的1/2~2/3。粪膜厚度以透过涂片可辨认纸上的字迹为宜;若过厚,光线不易透过;而过薄,则检出率降低。通常,先在低倍镜下按顺序检查;必要时可加盖玻片,转换高倍镜观察。常见蠕虫卵形状见图17-2。
【原虫滋养体检查】
基本方法同蠕虫卵检查,涂片应薄而均匀,加盖玻片后镜检。粪便尤须新鲜,宜取黏液、脓血部分及时作涂片检查。气温低时应用保温台保温观察,以保持滋养体的活力,便于识别。简易保温台系采用薄铜片制成“T”形板,横条中央开一圆孔(与显微镜载物台透光孔等大)。检查时,“T”形板的横条部分在载物台上,湿片置于其上;竖条部分则伸出镜台外,其下方用酒精灯加热,若置于近载玻片一端的小石蜡块缓缓熔化,则表明温度适宜。条件允许时,采用装有恒温罩的显微镜检查或在空调室内镜检则更好。
2.碘液染色法(Iodine staining)。
碘液染色法主要用于粪内原虫包囊的检查。欲观察原虫包囊的核、糖原块、拟染色体,须用碘液染色后才能清楚地显示。
【卢戈碘液配方】
碘化钾4g,碘2g,蒸馏水100ml。

图17-1 粪内常见物体示意图

图17-2 常见蠕虫卵模式图
【操作方法】
与直接涂片法相似,不过是以1~2滴卢戈碘液代替生理盐水而已。先在低倍镜下寻找比大头针头还要小的圆形或椭圆形的棕黄色包囊,然后加盖玻片在高倍镜下仔细观察。当然,亦可先作生理盐水直接涂片,然后加上盖玻片,再从盖玻片一侧滴加1滴碘液,待碘液向对侧渗入(数秒钟)后给予镜检;在同一载玻片上,一端作生理盐水直接涂片,另一端作碘液染色涂片,分别检查原虫的滋养体和包囊。
【注意事项】
所用碘液不宜太多、太浓,否则粪便凝成团块,包囊结构(如囊壁、胞核等)折光性降低,反而有碍于镜检。
3.改良抗酸染色法(Modified acid-fast staining)。
改良抗酸染色法为检查隐孢子虫卵囊的常用方法,且比较简便。
【染液备制】
石碳酸复红染(Ⅰ液):碱性复红4g,95%酒精20ml,石碳酸8ml,蒸馏水100ml。
13%盐酸溶液(Ⅱ液):分析纯盐酸3ml,95%酒精100ml(一边搅拌,一边慢慢滴入盐酸)。
1∶10孔雀绿工作液(Ⅲ液):孔雀绿原液(孔雀绿2g,蒸馏水100ml)1ml,蒸馏水10ml。
【染色方法】
涂制薄层粪膜(同生理盐水直接涂片法),干后用甲醇固定或通过火焰来回3次(以不烫手为度)。在粪膜上滴加Ⅰ液,盖满粪膜;染色1.5~5分钟后,用清水轻轻冲洗干净(下同)。滴加Ⅱ液,染色1~3分钟,水洗。滴加Ⅲ液,1分钟后水洗,待干(或以软纸吸干),镜检。染色后的标本背景呈蓝绿色,卵囊为玫瑰红色,呈圆形或椭圆形,内含4个裸露的子孢子。
【注意事项】
若着色太深,可用3%盐酸酒精脱色(在镜下边观察边脱色)。镜检时,应注意卵囊与粪内类似物(无内容物或特定结构)的鉴别。
(二)浓集法(Concentration method)
浓集法可将较多量的粪便中的原虫包囊、蠕虫卵浓集,从而提高检出率。常用的浓集法有厚涂片法、沉淀法、浮聚法及尼龙袋集卵法等。
1.加藤厚涂片法(Kato’s thick smearing)。
加藤厚涂片法采用粪便作厚涂片,其目的在于增加视野中的虫卵数量。而甘油可使粪便透明,便于光线透过,以便镜检虫卵;孔雀绿则可使视野光线柔和,减少眼疲劳。该法适用于检查蠕虫卵,操作简便。在操作过程中,虫卵不会散失,故检查效果较好。
【甘油—孔雀绿玻璃纸制备】
将亲水性玻璃纸一一剪成30mm×22mm大小的长方条,浸于甘油—孔雀绿溶液(纯甘油100ml,蒸馏水100ml,3%孔雀绿水溶液1ml)中,24小时后玻璃纸浸透呈绿色即可使用。
【操作方法】
先用100目/吋金属筛(或尼龙袋)除去粪便内粗渣,置于载玻片上,然后取50mg左右(若须作定量检查,则须用特制的定量板,详见虫卵计数部分)置洁净的载玻片上,并覆以甘油—孔雀绿玻璃纸片,用另一张载玻片轻压,使粪便平铺成约25mm×20mm大小的粪膜,置30℃~36℃温箱中半小时或25℃温箱中约1小时,待粪膜透明后即可镜检。
【注意事项】
过硬或过稀的粪便均不宜使用本法。泡沫状的粪便可在玻璃纸下形成多量微细小气泡,有碍于镜检。要严格掌握粪膜的合适厚度及透明时间;粪膜厚,则透明时间短,难以查见虫卵;透明时间过长,因虫卵过分透明或已变形,亦不易辨认,甚至可造成漏检。
2.沉淀法(Sedimentation method)。
沉淀法亦有助于提高检出率。其原理是利用原虫包囊和蠕虫卵的比重大于水,因而在水中易于下沉、浓集,再取沉淀物作涂片镜检,即可提高检出率。沉淀所需时间与包囊或虫卵的比重及粪液浓度有关。但对于比重较小的钩虫卵和包囊,此法效果较差。
(1)自然沉淀法(Natural sedimentation method)。
本法亦称水洗沉淀法或静置沉淀法(图17-3)。适用于各种蠕虫卵和幼虫以及原虫包囊的检查,尤其适用于血吸虫卵等有盖虫卵的检查。对于比重较小的包囊和钩虫卵等,此法效果较差。
【操作方法】
取粪便20~30g,在搪瓷缸内加水调成糊状。加水稀释后,经40~60目/吋金属筛过滤至500ml锥形量杯中。用水清洗筛内和缸中的粪渣,使量杯中的水至满(距杯口约1cm,下同)。静置30分钟,倾去中上层粪液。再加清水至满,沉淀20分钟,倾去中上层粪液。然后,每隔20分钟换水一次,如此沉淀3~4次,直至上液澄清为止。最后,倾去上清液,吸取沉渣作涂片、镜检。
【注意事项】
在操作中应根据过滤物大小选用合适的粪筛。
(2)倒置沉淀法(Inverted sedimentation method)。
【操作方法】
取0.5g左右的粪便置一小杯中,加水充分捣碎、混匀,经金属丝筛或湿纱布将粪液滤入另一青霉素瓶中,并加水至满,并在瓶口加一洁净的载玻片,静置15分钟。然后,连同青霉素瓶一齐翻转,使瓶倒立于载玻片上。静置15~20分钟后,两者一并迅速翻转,再立即提起载玻片迅速翻转过来,置镜下检查。该法主要用于检查华支睾吸虫卵,但视野的清晰度稍差。

图17-3 自然沉淀法和毛蚴孵化法
【注意事项】
青霉素瓶口一定要平整、光滑。
(3)离心沉淀法(Centrifuge sedimentation method)。
【操作方法】
取5g左右粪便置小杯内,加10ml清水,将粪便捣碎、调匀,经两层湿纱布滤入离心管中,离心(1 500~2 000r/min)1~2分钟。倾去上层粪液,再注入清水、离心沉淀。如此反复3~4次,直至上层液澄清为止;倾去上层液,取沉渣镜检。此法可用于检查蠕虫卵和原虫包囊,其效果与自然沉淀法相似,但费时少,适用于临床检验。
【注意事项】
离心时,一定要注意平衡。
(4)醛醚沉淀法(Formalin-ether sedimentation method)。
本法采用福尔马林固定虫卵和包囊,并用乙醚除去粪便中的脂肪,而分离出来的较轻的粪渣上浮,使虫卵和包囊沉入管底,以利于浓集虫卵,从而提高了检出率。
【操作方法】
取粪便1g,加水10~15ml捣碎调匀,过滤于15ml离心管中,2 000r/min离心2分钟,倾去上层粪液,沉渣内加水10ml调匀,离心2分钟,倾去上层液,加10%甲醛10ml,搅匀沉淀,静置5~10分钟,加乙醚3ml,用橡皮塞紧塞瓶口,充分摇匀,取下瓶塞离心2分钟,即可见管内自上而下分4层(自上而下为乙醚、黏附于管壁的粪渣、粪液、沉淀物),取管底沉淀物作涂片镜检即可。如欲查原虫包囊,则可作碘液染色,加盖玻片后镜检。
本法浓集效果好,其检出率可比一般粪便涂片法提高20~30倍,且不损伤包囊及虫卵形态,有利于鉴别检查。对于含脂肪较多的粪便,浓集效果比硫酸锌浮聚法好。然而,对于短膜壳绦虫卵、蓝氏贾第鞭毛虫包囊和布氏嗜碘阿米巴包囊的浓集效果欠佳。
【注意事项】
本法可对滋养体造成破坏。
(5)汞碘醛液离心沉淀法(Merthiolate-iodine-formaldehyde centrifuge sedimentation method,M IFC)。
本法较醛醚沉淀法增加了硫柳汞酊和卢戈碘液,具有固定、保存、浓集和染色作用,有利于发现和鉴别原虫包囊;也适用于原虫滋养体、蠕虫卵和幼虫的检查。
【汞碘醛液配制】
汞醛液:1/1 000硫柳汞酊200m l,甲醛25m l,甘油5ml,蒸馏水250ml。卢戈碘液:碘5g,碘化钾10g,蒸馏水100ml。
【操作方法】
取汞醛液9.4ml及卢戈碘液0.6ml,混合后立即加入粪便1g,充分搅匀,经两层湿纱布滤入15m l离心管中,加入乙醚4m l,盖橡皮塞振摇2分钟,去除橡皮塞,2 000r/min离心2分钟,管内分为4层,即乙醚层、蜡状粪渣层、汞碘醛液层及沉淀物层。最后,吸弃上3层,取沉淀物作涂片,加盖玻片镜检。汞碘醛液离心沉淀法主要用于检查原虫包囊和蠕虫卵,也可检查原虫滋养体。可用汞碘醛液作直接涂片法,检查原虫包囊和滋养体。此方法若准确称取粪便,还可以作蠕虫卵的定量检查,以测定感染度。
【注意事项】
汞碘醛液需在检查时混合,混合液8小时后变质。卢戈碘液保存不宜超过一周。
3.浮聚法(Flotation method)。
本法系利用比重较大的液体,使比重较小的蠕虫卵或原虫包囊上浮,集中于液体表面,以提高检出率,其效果优于沉淀法。常用的浮聚法有以下两种:
(1)饱和盐水浮聚法(Brine flotation method)。
【操作方法】
用竹签取黄豆粒大小的粪便置于浮聚瓶(高3.5cm、直径2cm的圆形直筒,也可用青霉素瓶代替)内,先加入少量饱和盐水(约2ml)调匀,再加饱和盐水至瓶口;挑去上浮粪渣,滴加饱和盐水至液面略高于瓶口而不溢出为止(图17-4)。取一洁净的载玻片,一侧先搁在瓶口边上,另一侧再轻轻置于液面上,静置15分钟后,将载玻片缓缓提起并迅速翻转,置镜下镜检。本法适用于检查比重小于1.20的线虫卵及微小膜壳绦虫卵,以检查钩虫卵及鞭虫卵的效果为最好,但不适用于吸虫卵及原虫包囊的检查,故应用范围不够广。
【饱和盐水配制】
将食盐徐徐加入盛有沸水的容器中,不断搅动,直至食盐不再溶解为止。100ml沸水约需38~40g食盐。饱和盐水的比重约为1.20。
【注意事项】
操作时瓶口与载玻片之间不能有气泡与粗大粪渣;静置时间不宜太长或过短;载玻片翻转要平稳而迅速。
(2)硫酸锌液离心浮聚法(Zine sulfate centrifuge flotation)。
【硫酸锌溶液配制】
硫酸锌40g,加水100ml,充分溶解,用密度计测定其比重,如高于1.18,则加水;如低于1.18,则加硫酸锌,务必矫正至比重为1.18。
【操作方法】
取粪便约1g置小烧杯(先加入2ml水)内,加10~15倍水,充分捣碎、搅匀,经2层湿纱布滤入10m l离心管内,2 500r/min离心1分钟,倾去上层液,反复数次,直至离心管内上层水澄清为止。弃去上清液,加入33%饱和硫酸锌(比重1.18)至瓶口下1cm处,离心1分钟。然后,用直径约0.5cm的金属(如铅丝)环取表面液膜置载玻片上,于高倍镜下镜检。本法主要检查比重较小的原虫包囊和部分蠕虫卵,尤适于检查粪类圆线虫卵。如将硫酸锌溶液比重提高到1.23,则可浮聚华支睾吸虫卵等比重稍大的蠕虫卵。
【注意事项】
离心沉淀后,须待离心机自然停止。加硫酸锌溶液之前,应将管内上层液倒尽;离心后吊取标本时,应用金属环轻轻接触液面,切勿搅动液面。制片后应立即镜检;若搁置时间超过1小时,则包囊和虫卵均可能变形或下沉,从而影响检查结果。欲检查原虫包囊,应加碘液和盖玻片。
常见蠕虫卵、原虫包囊的比重见表17-1。
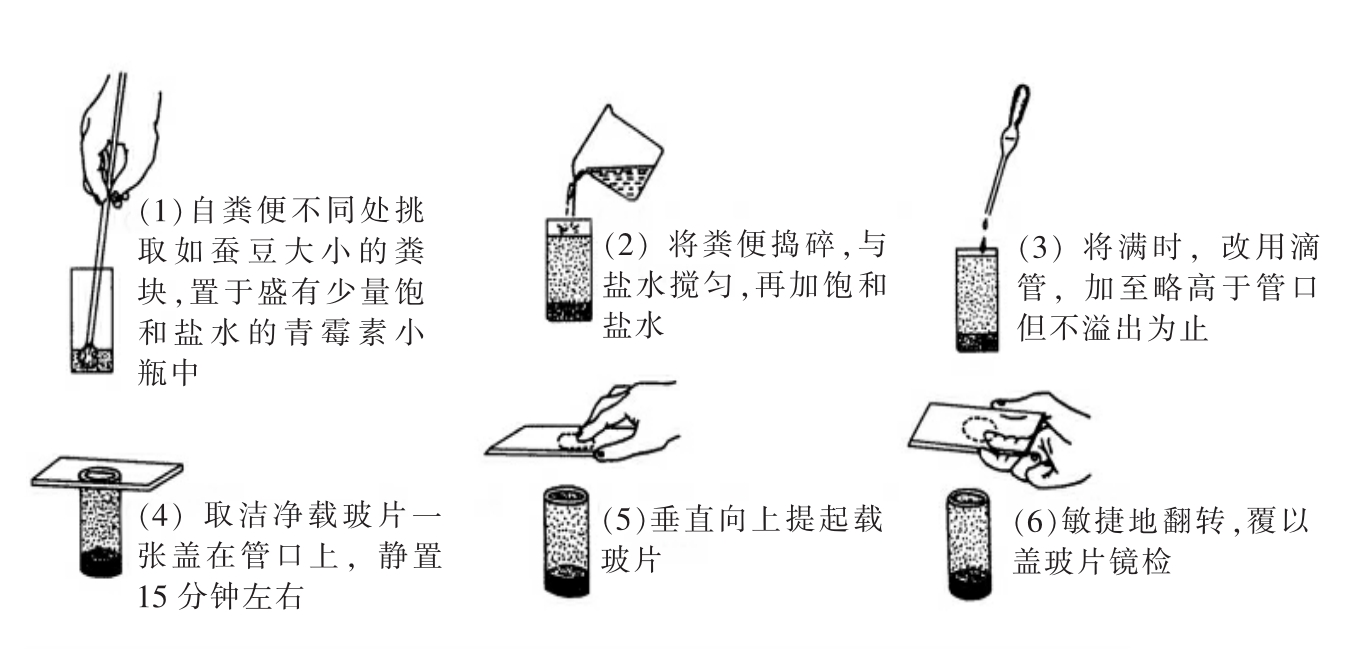
图17-4 饱和盐水浮聚法
表17-1 常见蠕虫卵、原虫包囊的比重表

4.尼龙袋集卵法(Method of concentration using nylon bag)。
本法分别以孔径略大于和略小于日本血吸虫卵的两个尼龙袋较快地滤除粪便中的粪渣,并较好地收集血吸虫卵。
【尼龙袋的制备】
将尼龙绢剪成圆片,周边缝于带柄的铁丝圆圈上,制成圆底形尼龙袋。内袋为120目/吋,筛径8cm,深约8cm;外袋为260目/吋,筛径10cm,深约10cm。
【操作方法】
将120目/吋(内袋)和260目/吋(外袋)的二尼龙袋套在一起,浸于盛有1 000ml水的塑料盆(桶)内。然后,取30g粪便于盛有少量水的搪瓷杯内捣碎、调匀,经60目/吋铜筛滤入上述内层尼龙袋(套入外袋)内,并将内、外二尼龙袋一起在清水盆(或桶)内缓缓地上下提放、洗涤,过滤袋内粪液;也可在自来水莲蓬状喷头下缓缓冲洗,至滤出的水澄清为止。然后,将内袋提出水面,洗去袋(外翻)内粪便;而将外袋(外翻)中收集的滤出物(内含血吸虫卵)全部洗入锥形量杯内,静置15分钟,倾去上层粪液,吸取沉渣镜检虫卵,并可进一步作血吸虫毛蚴孵化。
本法主要用于浓集血吸虫卵,集卵速度较快,用水量少,虫卵损失少;且尼龙袋便于携带,适合于大范围普查时应用。
【注意事项】
操作时应用水缓洗,不可用竹片、玻棒等在尼龙袋内搅拌或挤压。尼龙袋用毕,应将其放入来苏儿液中浸泡、消毒30分钟,然后用清水冲洗,绝不能刷洗或搓揉;亦忌用热水烫洗,以防尼龙袋的孔径扩大、缩小或变形。用清水洗净后,再晾干、保存。
(三)虫卵计数法(Egg countmethod)
定量计数每克粪便中的虫卵数,以测定某些蠕虫的感染度,以指导用药、判断疗效和考核防治效果等。常用的虫卵计数法有以下几种。
1.改良加藤厚涂片法(Modified kato's thick smearing)。
本法亦称Kato-Katz法,俗称定量透明厚涂片法,简称定透法。通常采用聚苯乙烯定量板(图17-5)进行计量。定量板的规格通常为40mm×30mm×1.37mm,在其一侧有两个小疙瘩,称为定边,具有定位作用;在其中央部位有一8mm×4mm的长椭圆形定量孔,粪样重量为41.7mg。
【操作方法】
取定量板置洁净载玻片上,刮取经100目/吋尼龙网或金属丝筛滤去粗渣的粪便标本,置入定量板孔内并填平,并刮去多余粪便。然后移去定量板,并在粪便标本上覆盖浸透甘油—孔雀绿溶液的亲水玻璃纸(大小为30mm×22mm),用另一张载玻片将粪便压平,使其均匀铺开;置20℃~25℃下1~2小时,粪膜透明后即可在低倍镜下计数厚片中的虫卵。
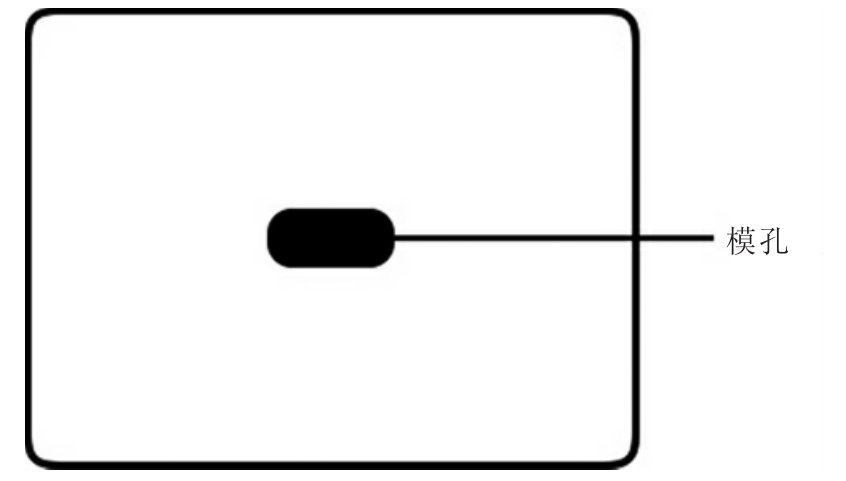
图17-5 改良加藤厚涂片法定量板
定量板孔中粪(41.7mg)内的虫卵数乘以系数(24),再乘以粪便性状系数,即为每克粪便虫卵数(egg per gram,EPG)。粪便性状系数:成形粪便为1,软粪便为2,粥样粪便为3,水样粪便为4(下同)。若保留病人24小时内全部粪量并记录重量,可推算出该病人1天内随粪便排出的虫卵总数,并推算出体内寄生的成虫数,计算公式如下:

在估算蠕虫成虫数时,雌、雄成虫总数为雌虫总数的2倍。本法适用于各种蠕虫卵的检查和定量计数,操作简便,虫卵散失少,结果较准确。定量板被清洗后,再在来苏儿液中消毒(切勿烫、煮),可反复使用。但对轻度感染者计数误差大。
【注意事项】
要掌握粪便厚度和透明时间,粪膜厚薄要均匀,若过厚、透明时间太短,则镜检时模糊、虫卵难以认定,计数很难准确。
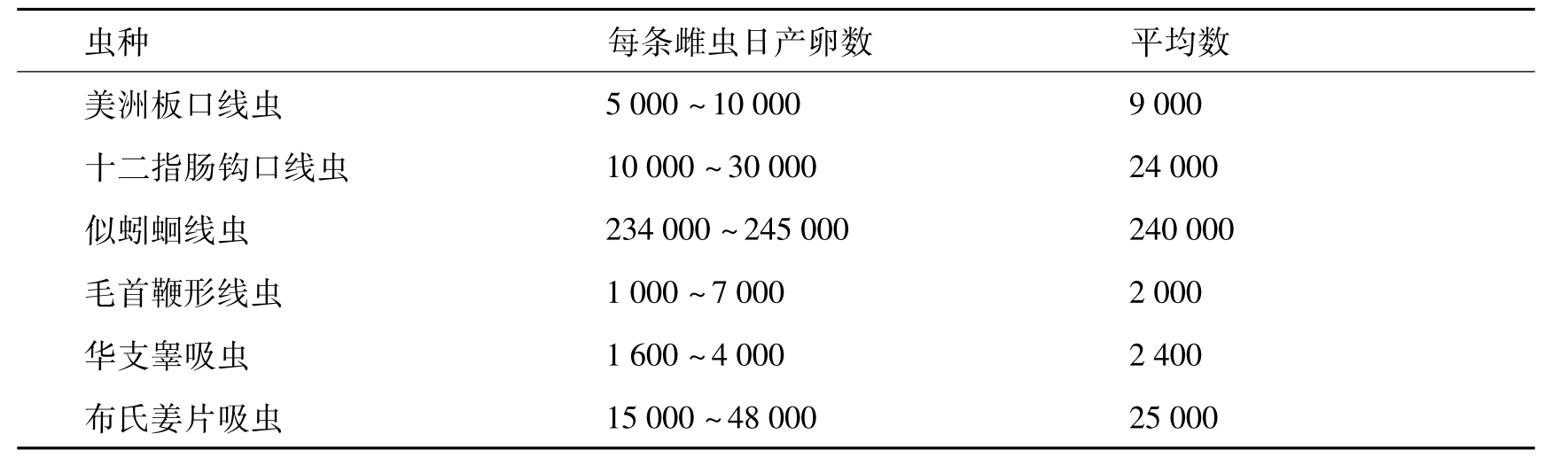
几种常见蠕虫每日产卵数见表17-2。
表17-2 常见蠕虫每日产卵数(单位:个)
2.洪(式闾)氏过滤改良计数法。
此法系根据虫卵在饱和盐水中浮聚浓集的原理设计的,故尤其适用于感染度较轻者;主要用于钩虫卵计数。浮聚盒为由厚约0.05cm的铜片制成的直径5.35cm、高2cm的无盖圆盒。
【操作方法】
称取1g粪便置小杯中,加少许饱和盐水,将粪便捣碎;再加饱和盐水,并充分混匀。然后将混匀的粪液经铜丝筛滤入浮聚盒内,继而用饱和盐水仔细冲洗筛内的粪便残渣,至液体充满浮聚盒为止。接着在液面上平放3张18mm×18mm的清洁盖玻片,使呈“品”字形,放时勿产生气泡。静置10分钟后,用镊子夹持盖玻片置载玻片上,计算3张盖玻片上的虫卵总数,除以3,求出1张盖玻片上的虫卵数;乘以7(浮聚盒表面积=7×18×18mm2),再乘以粪便性状系数,即为1g粪便的虫卵数(EPG)。
【注意事项】
本法为浓集虫卵计数法,故对重感染病例的粪便标本,因浮聚后的虫卵太密集而不易计数。
3.司徒尔(Stoll)虫卵计数法。
【操作方法】
将0.1mol/L氢氧化钠溶液加入司氏虫卵计数瓶(图17-6)内至56ml刻度处,再缓缓加入粪便,使液面上升至60ml刻度处,即加入粪便4ml(相当于4g)。然后放入10余颗玻璃珠,并用橡皮塞塞紧瓶口,充分摇动,使瓶内粪液成为均匀悬液。如粪便过硬,则应置4℃下过夜。计数前须将粪液充分混匀,用刻度吸管吸取0.15ml悬液置洁净的载玻片上,加盖玻片,在低倍镜下计数全片虫卵。应连续做两次,计算平均虫卵数,然后乘以100(若吸取0.075ml计数,则乘以200),再乘以粪便性状系数,即为每克粪便虫卵数(EPG)。
本法适用于粪便内各种蠕虫卵的计数,并可推算出感染度。EPG<2 000,为轻度感染;EPG若是2 000~11 000,则为中度感染;若EPG>11 000,便为高度感染。因该法属于稀释计数法,故该法尤适用于感染度较重者,而感染度过低时,则计数误差大。

图17-6 司徒尔虫卵计数法
【注意事项】
粪便中虫卵数受粪便性状影响,稀软便中水分多,虫卵含量比干便内的少,为统一标准,让结果具有可比性,所求得的虫卵数必须乘以粪便性状系数。
(四)幼虫孵化法(Larvae hachingmethod)
某些虫卵在适宜外界条件下可孵化出幼虫,用肉眼或放大镜观察即可识别。不仅便于确诊,提高检出率,还可用于某些虫种的进一步鉴定或作定量计数。
1.钩蚴培养法(Culturemethod for hookworm larvae)。
钩蚴培养法的具体方法较多,其中最为常用的方法为试管滤纸培养法(图17-7)。钩虫卵在适宜的温、湿度和氧气充足的条件下很快发育并孵出幼虫。此法检出率比粪便直接涂片法高7.2倍,亦高于饱和盐水浮聚法。但操作稍烦琐。本法主要用于鉴别虫种、研究药物对钩虫的驱虫效果、指导治疗以及钩虫感染的流行病学调查。
【操作方法】
取1cm×10cm的洁净试管,加入冷开水或去氯水(如将自来水放置一夜)1~2ml。将滤纸剪成1.4cm×6.0cm的“T”字形纸条并对折一下,在上端用铅笔写明受检者姓名、编号及检查日期。取混匀的粪便0.2~0.4g(约黄豆粒大小),涂于纸条中上部2/3处;将滤纸条插入试管中,下端浸入水内,但不能接触管底,也不使粪便浸入水中,然后置25℃~30℃温箱内培养,每天补充蒸发的水量。3天后,用放大镜检查管底水中有无作蛇形运动、虫体透明的钩蚴。如为阴性,可继续培养至第5天。
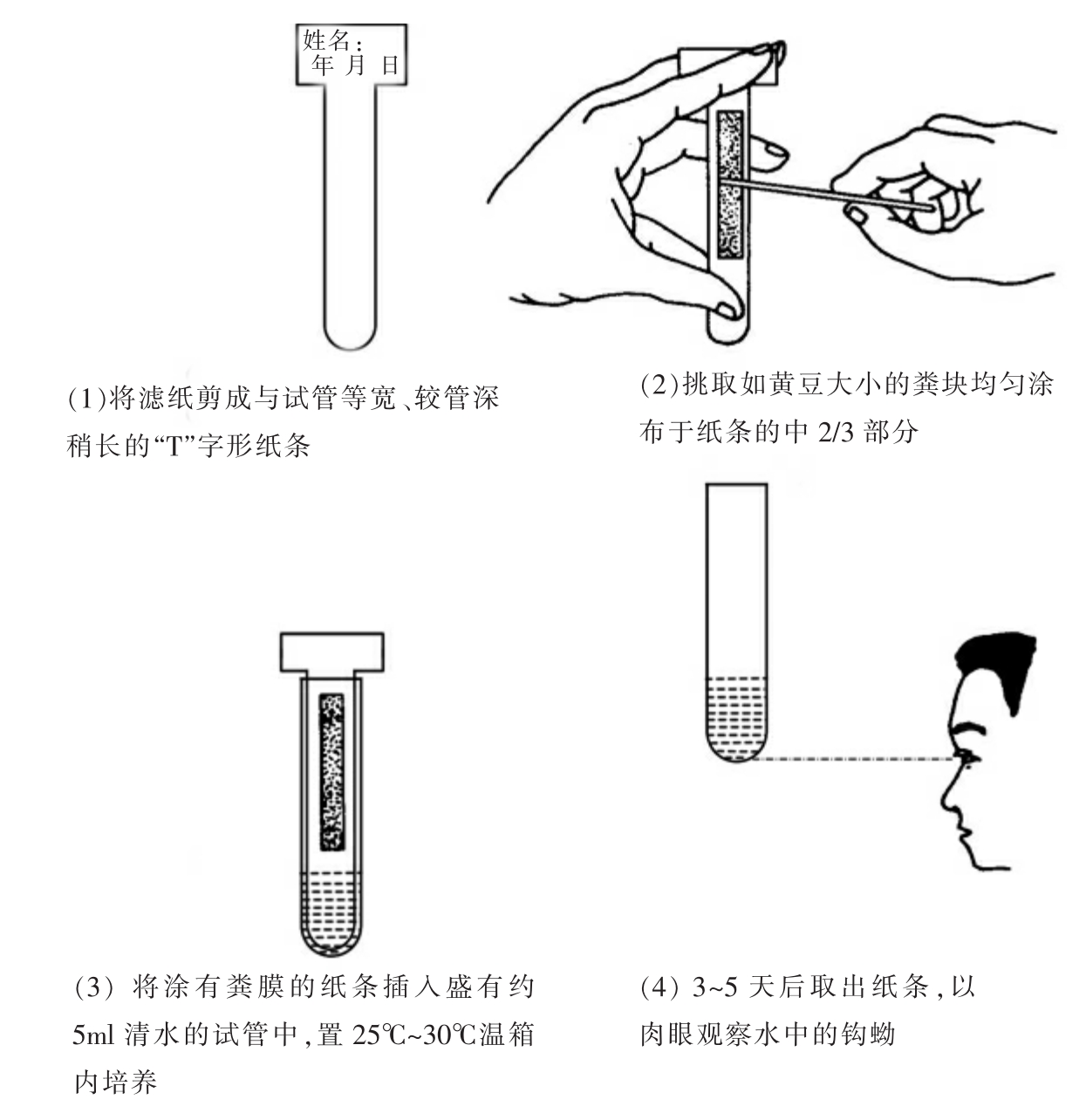
图17-7 钩蚴培养法
【注意事项】
检查时,应将滤纸条取出,摇动管内液体。鉴定虫种时,应在摇动后待片刻,再吸取管底沉淀物置载玻片上,在显微镜下观察。若用定量粪便作钩蚴培养法,可计数水中全部钩蚴数(或摇匀作定量计数),以便算出每克粪便虫卵数(EPG),从而了解钩虫感染度。
2.毛蚴孵化法(M iracidium hachingmethod)。
成熟日本血吸虫卵内的毛蚴在适宜温度(25℃~30℃)、pH(7.5~7.8)及光线下,可在清水中很快孵化出来,并在水面下作直线游动,用肉眼或放大镜观察即可看到,不仅方便,而且检出率也明显高于粪便检查血吸虫卵的其他各种方法。
【操作方法】
取粪便30g,采用自然沉淀法进行浓集处理,将沉渣倒入三角烧瓶(孵化瓶)内。然后加清水至瓶口下1cm处,置25℃~30℃室温或孵箱内孵化,经4~6小时毛蚴可孵出。观察时,应在瓶后衬以黑纸作背景,视线应在瓶口水平上,对着光用肉眼或放大镜观察(图17-2)。毛蚴如针尖大小,灰白色,半透明,有一定折光性,在水面下1~4cm处作直线运动,须注意与水中原生动物(大小不均、色彩不一、运动不呈直线等)进行区别。可疑时,应用细口吸管吸出,置镜下鉴定。用尼龙袋集卵法收集的沉渣,亦可按上述方法作毛蚴孵化。
此法用于诊断血吸虫病,查到毛蚴表明患者体内有活的血吸虫,是血吸虫病原检查中最常用的方法,检出率比自然沉淀法高。但操作较烦琐、费时,且需有观察和鉴别毛蚴的经验,对于粪便中虫卵较少的患者,有时需多次检查才能查见毛蚴。
【注意事项】
应注意血吸虫毛蚴与水中自由生活原生动物的鉴别。血吸虫毛蚴与水中原生动物鉴别见表17-3。
表17-3 血吸虫毛蚴与水中原生动物鉴别

(五)涂片染色法(Smear staining)
原虫的包囊和滋养体经染色后,其细微结构清晰易见;若经脱水、透明、封片,还可用油镜进一步观察。该法不仅是鉴定肠原虫的最佳选择,也是肠原虫检出率最高的方法之一。染色后的标本可长期保存,并可用于教学和科研。
1.福(Faust)氏铁苏木精快速染色法。
苏木精(苏木素)是从植物苏木中提取的天然染料,本身并无染色作用,然而经氧化后则变成弱酸性的苏木红染料。苏木红对组织亲和力很小,不能单独染色,而加入媒染剂(如铁明矾)则能产生染色作用,并形成黑色或蓝黑色的沉淀色素。其作用如同碱性染料,是细胞核的优良染剂,与组织结合后又可被铁明矾溶液脱色。所以,铁明矾在这里既是媒染剂,又是脱色剂。
【苏木精染色液的配制】
将苏木精粉10g溶于95%酒精100ml中,装入大口瓶内(勿超过瓶容量的2/3),用数层纱布覆盖瓶口,使瓶内溶液暴露于空气中或晒于阳光下,每日振摇,6~8周后即氧化成熟。成熟染液滴入水中呈紫色,密封的原液可保存数年。染色时,将原液1份,加蒸馏水19份,配制成0.5%(1∶20)的苏木精染色液。
【操作方法】
用竹签在粪便不同部位挑取少许标本,置于洁净的载玻片上涂成均匀的薄粪膜,并立即放入60℃的肖氏(Schaudinn)固定液(氧化汞饱和水溶液66ml,95%酒精33ml,冰乙酸5m l)中,固定2分钟。依次将标本放入70%碘酒精(70%酒精中加入碘酒,呈红葡萄酒色)、70%酒精、50%酒精各2分钟;再流水冲洗2分钟。置于40℃的2%铁明矾溶液中2分钟,流水冲洗2分钟。放入0.5%苏木精溶液中染色2分钟,流水冲洗2分钟。置于2%铁明矾溶液(不加温)中脱色3分钟。脱色时,应不时在显微镜下观察,直至细胞核结构清晰时为止,并以流水冲洗10~15分钟,待标本呈现蓝色后,依次将其放入70%、80%、90%、95%及100%酒精中各脱色2分钟。在二甲苯中透明3~5分钟,用中性树胶封片后平置烤箱或温箱(40℃左右)内烘干。染色后,原虫呈蓝灰色,核膜、染色质粒、核仁、拟染色体及溶组织内阿米巴大滋养体内所含红细胞呈蓝黑色,包囊内的糖原泡呈空泡状。
本法用于阿米巴及蓝氏贾第鞭毛虫包囊、滋养体的检查和鉴定。铁苏木素染色方法是检查肠道原虫的最佳方法,标本可保存数十年,已沿用了一个多世纪,改进的方法很多,此法仅为其中之一,比经典方法大大缩短了操作时间,但手续仍较烦琐,需时仍较长,且需一定的经验。
【注意事项】
掌握脱色程度是决定染色效果或成败的关键。脱色时,勿使标本干燥。
2.劳(Loos)氏快速染色法。
本法是一种将固定液和染料配制在一起的快速染色法,其效果与福氏铁苏木精快速染色法差不多。
【固定染色液的配制】
丙酮50ml,冰乙酸10ml,甲醛10ml,肖氏液890ml,上液混合完毕后,加入酸性品红1.25g,固绿0.5g,溶解后贮存于密封的棕色瓶内。可保存使用2个月以上。
【操作方法】
制作粪膜涂片(同上)。趁湿时立即滴加固定染色液至覆盖整个粪膜。将标本置酒精灯上缓慢地通过火焰2~3次,直至出现蒸气为止,以不烫手为度,切勿煮沸或烤焦。以流水冲洗,然后依次放入50%、70%、80%、95%、100%酒精中各0.5~1分钟;最后浸入二甲苯内1分钟,取出后用中性树胶封片。染色后,标本背景呈淡蓝紫色,而虫体则被染成不同程度的蓝色至紫色,其形态特征则与铁苏木素染色标本相似。除脆弱双核阿米巴的效果不佳外,其他阿米巴滋养体及包囊的鉴别均可使用本法。
染液具有固定及染色双重作用,配制后即可使用(无须成熟过程),且染色简便、迅速,一般仅需2.5分钟左右。对鉴别肠道原虫滋养体及包囊所需要的形态特征均可观察清楚。染色标本保存半年左右,仍可保持虫体的染色特征。
【注意事项】
对标本加热固定必须适度,脱水和透明均要充分。
(六)肛门拭子法(Anal swab method)
通常,雌蛲虫从肛门爬出并在肛门周围产卵;某些带绦虫(如牛带绦虫)孕节亦可从肛门逸出,并有虫卵污染肛门周围。所以,均可用肛门拭子法检出这些虫卵。
1.肛门周围虫卵检查。
肛门拭子法适用于检查蛲虫卵、带绦虫卵。用肛门拭子法检查肛门周围的虫卵,常用方法有透明胶纸法和棉拭子法。
(1)透明胶纸法(Cellophane tapemethod)。
【操作方法】
将宽2cm、长6cm的透明胶纸贴于载玻片(右端粘贴标签,供编号用)上备用,检查时将胶纸一端掀起3/4用胶面粘贴受检者肛门周围皮肤,可用手指或棉签按压无胶面,使胶面与皮肤充分粘贴,然后将胶纸贴回于载玻片上镜检。
【注意事项】
用低倍镜检查虫卵时,若气泡过多而有碍镜检时,可揭起胶带,加一两滴二甲苯,并贴回胶带,待其平展后再镜检。
(2)棉拭子法(Cotton swab method)。
【具体方法】
第一种方法:用生理盐水浸湿的棉拭子(压在管内壁上,挤去多余生理盐水),擦拭受检者肛周皮肤,然后将拭取物涂于载玻片上的生理盐水中,加盖玻片镜检。
第二种方法:将棉拭子放入盛有生理盐水的试管中荡洗,离心沉淀后取沉渣镜检。
第三种方法:将棉拭子在盛有饱和盐水的青霉素瓶中荡洗,然后加饱和盐水至满,覆以载玻片,待15分钟后翻转载玻片作镜检。
【注意事项】
检查时,要充分暴露受检者会阴部皮肤皱褶;检查蛲虫卵应在清晨解便前进行。检查者要严防自身感染,器材要充分消毒。
2.肛门部位蛲虫成虫检查。
【操作方法】
雌蛲虫成虫夜间爬出肛门产卵。因此,在夜间当小孩熟睡后,可将其侧卧,暴露肛门,仔细检查肛门部位。若发现5~13毫米长的白色小虫,即用镊子或棉签取虫,放入盛有70%酒精的小瓶内送检。若放入装有生理盐水的小瓶内,在36℃温箱内过夜,还可同时收集到蛲虫卵和蛲虫幼虫。
【注意事项】
因蛲虫的虫体(尤其是雄虫)较小,所以在肛门部位检查时应有充足的光线。
(七)粪便内蠕虫的检查和鉴定
在肠道寄生的蠕虫有时能自然排出;服药驱虫后虫体亦可随粪便排出。排出的虫体通过检查和鉴定,可作为诊断、治疗及疗效考核的依据。
1.虫体收集。
某些肠道蠕虫在未经治疗的情况下,也可随粪便排出,例如猪带绦虫和牛带绦虫的孕节,可经常随粪便排出。儿童腹泻时,还可排出蛲虫成虫。衰老的蛔虫也可随粪便自然排出。检查随粪便排出的虫体,可以确诊某些寄生虫病。肠道蠕虫病患者,可在服药后3天内收集全部粪便,进行检查。检查驱虫后粪便中的蠕虫成虫,可直接判断驱治肠道蠕虫的疗效和鉴定虫种。
(1)拣虫法(Method of choose words)。
【操作方法】
用镊子或竹签挑出粪便中的虫体。此法主要用于肉眼可见的大型蠕虫,如蛔虫、姜片虫成虫、带绦虫成虫或孕节等。
【注意事项】
动作要轻,检查要仔细。将挑出的虫体置大玻皿内,于清洗后移至白色搪瓷盘内的生理盐水中检查。对于细长虫体或绦虫,切勿使头颈断落。对于过硬的粪块,可先用生理盐水浸泡,化解后再行拣虫。
(2)淘虫法(Method of wash words)。
【操作方法】
将收集的粪便置搪瓷缸内加水搅拌成糊状,移至容量较大的玻璃缸或锥形量杯内,加水至满。静置20~30分钟后倾去上层粪水,再加水至满,如此反复3~4次,直至上层粪液澄清为止,弃上清液,将沉渣倒入大平皿内,并在底面衬以黑纸进行检查。本法主要用于收集小型蠕虫,如钩虫、蛲虫、鞭虫、短膜壳绦虫等。
【注意事项】
浸泡时间不宜过长,以防虫体胀裂。
(3)冲洗过筛法(Method ofwash and siftwords)。
【操作方法】
将调成糊状的粪便(在搪瓷缸内)倒入40~60目/吋铜丝筛内,用清水反复冲洗筛内粪渣,直至冲出清水为止。取筛内粪渣置大玻皿内,加少许生理盐水,下衬黑纸检查。本法适用于收集小型蠕虫,但也可用于收集带绦虫成虫或其孕节。
【注意事项】
水冲洗不能过猛,时间不宜过长,以免虫体受损。
2.虫体检查和鉴定。
(1)直接观察法(Method of direct observe words)。
【操作方法】
用肉眼、放大镜或在解剖镜(体视显微镜)下观察虫体大小、形状、颜色及活动等,以便鉴定。此法适用于各种蠕虫的检查。
【注意事项】
尽量先检查蠕虫的自然状态,然后作适当处理(如进行固定)后再进一步鉴定。
(2)压片法和注射法(Method of press smear and injecting)。
【操作方法】
本法适用于检查猪、牛带绦虫孕节。将检出的孕节用清水洗净后置两张载玻片之间,轻压后用尼龙线将玻片两端扎紧。然后,对光观察孕节子宫侧支数目,以确定虫种。在洗净玻片后,用结核菌素注射器抽取墨汁或卡红液,从孕节子宫主干后端徐徐注入,待侧支充满染液后,再以清水冲去多余染液,进一步作压片检查或鉴定。
【注意事项】
操作时应戴一次性塑料手套,以免虫卵污染。送检的节片若已干变,可用清水泡软后检查。使用过的器皿必须放入来苏儿溶液中浸泡30分钟后,再煮沸消毒;手套应予焚烧。










