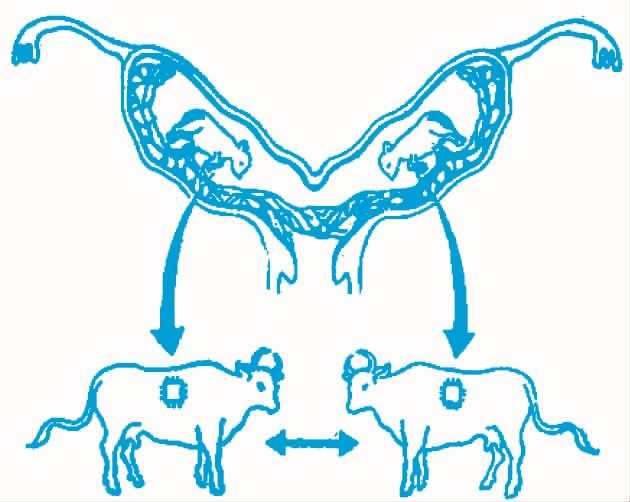
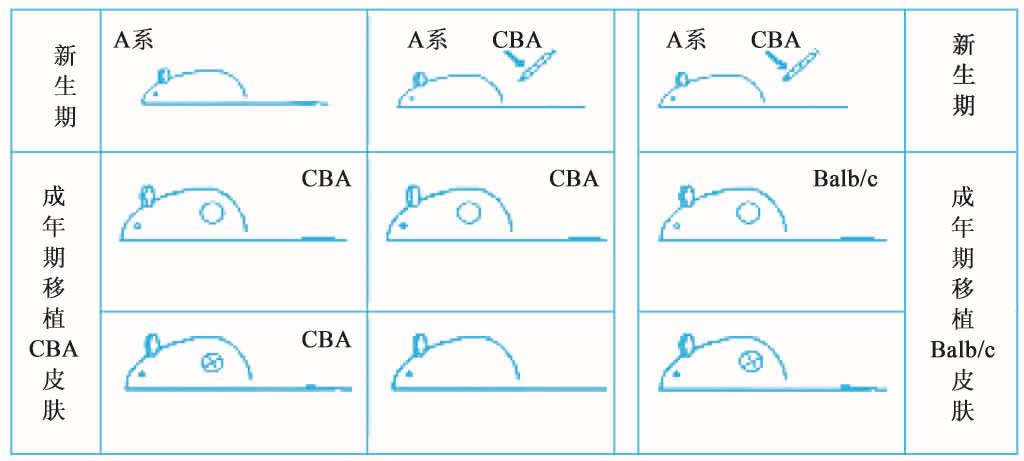
-
1.1序 言
-
1.2第一章 医学免疫学绪论(Introduction to Immunology)
-
1.2.1第一节 免疫学基本概念(Basic Concept of Immunology)
-
1.2.2第二节 免疫系统(Immune System)
-
1.2.3第三节 免疫学发展史概述(Brief History of Immunology)
-
1.2.4第四节 免疫学的主要进展(Important Progresses in Immunology)
-
1.3第二章 免疫器官(Lymphoid Organs)
-
1.3.1第一节 中枢免疫器官(Central Lymphoid Organ)
-
1.3.2第二节 外周免疫器官(Peripheral Lymphoid Organs)
-
1.3.3第三节 淋巴细胞循环(Lymphocyte Circulation)
-
1.4第三章 抗原(Antigen)
-
1.4.1第一节 抗原的概念(Concept of Antigen)
-
1.4.2第二节 决定抗原分子免疫原性的因素 (Factors Influencing Immunogenic...
-
1.4.3第三节 抗原的特异性(Specificity of Antigen)
-
1.4.4第四节 抗原的分类及其医学意义 (Classification and Medical Signif...
-
1.4.5第五节 非特异性免疫刺激剂(Non-specific Stimulators)
-
1.5第四章 免疫球蛋白(Immunoglobulin)
-
1.5.1第一节 免疫球蛋白的结构(Structure of Immunoglobulin)
-
1.5.2第二节 免疫球蛋白分子的抗原性
-
1.5.3第三节 抗体的生物学功能 (Biological Functions of Immunoglobul...
-
1.5.4第四节 五类免疫球蛋白的生物学特性 (Biological Properties of Five C...
-
1.5.5第五节 抗体技术(Antibody Technology)
-
1.6第五章 补体系统(Complement System)
-
1.6.1第一节 概述(Complement Overview)
-
1.6.2第二节 补体的激活途径(Complement Activation Pathways)
-
1.6.3第三节 补体活化的调控(Regulation of Complement System)
-
1.6.4第四节 补体受体(Complement Receptors)
-
1.6.5第五节 补体系统的功能及生物学意义 (Functions and Biological Signif...
-
1.6.6第六节 补体与疾病(Complement Related Diseases)
-
1.7第六章 细胞因子(Cytokines)
-
1.7.1第一节 细胞因子概述(General Characteristic of Cytokines)
-
1.7.2第二节 细胞因子的分类和功能 (Classification and Biological Acti...
-
1.7.3第三节 细胞因子受体(Cytokine Receptors)
-
1.7.4第四节 细胞因子与临床(Clinical Application of Cytokines)
-
1.8第七章 白细胞分化抗原和黏附分子(Leukocyte Differentiation Antigen...
-
1.8.1第一节 白细胞分化抗原(Leukocyte Differentiation Antigen)
-
1.8.2第二节 黏附分子(Adhesion Molecules)
-
1.9第八章 主要组织相容性抗原(Major Histocompatibility Antigen)
-
1.9.1第一节 MHC基因的结构(Structure of MHC Genes)
-
1.9.2第二节 MHC基因的遗传学特点(Genetic Features of MHC Genes)
-
1.9.3第三节 MHC分子的分布、结构与功能 (Cellular Distribution,Structur...
-
1.9.4第四节 HLA与医学实践(HLA and Clinical Medicine)
-
1.10第九章 淋巴细胞的发育(Development of Lymphocytes)
-
1.10.1第一节 造血干细胞的特性和分化 (Characteristics and Differentiati...
-
1.10.2第二节 T淋巴细胞的发育与成熟 (Development and Maturation of T L...
-
1.10.3第三节 B淋巴细胞的发育与成熟 (Development and Maturation of B L...
-
1.10.4第四节 自然杀伤细胞的发育(Maturation of Natural Killer Cell)
-
1.10.5第五节 调节性T细胞的发育(Development of Regulatory T Cell)
-
1.11第十章 抗原提呈细胞及抗原提呈 (Antigen Presenting Cells and Anti...
-
1.11.1第一节 抗原提呈细胞(Antigen Presenting Cells)
-
1.11.2第二节 抗原的处理和提呈 (Antigen Processing and Presentation)
-
1.12第十一章 T淋巴细胞与T细胞介导的细胞免疫应答(T Lymphocyte and Cellular ...
-
1.12.1第一节 T细胞表面标志(Surface Markers of T Cells)
-
1.12.2第二节 T细胞亚群及功能(Subsets and Functions of T Cells)
-
1.12.3第三节 T细胞对抗原的识别(T Cells Recognition of Antigen)
-
1.12.4第四节 T细胞的活化、增殖和分化 (T cells Activation,Proliferation...
-
1.12.5第五节 T细胞应答的效应及其机制 (Effects and Mechanisms of T Cell...
-
1.13第十二章 B淋巴细胞与B细胞介导的体液免疫应答(B Lymphocyte and Humoral I...
-
1.13.1第一节 B淋巴细胞表面标记分子和亚群(Surface Markers and Subset of B...
-
1.13.2第二节 B细胞对抗原的识别(B Cells Recognition of Antigen)
-
1.13.3第三节 B细胞活化、增殖和分化 (B Cells Activation,Proliferation ...
-
1.13.4第四节 抗体生成的理论(Rules of Antibody Production)
-
1.13.5第五节 B细胞介导的体液免疫应答效应 (Effects of B cells Mediated Hu...
-
1.13.6第六节 体液免疫应答规律(Rules of Antibody Responses)
-
1.14第十三章 固有免疫(Innate Immunity)
-
1.14.1第一节 固有免疫的组成 (Components Involved in Innate Immunit...
-
1.14.2第二节 固有免疫应答(Innate Immune Response)
-
1.14.3第三节 固有免疫的生物学意义 (Biological Significance of Innate ...
-
1.15第十四章 免疫调节与免疫耐受 (Immunoregulation and Immunotoleran...
-
1.15.1第一节 免疫调节(Immunoregulation)
-
1.15.2第二节 免疫耐受(Immune Tolerance)
-
1.16第十五章 超敏反应(Hypersensitivity)
-
1.16.1第一节 Ⅰ型超敏反应(Type I Hypersensitivity)
-
1.16.2第二节 Ⅱ型超敏反应(Type II Hypersensitivity)
-
1.16.3第三节 Ⅲ型超敏反应(Type III Hypersensitivity)
-
1.16.4第四节 Ⅳ型超敏反应(Type IV Hypersensitivity)
-
1.17第十六章 自身免疫和自身免疫性疾病(Autoimmunity and Autoimmune Dise...
-
1.17.1第一节 概述(Introduction)
-
1.17.2第二节 自身免疫性疾病的致病因素及机制 (Pathogenesis and Mechanisms o...
-
1.17.3第三节 自身免疫性疾病的组织损伤机制 (Mechanisms of Tissue Injury In...
-
1.17.4第四节 自身免疫性疾病治疗原则(Treatment of Autoimmune Diseases)
-
1.17.5第五节 常见的自身免疫性疾病(Typical of Autoimmune Diseases)
-
1.18第十七章 抗感染免疫(Immunity against Infection)
-
1.18.1第一节 抗细菌感染的免疫 (Immunity against Bacterial Infection...
-
1.18.2第二节 抗病毒感染的免疫(Immunity against Viral Infection)
-
1.18.3第三节 抗真菌感染的免疫(Immunity against Fungal Infection)
-
1.18.4第四节 抗寄生虫感染的免疫(Immunity against parasitic Infection...
-
1.18.5第五节 抗感染免疫中的病理损伤 (Immunopathology Resulting from Im...
-
1.19第十八章 免疫缺陷病(Immunodeficiency Disease)
-
1.19.1第一节 原发性免疫缺陷病(Primary Immunodeficiency Disease)
-
1.19.2第二节 继发性免疫缺陷病(Secondary Immunodeficiency Disease)
-
1.20第十九章 移植免疫(Transplantation Immunology)
-
1.20.1第一节 同种异型抗原的识别机制 (Recognition Mechanisms of Allogra...
-
1.20.2第二节 同种异型移植排斥反应的类型及其效应机制 (Allograft Rejection Types...
-
1.20.3第三节 同种异型移植排斥反应的防治原则(Prevention and Treatment of Al...
-
1.21第二十章 肿瘤免疫(Tumor Immunology)
-
1.21.1第一节 肿瘤抗原(Tumor Antigen)
-
1.21.2第二节 抗肿瘤的免疫效应机制(Mechanisms of Anti-tumor Effects)
-
1.21.3第三节 肿瘤逃避机体免疫监视的机制 (Mechanism of Tumor Escape)
-
1.21.4第四节 肿瘤的免疫诊断和治疗 (Tumor Immunodiagnosis and Immunoth...
-
1.22第二十一章 免疫学检测技术(Immunological Techniques)
-
1.22.1第一节 免疫学诊断(Immunodiagnosis)
-
1.22.2第二节 免疫学预防(Immunoprevention)
-
1.22.3第三节 免疫学治疗(Immunotherapy)
-
1.23附录Ⅰ 细胞因子
-
1.24附录Ⅱ 趋化因子及其受体
-
1.25附录Ⅲ 人CD分子的主要特征
-
1.26附录Ⅳ 英中文对照索引
1
医学免疫学