-
1.1全国高等医药院校药学类规划教材常务编委会
-
1.2出版说明
-
1.3第二版前言
-
1.4目录
-
1.5绪论
-
1.5.1一、药物化学的研究内容和任务
-
1.5.2二、药物化学的发展
-
1.5.3三、我国药物化学的发展
-
1.6第一部分 作用于神经系统的药物
-
1.6.1第一章 镇静、催眠药和抗癫痫药
-
1.6.1.1第一节 芾二氮䓬类镇静催眠药
-
1.6.1.1.1一、苯二氮䓬类药物的发展
-
1.6.1.1.2二、苯二氮䓬类药物的作用机制
-
1.6.1.1.3三、苯二氮䓬类药物的理化性质
-
1.6.1.1.4四、苯二氮䓬类药物的构效关系
-
1.6.1.1.5五、苯二氮䓬类药物的立体化学
-
1.6.1.1.6六、内源性的苯二氮䓬受体配体和苯二氮䓬受体拮抗剂
-
1.6.1.1.7七、苯二氮䓬类药物的体内代谢
-
1.6.1.2第二节 非苯二氮䓬类GABAA受体激动剂
-
1.6.1.2.1一、吡咯酮类
-
1.6.1.2.2二、咪唑并吡啶类
-
1.6.1.3第三节 抗癫痫药
-
1.6.1.3.1一、抗癫痫药物的发展
-
1.6.1.3.2二、抗癫痫药物的作用机制
-
1.6.1.3.3三、巴比妥类及同型药物
-
1.6.1.3.4四、二苯并氮杂䓬类
-
1.6.1.3.5五、GABA类似物
-
1.6.1.3.6六、脂肪羧酸类
-
1.6.1.3.7七、磺酰胺类
-
1.6.1.3.8八、其他结构类药物
-
1.6.2第二章 精神疾病治疗药
-
1.6.2.1第一节 经典抗精神病药
-
1.6.2.1.1一、吩噻嗪类
-
1.6.2.1.2二、硫杂蒽类
-
1.6.2.1.3三、丁酰苯类及其类似物
-
1.6.2.1.4四、苯酰胺类
-
1.6.2.1.5五、二苯二氮䓬类及其衍生物
-
1.6.2.2第二节 非经典抗精神病药物
-
1.6.2.3第三节 抗抑郁药
-
1.6.2.3.1一、单胺氧化酶抑制剂
-
1.6.2.3.2二、三环类抗抑郁药
-
1.6.2.3.3三、选择性5-羟色胺再摄取抑制剂
-
1.6.2.4第四节 抗躁狂药和抗焦虑药
-
1.6.2.4.1一、抗躁狂药
-
1.6.2.4.2二、抗焦虑药
-
1.6.3第三章 神经退行性疾病治疗药
-
1.6.3.1第一节 抗帕金森病药
-
1.6.3.1.1一、拟多巴胺类药
-
1.6.3.1.2二、外周脱羧酶抑制剂
-
1.6.3.1.3三、多巴胺释放剂
-
1.6.3.1.4四、多巴胺受体激动剂
-
1.6.3.1.5五、辅助治疗药
-
1.6.3.2第二节 抗老年痴呆症药
-
1.6.3.2.1一、胆碱能药物
-
1.6.3.2.2二、作用于β淀粉样多肽的AD治疗药
-
1.6.3.2.3三、作用于tau蛋白的AD治疗药
-
1.6.4第四章 阿片类镇痛药
-
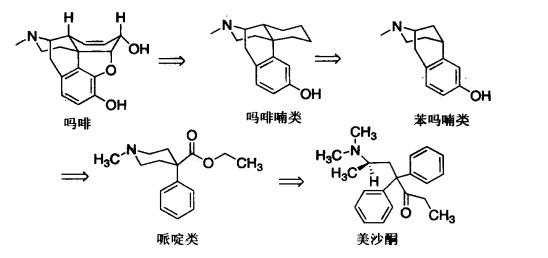
1.6.4.1第一节 吗啡及其半合成镇痛药
-
1.6.4.2第二节 合成镇痛药
-
1.6.4.2.1一、吗啡喃类
-
1.6.4.2.2二、苯吗喃类
-
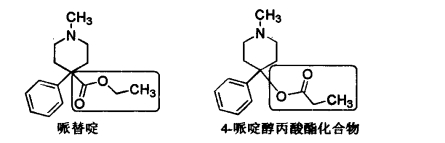
1.6.4.2.3三、哌啶类
-
1.6.4.2.4四、苯丙胺类
-
1.6.4.2.5五、其他合成镇痛药
-
1.6.4.3第三节 内源性阿片肽与阿片受体
-
1.6.4.3.1一、内源性阿片肽
-
1.6.4.3.2二、阿片受体
-
1.6.5第五章 局部麻醉药
-
1.6.5.1第一节 局部麻醉药的发展
-
1.6.5.2第二节 局部麻醉药的构效关系
-
1.6.5.3第三节 局部麻醉药的作用机制
-
1.7第二部分 影响神经递质的药物
-
1.7.1第六章 拟胆碱和抗胆碱药物
-
1.7.1.1第一节 拟胆碱药
-
1.7.1.1.1一、胆碱受体激动剂
-
1.7.1.1.2二、乙酰胆碱酯酶抑制剂
-
1.7.1.2第二节 抗胆碱药
-
1.7.1.2.1一、茄科生物碱类M受体拮抗剂
-
1.7.1.2.2二、合成M受体拮抗剂
-
1.7.1.2.3三、N胆碱受体拮抗剂
-
1.7.2第七章 作用于肾上腺素能受体的药物
-
1.7.2.1第一节 肾上腺素能神经递质的生物合成和体内代谢
-
1.7.2.1.1一、肾上腺素能神经递质的生物合成
-
1.7.2.1.2二、肾上腺素能神经递质的体内代谢
-
1.7.2.2第二节 拟肾上腺素能受体药
-
1.7.2.2.1一、α、β-受体激动剂
-
1.7.2.2.2二、α-受体激动剂
-
1.7.2.2.3三、β-受体激动剂
-
1.7.2.2.4四、构效关系
-
1.7.2.3第三节 抗肾上腺素药物
-
1.7.2.3.1一、α-受体拮抗剂
-
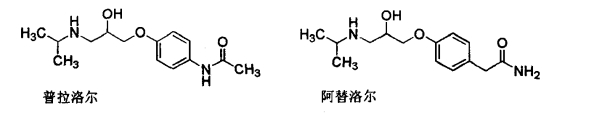
1.7.2.3.2二、β-受体拮抗剂
-
1.7.2.3.3三、β-受体拮抗剂的构效关系
-
1.8第三部分 影响心脑血管系统的药物
-
1.8.1第八章 高血压治疗药
-
1.8.1.1第一节 中枢性降压药
-
1.8.1.2第二节 作用于神经末梢的药物
-
1.8.1.3第三节 血管扩张药物
-
1.8.1.3.1一、钾通道调节剂
-
1.8.1.3.2二、NO供体药物
-
1.8.1.4第四节 影响肾素-血管紧张素-醛固酮系统的药物
-
1.8.1.4.1一、肾素-血管紧张素-醛固酮系统
-
1.8.1.4.2二、肾素抑制剂
-
1.8.1.4.3三、血管紧张素转化酶抑制剂
-
1.8.1.4.4四、血管紧张素Ⅱ受体拮抗剂
-
1.8.1.5第五节 钙通道阻滞剂
-
1.8.1.5.1一、选择性钙通道阻滞剂
-
1.8.1.5.2二、非选择性钙通道阻滞剂
-
1.8.1.6第六节 利尿药
-
1.8.1.6.1一、碳酸酐酶抑制剂
-
1.8.1.6.2二、Na+-K+-2Cl-协转运抑制剂
-
1.8.1.6.3三、Na+-Cl-协转运抑制剂
-
1.8.1.6.4四、肾小管上皮钠通道阻滞剂
-
1.8.1.6.5五、盐皮质激素受体拮抗剂
-
1.8.2第九章 心脏疾病药物和血脂调节药
-
1.8.2.1第一节 强心药物
-
1.8.2.1.1一、强心苷类
-
1.8.2.1.2二、磷酸二酯酶抑制剂
-
1.8.2.1.3三、钙敏化剂
-
1.8.2.2第二节 抗心律失常药物
-
1.8.2.2.1一、钠通道阻滞剂
-
1.8.2.2.2二、钾通道阻滞剂
-
1.8.2.3第三节 抗心绞痛药物
-
1.8.2.3.1一、硝酸酯类
-
1.8.2.3.2二、部分脂肪酸氧化抑制剂
-
1.8.2.4第四节 血脂调节药
-
1.8.2.4.1一、羟甲戊二酰辅酶A还原酶抑制剂
-
1.8.2.4.2二、苯氧乙酸类
-
1.8.2.4.3三、烟酸及其衍生物
-
1.8.2.4.4四、其他降血脂药物
-
1.9第四部分 影响消化系统的药物
-
1.9.1第十章 抗溃疡药
-
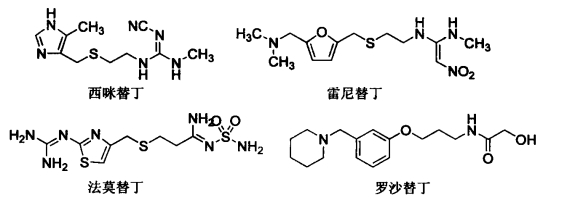
1.9.1.1第一节 H2受体拮抗剂
-
1.9.1.1.1一、咪唑类
-
1.9.1.1.2二、呋喃类
-
1.9.1.1.3三、噻唑类
-
1.9.1.1.4四、哌啶甲苯类
-
1.9.1.1.5五、H2受体拮抗剂的构效关系
-
1.9.1.2第二节 质子泵抑制剂
-
1.9.2第十一章 胃动力药和止吐药
-
1.9.2.1第一节 胃动力药
-
1.9.2.1.1一、多巴胺D2受体拮抗剂
-
1.9.2.1.2二、5-HT4受体激动剂
-
1.9.2.2第二节 止吐药
-
1.9.2.2.1一、作用机制和分类
-
1.9.2.2.2二、5-HT3受体拮抗剂
-
1.10第五部分 化学治疗药物
-
1.10.1第十二章 合成抗菌药
-
1.10.1.1第一节 喹诺酮类抗菌药
-
1.10.1.1.1一、喹诺酮类药物的发展
-
1.10.1.1.2二、喹诺酮类药物的作用机制
-
1.10.1.1.3三、喹诺酮类药物的化学结构与抗菌活性的关系
-
1.10.1.2第二节 磺胺类抗菌药及抗菌增效剂
-
1.10.1.2.1一、磺胺类药物的发展
-
1.10.1.2.2二、磺胺类药物的构效关系
-
1.10.1.2.3三、磺胺类药物的作用机制
-
1.10.1.2.4四、吸收和代谢
-
1.10.1.2.5五、磺胺类药物的理化性质
-
1.10.1.2.6六、抗菌增效剂
-
1.10.1.3第三节 抗真菌药
-
1.10.1.3.1一、抗生素类抗真菌药
-
1.10.1.3.2二、唑类抗真菌药
-
1.10.1.3.3三、其他抗真菌药
-
1.10.1.4第四节 抗结核病药
-
1.10.2第十三章 抗病毒药
-
1.10.2.1第一节 病毒及抗病毒药物的作用机制
-
1.10.2.1.1一、病毒的分类
-
1.10.2.1.2二、病毒生命周期
-
1.10.2.1.3三、抗病毒药物作用机制
-
1.10.2.2第二节 干扰病毒复制初期的药物
-
1.10.2.2.1一、干扰病毒吸附的药物
-
1.10.2.2.2二、干扰病毒穿入、脱壳的药物
-
1.10.2.2.3三、干扰素
-
1.10.2.3第三节 抑制病毒核酸复制的药物
-
1.10.2.3.1一、嘧啶核苷类
-
1.10.2.3.2二、嘌呤核苷类
-
1.10.2.3.3三、非核苷类
-
1.10.2.4第四节 基于其他机制的抗病毒药物
-
1.10.2.5第五节 抗人免疫缺陷病毒药物
-
1.10.2.5.1一、融合抑制剂
-
1.10.2.5.2二、逆转录酶抑制剂
-
1.10.2.5.3三、HIV蛋白酶抑制剂
-
1.10.2.5.4四、整合酶抑制剂
-
1.10.3第十四章 抗生素
-
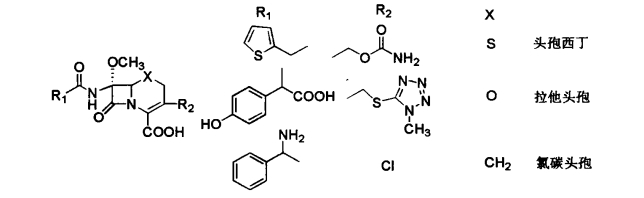
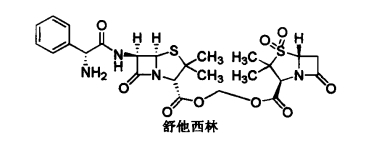
1.10.3.1第一节 β-内酰胺类抗生素
-
1.10.3.1.1一、青霉素类
-
1.10.3.1.2二、头孢菌素类
-
1.10.3.1.3三、非经典的β-内酰胺抗生素
-
1.10.3.2第二节 大环内酯类抗生素
-
1.10.3.2.1一、红霉素类大环内酯抗生素
-
1.10.3.2.2二、螺旋霉素及其衍生物
-
1.10.3.2.3三、麦迪霉素及其衍生物
-
1.10.3.3第三节 氨基糖苷类抗生素
-
1.10.3.3.1一、链霉素
-
1.10.3.3.2二、卡那霉素及其衍生物
-
1.10.3.3.3三、庆大霉素C及其衍生物
-
1.10.3.3.4四、新霉素类
-
1.10.3.4第四节 四环素类抗生素
-
1.10.3.5第五节 其他抗生素
-
1.10.3.5.1一、氯霉素及其衍生物
-
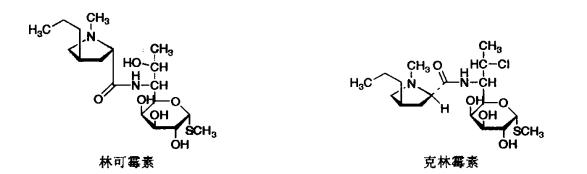
1.10.3.5.2二、林可霉素及其衍生物
-
1.10.4第十五章 抗肿瘤药
-
1.10.4.1第一节 直接作用于DNA的药物
-
1.10.4.1.1一、烷化剂
-
1.10.4.1.2二、金属铂配合物
-
1.10.4.1.3三、直接作用于DNA的天然产物
-
1.10.4.1.4四、DNA拓扑异构酶抑制剂
-
1.10.4.2第二节 抗代谢药物
-
1.10.4.2.1一、嘧啶拮抗物
-
1.10.4.2.2二、嘌呤拮抗物
-
1.10.4.2.3三、叶酸拮抗物
-
1.10.4.3第三节 抗有丝分裂的药物
-
1.10.4.3.1一、在微管蛋白上有一个结合位点的药物
-
1.10.4.3.2二、在微管蛋白上有两个结合点的药物
-
1.10.4.3.3三、微管稳定剂及微管组装促进剂
-
1.10.4.4第四节 基于肿瘤信号转导机制的药物
-
1.10.4.4.1一、蛋白激酶抑制剂
-
1.10.4.4.2二、蛋白酶体抑制剂
-
1.10.5第十六章 抗寄生虫药
-
1.10.5.1第一节 抗疟药物
-
1.10.5.1.1一、疟原虫的生命周期和抗疟药物的作用环节
-
1.10.5.1.2二、疟疾的预防和治疗药物
-
1.10.5.2第二节 驱肠虫药物
-
1.10.5.2.1一、哌嗪类
-
1.10.5.2.2二、咪唑类
-
1.10.5.2.3三、其他类驱肠虫药
-
1.10.5.3第三节 抗血吸虫药物
-
1.11第六部分 影响激素调控系统的药物
-
1.11.1第十七章 甾体激素药物
-
1.11.1.1第一节 概述
-
1.11.1.1.1一、甾体激素的作用机制
-
1.11.1.1.2二、甾体化合物的化学结构与命名
-
1.11.1.1.3三、甾体激素半合成原料及中间体
-
1.11.1.1.4四、甾体激素的体内生物合成途径
-
1.11.1.2第二节 雄激素、蛋白同化激素及雄激素拮抗剂
-
1.11.1.2.1一、概述
-
1.11.1.2.2二、人工合成的雄激素和蛋白同化激素
-
1.11.1.2.3三、构效关系
-
1.11.1.2.4四、不良反应及禁忌证
-
1.11.1.2.5五、雄激素拮抗剂
-
1.11.1.3第三节 雌激素和雌激素拮抗剂
-
1.11.1.3.1一、概述
-
1.11.1.3.2二、甾体雌激素
-
1.11.1.3.3三、甾体雌激素的代替品——非甾体雌激素
-
1.11.1.3.4四、构效关系
-
1.11.1.3.5五、不良反应及禁忌证
-
1.11.1.3.6六、雌激素拮抗剂
-
1.11.1.4第四节 孕激素和孕激素拮抗剂
-
1.11.1.4.1一、概述
-
1.11.1.4.2二、人工合成的孕激素
-
1.11.1.4.3三、构效关系
-
1.11.1.4.4四、孕激素拮抗剂
-
1.11.1.4.5五、不良反应及禁忌证
-
1.11.1.4.6六、甾体避孕药
-
1.11.1.5第五节 肾上腺皮质激素
-
1.11.1.5.1一、概述
-
1.11.1.5.2二、合成糖皮质激素
-
1.11.1.5.3三、一些常用的糖皮质激素类的药物
-
1.11.1.5.4四、不良反应及禁忌证
-
1.11.1.5.5五、肾上腺皮质激素拮抗剂
-
1.11.2第十八章 降血糖药物和骨质疏松治疗药
-
1.11.2.1第一节 降血糖药物
-
1.11.2.1.1一、胰岛素
-
1.11.2.1.2二、口服降血糖药
-
1.11.2.2第二节 骨质疏松治疗药物
-
1.11.2.2.1一、骨吸收抑制剂
-
1.11.2.2.2二、骨形成促进剂
-
1.12第七部分 影响免疫系统的药物
-
1.12.1第十九章 非甾体消炎药
-
1.12.1.1第一节 解热镇痛药
-
1.12.1.1.1一、水杨酸类药物
-
1.12.1.1.2二、苯胺类药物
-
1.12.1.1.3三、吡唑酮类
-
1.12.1.2第二节 非甾体抗炎药
-
1.12.1.2.1一、3,5-吡唑烷二酮类
-
1.12.1.2.2二、邻氨基苯甲酸类
-
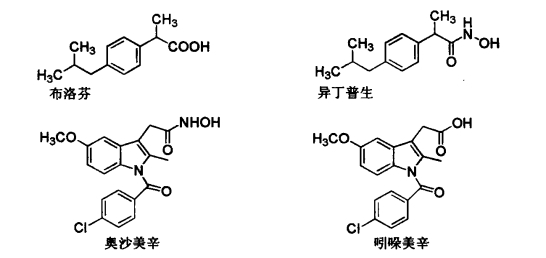
1.12.1.2.3三、吲哚乙酸类
-
1.12.1.2.4四、芳基烷酸类
-
1.12.1.2.5五、1,2-苯并噻嗪类
-
1.12.1.2.6六、选择性COX-2抑制剂
-
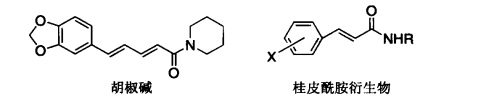
1.12.1.2.7七、非甾体抗炎药作用机制
-
1.12.2第二十章 抗变态反应药物
-
1.12.2.1第一节 组胺H1受体拮抗剂
-
1.12.2.1.1一、组胺H1受体拮抗剂的发展
-
1.12.2.1.2二、组胺H1受体拮抗剂
-
1.12.2.2第二节 过敏介质与抗过敏药
-
1.12.2.2.1一、过敏介质释放抑制剂
-
1.12.2.2.2二、过敏介质拮抗剂
-
1.13第八部分 维生素
-
1.13.1第二十一章 维生素
-
1.13.1.1第一节 脂溶性维生素
-
1.13.1.1.1一、维生素A类
-
1.13.1.1.2二、维生素D类
-
1.13.1.1.3三、维生素E类
-
1.13.1.1.4四、维生素K类
-
1.13.1.2第二节 水溶性维生素
-
1.13.1.2.1一、维生素B类
-
1.13.1.2.2二、维生素C类
-
1.13.1.2.3三、叶酸类
-
1.13.1.2.4四、其他水溶性维生素
-
1.14第九部分 药物研究与开发的基本原理和方法
-
1.14.1第二十二章 药物的化学结构与生物活性
-
1.14.1.1第一节 影响药物活性的主要因素
-
1.14.1.2第二节 药物理化性质对活性的影响
-
1.14.1.2.1一、药物的溶解度和分配系数对药效的影响
-
1.14.1.2.2二、药物的酸碱性和解离度对药效的影响
-
1.14.1.3第三节 药物与受体的相互作用对药效的影响
-
1.14.1.3.1一、药物与受体的相互键合作用对药效的影响
-
1.14.1.3.2二、药物结构中的各官能团对药效的影响
-
1.14.1.3.3三、药物分子的电荷分布对药效的影响
-
1.14.1.3.4四、药物的立体结构对药效的影响
-
1.14.2第二十三章 药物的化学结构与药物代谢
-
1.14.2.1第一节 药物的官能团化反应
-
1.14.2.1.1一、氧化反应
-
1.14.2.1.2二、还原反应
-
1.14.2.1.3三、水解反应
-
1.14.2.2第二节 药物的结合反应
-
1.14.2.2.1一、与葡萄糖醛酸的结合反应
-
1.14.2.2.2二、与硫酸的结合反应
-
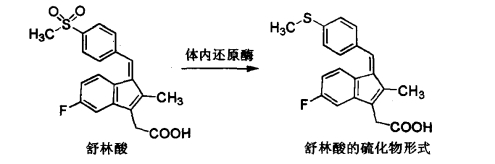
1.14.2.2.3三、与氨基酸的结合反应
-
1.14.2.2.4四、与谷胱甘肽的结合反应
-
1.14.2.2.5五、乙酰化结合反应
-
1.14.2.2.6六、甲基化结合反应
-
1.14.2.3第三节 药物代谢与药物研发
-
1.14.2.3.1一、药物代谢的影响因素
-
1.14.2.3.2二、药物的生物转化对临床合理用药的指导
-
1.14.2.3.3三、药物的生物转化在药物研发中的应用
-
1.14.3第二十四章 药物的化学结构修饰与新药研究开发
-
1.14.3.1第一节 药物的化学结构修饰对药效的影响
-
1.14.3.1.1一、改善药物的吸收性能
-
1.14.3.1.2二、延长药物的作用时间
-
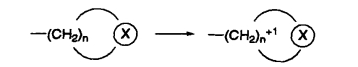
1.14.3.1.3三、增加药物对特定部位作用的选择性
-
1.14.3.1.4四、降低药物的毒副作用
-
1.14.3.1.5五、提高药物的稳定性
-
1.14.3.1.6六、改善药物的溶解性能
-
1.14.3.1.7七、消除不适宜的异味
-
1.14.3.2第二节 药物化学结构修饰的常用方法
-
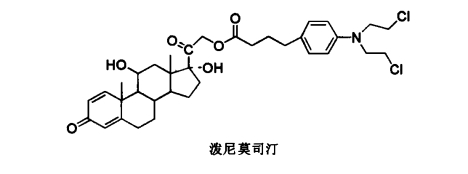
1.14.3.2.1一、酯化和酰胺化修饰
-
1.14.3.2.2二、成盐修饰
-
1.14.3.2.3三、成环和开环修饰
-
1.14.3.3第三节 药物设计与新药开发
-
1.14.3.3.1一、先导化合物发现的方法和途径
-
1.14.3.3.2二、先导化合物的优化
-
1.14.3.3.3三、计算机辅助药物设计
-
1.14.3.3.4四、新药研究与开发
1
药物化学