(三)酶促反应动力学

1.底物浓度对反应速度的影响 在其他因素不变的情况下,底物浓度与反应速度作图呈矩形双曲线。
[S]较低时,v∝[S]——一级反应;[S]增高时,v也增大;[S]增加,v不变时——零级反应
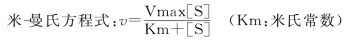
前提:①测定的反应速度为初速度,即反应开始,产物的生成量极少,逆反应可不考虑;
②过大于[E],[S]的变化在测定初速度的过程中可急略不计。
Km与Vm的意义:
Km值为酶促反应速度为最大速度一半时的底物浓度。
Km值可用来表示酶对底物的亲和力,Km值愈小,酶与底物的亲和力愈大。
Km值是酶的特征性常数之一,与酶的结构有关,与酶的浓度无关。
Km值与酶所催化的底物和反应环境(如温度、pH值、离子强度)有关。
Vm是酶完全被底物饱和时的反应速度,与酶浓度成正比。
Km值和Vm值的测定:双倒数作图法(林-贝氏作图法):以1/V对1/[S]作图,纵轴上的截距为1/Vm,横轴上的截距为-1/Km
Hanes作图法:以[S]/v对[S]作图,横轴上的截距为-Km,直线的斜率为1/Vm。
2.酶浓度对反应速度的影响 [S]>[E]时,v正比于[E]。
3.温度对反应速度的影响
升高温度可加快反应速度,也可增加酶的变性;温度降低,酶的活性下降,但不变性。
最适温度:酶促反应速度最快时的环境温度,它不是酶的特征常数,与反应进行的时间有关。
4.pH值对反应速度的影响
影响酶活性中心的基团解离及底物的解离状态,影响底物与酶的亲和力。
最适pH值:酶促反应速度最快时的环境pH值,它不是酶的特征常数,受底物浓度、缓冲液的种类与浓度、酶的纯度等因素的影响。
5.激活剂对反应速度的影响 酶的激活剂:使酶由无活性变为有活性或使酶活性增加的物质,如K+、Mg2+、Zn2+。
必需激活剂:缺之,酶则无活性。如Mg2+是己糖激酶的必需激活剂。
非必需激活剂:不存在时,酶仍有活性。如Cl-是唾液淀粉酶的非必需激活剂。
6.抑制剂对反应速度的影响 酶的抑制剂:凡能使酶的催化活性下降而不引起酶蛋白变性的物质。可分2类:
不可逆性抑制作用。抑制剂以共价键与酶的活性中心上必需基团相结合,使酶失活,且不能用透析、超滤等物理方法去除。
有机磷与羟基酶结合(如敌敌畏、1059等农药),解磷定(PAM)解毒。
重金属离子(Hg2+、Ag+)及砷类化合物与巯基酶结合,如路易士气。二巯基丙醇(BAL)解毒。
可逆性抑制作用。抑制剂以非共价键与酶和(或)酶-底物复合物可逆性结合,使酶活性降低或消失,用透析、超滤等物理方法可将抑制剂去除。
竞争性抑制作用:抑制剂与底物结构相似,与底物竞争酶的活性中心;抑制强度与[I]/[S]有关;Vm不变,表观Km值增大。
磺胺类药物与对氨基苯甲酸相似,竞争性抑制二氢叶酸合成酶,影响细菌的生长繁殖。
非竞争性抑制作用:抑制剂与酶的活性中心外的必需基团结合,不影响酶与底物的结合,酶和底物的结合也不影响酶与抑制剂的结合。抑制强弱只与抑制剂浓度有关,与底物浓度无关;Vm降低,表观Km值不变。
反竞争性抑制作用:仅与酶和底物形成的中间产物(ES)结合,使中间产物的量下降;Vm降低,表观Km值减少。
