-
1.1内容提要
-
1.2前言
-
1.3第一章 导论:化学与生命
-
1.3.11-1 引言
-
1.3.21-2 化学与生命
-
1.4第二章 宇宙和化学元素的起源
-
1.4.12-1 宇宙如何创生——传说和思考
-
1.4.22-2 宇宙是在膨胀中
-
1.4.2.12-2-1 问题之一:夜里的天空为什么是黑的?
-
1.4.2.22-2-2 问题之二:天体的光谱为什么会有红移?
-
1.4.32-3 宇宙大爆炸理论
-
1.4.3.12-3-1 宇宙大爆炸理论的提出
-
1.4.3.22-3-2 宇宙大爆炸的八个阶段
-
1.4.3.32-3-3 宇宙从何而来?
-
1.4.3.42-3-4 宇宙又往何处去?
-
1.4.42-4 化学元素诞生的理论
-
1.4.4.12-4-1 化学元素的最初核合成——大爆炸中的核合成
-
1.4.4.22-4-2 化学元素的恒星核合成
-
1.4.4.32-4-3 化学元素的超新星核合成
-
1.4.4.42-4-4 地球的形成
-
1.4.52-5 “化学元素王国”的边界
-
1.5第三章 生命和生命元素的演变
-
1.5.13-1 生命起源的研究
-
1.5.1.13-1-1 生命是谁创造的?
-
1.5.1.23-1-2 生命起源的学说之一(化学进化说)
-
1.5.1.33-1-3 生命起源的学说之二(早期宇宙胚种说)
-
1.5.1.43-1-4 生命起源的学说之三(新宇宙胚种说)
-
1.5.1.53-1-5 生命起源的学说之四(新地球生成论)
-
1.5.1.63-1-6 生命进化的历程
-
1.5.23-2 生命元素的形成
-
1.5.2.13-2-1 生命起源时对化学元素最初的自然选择
-
1.5.2.23-2-2 生命体演化过程中有选择地吸收化学元素的规律
-
1.5.2.33-2-3 生命元素的组成
-
1.5.33-3 生命体中化学元素的来源
-
1.5.3.13-3-1 地球是生命体元素的源泉
-
1.5.3.23-3-2 生命体中元素的主要来源之一:天然淡水
-
1.5.3.33-3-3 生命体中元素的主要来源之二:海洋
-
1.5.3.43-3-4 生命体中元素的主要来源之三:土壤岩石
-
1.5.3.53-3-5 生命体中元素的主要来源之四:大气
-
1.5.43-4 生命元素的主要形态和主要特性
-
1.5.4.13-4-1 生命体中的主要生命物质
-
1.5.4.23-4-2 生命元素的主要存在形态
-
1.5.4.33-4-3 生命元素的主要特征
-
1.5.4.43-4-4 生命元素与地球生物化学循环密切相关
-
1.5.53-5 影响生命元素演变的环境因素
-
1.5.5.13-5-1 生命外部环境的差异和变化所造成的影响
-
1.5.5.23-5-2 地球环境被破坏对人类带来的影响
-
1.6第四章 生命中的主量元素(一)
-
1.6.14-1 碳是生命的物质基础
-
1.6.1.14-1-1 生命为什么选择碳?
-
1.6.1.24-1-2 生命中的碳元素主要起什么作用
-
1.6.24-2 糖类化合物
-
1.6.2.14-2-1 光合作用
-
1.6.2.24-2-2 单糖
-
1.6.2.34-2-3 二糖
-
1.6.2.44-2-4 多糖
-
1.6.2.54-2-5 黏多糖
-
1.6.2.64-2-6 复合多糖
-
1.6.2.74-2-7 红血球的糖蛋白与血型
-
1.6.2.84-2-8 维生素C
-
1.6.34-3 糖类化合物的重要生理功能
-
1.6.3.14-3-1 糖类化合物的主要生理功能
-
1.6.3.24-3-2 糖类化合物的生物信息识别功能
-
1.6.44-4 脂类化合物
-
1.6.4.14-4-1 中性脂肪、脂肪酸及蜡
-
1.6.4.24-4-2 磷脂和糖脂
-
1.6.4.34-4-3 甾类化合物
-
1.6.4.44-4-4 脂溶性维生素
-
1.6.4.54-4-5 植物甾醇的研究
-
1.6.4.64-4-6 脂类化合物的主要生理功能
-
1.6.54-5 碳在生命体中的代谢和平衡
-
1.6.5.14-5-1 碳营养源
-
1.6.5.24-5-2 碳在生物体内的循环
-
1.6.5.34-5-3 糖类代谢的疾病——糖尿病
-
1.6.5.44-5-4 脂类代谢的疾病——心血管疾病
-
1.6.5.54-5-5 用“碳”来毁灭生命?
-
1.7第五章 生命中的主量元素(二)
-
1.7.15-1 生命与氮
-
1.7.25-2 氨基酸
-
1.7.2.15-2-1 蛋白质氨基酸的结构和分类
-
1.7.2.25-2-2 非蛋白质氨基酸
-
1.7.35-3 肽
-
1.7.3.15-3-1 多肽
-
1.7.3.25-3-2 一些具有重要功能的多肽
-
1.7.45-4 蛋白质
-
1.7.4.15-4-1 蛋白质的结构
-
1.7.4.25-4-2 蛋白质的生理功能
-
1.7.55-5 酶、维生素、激素
-
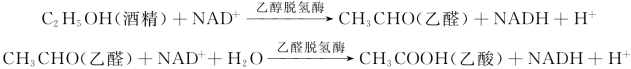
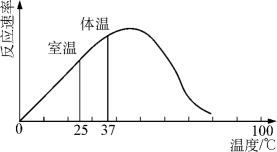
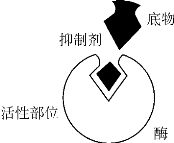
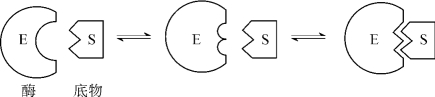
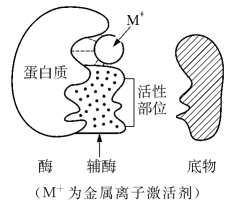
1.7.5.15-5-1 酶
-
1.7.5.25-5-2 维生素(B族)
-
1.7.5.35-5-3 激素
-
1.7.65-6 核酸和基因
-
1.7.6.15-6-1 核酸
-
1.7.6.25-6-2 基因的研究
-
1.7.75-6-3 生命的遗传
-
1.7.85-7 生命体中其他重要的含氮小分子化合物
-
1.7.8.15-7-1 神经递质
-
1.7.8.25-7-2 生物碱
-
1.7.8.35-7-3 植物中的硝酸盐氮
-
1.7.8.45-7-4 人体内的一氧化氮
-
1.7.95-8 氮元素在人体中的代谢与平衡
-
1.8第六章 生命中的主量元素(三)
-
1.8.16-1 氧和生命
-
1.8.1.16-1-1 氧生于水——光合作用
-
1.8.1.26-1-2 氧与呼吸
-
1.8.1.36-1-3 生命体中氧的吸入和运输
-
1.8.26-2 氧的“功”与“过”
-
1.8.2.16-2-1 氧的“功绩”
-
1.8.2.26-2-2 氧又是一种潜在的“毒物”
-
1.8.2.36-2-3 生命中的过量氧是有害的
-
1.8.2.46-2-4 氧自由基真是衰老的罪魁祸首吗?
-
1.8.2.56-2-5 生命体中的抗氧化合物
-
1.8.2.66-2-6 重要的是缺氧同样有害
-
1.8.36-3 生命中的氢元素
-
1.8.3.16-3-1 氢离子和酸碱平衡
-
1.8.3.26-3-2 氢离子和体液
-
1.8.3.36-3-3 人体对氢离子的调节
-
1.8.3.46-3-4 氢离子和人的味觉
-
1.8.3.56-3-5 人体里的氢与医疗诊断
-
1.8.3.66-3-6 氢的氧化是生物氧化过程的本质
-
1.8.46-4 水和生命
-
1.8.4.16-4-1 水的化学特性
-
1.8.4.26-4-2 人体中的水
-
1.8.4.36-4-3 水的生理功能
-
1.8.56-5 钙和磷
-
1.8.5.16-5-1 骨骼、牙齿及血浆
-
1.8.5.26-5-2 钙离子的主要生理作用
-
1.8.5.36-5-3 成骨与破骨
-
1.8.5.46-5-4 钙的营养吸收
-
1.8.5.56-5-5 磷化物——人体能量的仓库
-
1.8.5.66-5-6 磷的生理作用和营养吸收
-
1.8.66-6 钠和钾
-
1.8.6.16-6-1 人体中的钠和钾
-
1.8.6.26-6-2 钠和钾的生理作用
-
1.8.6.36-6-3 离子通道和Na<span title="pagenumber_ebook=292,pag...
-
1.8.6.46-6-4 人体对钠和钾的吸收
-
1.8.6.56-6-5 钠和钾对植物生长的作用
-
1.8.76-7 氯和硫
-
1.8.7.16-7-1 氯
-
1.8.7.26-7-2 硫
-
1.8.86-8 镁
-
1.8.8.16-8-1 镁与叶绿素
-
1.8.8.26-8-2 镁和人体
-
1.9第七章 微量元素和人体健康
-
1.9.17-1 人体中必需(及可能必需)的微量元素
-
1.9.1.17-1-1 碘
-
1.9.1.27-1-2 锌
-
1.9.1.37-1-3 硒
-
1.9.1.47-1-4 铁
-
1.9.1.57-1-5 铜、钼、钴、铬
-
1.9.1.67-1-6 锰、硅、镍、硼、钒
-
1.9.27-2 低剂量可能具有人体所必需功能但具有潜在毒性的微量元素
-
1.9.2.17-2-1 氟
-
1.9.2.27-2-2 锡、锂、铝
-
1.9.37-3 可能具有人体所必需的功能但具有较大毒性的元素
-
1.9.3.17-3-1 铅
-
1.9.3.27-3-2 汞
-
1.9.3.37-3-3 镉
-
1.9.3.47-3-4 砷
-
1.9.47-4 对微量元素的研究
-
1.9.4.17-4-1 微量元素缺乏与过量时对生命的影响
-
1.9.4.27-4-2 微量元素之间的相互作用
-
1.9.4.37-4-3 人体中微量元素分布、代谢及平衡的研究
-
1.9.4.47-4-4 人体内微量元素存在现状的忧虑
-
1.10第八章 人类与地球共命运
-
1.10.18-1 人类与环境
-
1.10.28-2 人类对生命元素循环的严重破坏造成了地球环境的严重污染
-
1.10.2.18-2-1 生物地球化学循环
-
1.10.2.28-2-2 地球上的碳循环和人类对其的严重干扰
-
1.10.2.38-2-3 污染气体氮氧化物、二氧化硫的释放引起了全球性的严重大气污染
-
1.10.2.48-2-4 含磷、氮的废水造成了地表水的富营养化,工业污染使水循环遭受严重破坏
-
1.10.38-3 世界范围内的环境污染严重威胁着人类的生存
-
1.10.48-4 我们应与地球共命运——建立绿色的家园
-
1.11主要参考书目
1
生命中的化学元素