-
1.1内容提要
-
1.2前言
-
1.3目录
-
1.4第一章 艾滋病及其相关疾病
-
1.4.1第一节 机会性感染
-
1.4.1.1一、肺孢子菌肺炎(PCP)
-
1.4.1.2二、结核病
-
1.4.1.3三、非结核分枝杆菌感染
-
1.4.1.4四、巨细胞病毒感染
-
1.4.1.5五、弓形体脑病
-
1.4.1.6六、真菌感染
-
1.4.1.6.1假丝酵母菌感染
-
1.4.1.6.2新型隐球菌感染
-
1.4.1.6.3马尔尼菲篮状菌感染
-
1.4.2第二节 艾滋病相关肿瘤
-
1.4.2.1一、卡波西肉瘤
-
1.4.2.2二、非霍奇金淋巴瘤
-
1.4.3第三节 艾滋病相关慢性疾病
-
1.4.3.1一、艾滋病合并冠心病
-
1.4.3.2二、艾滋病合并脑血管疾病
-
1.4.3.3三、艾滋病合并高血压
-
1.4.3.4四、艾滋病合并内分泌及代谢性疾病
-
1.4.3.5五、艾滋病合并骨病
-
1.5第二章 艾滋病及相关疾病的治疗药物
-
1.5.1第一节 抗逆转录病毒药物
-
1.5.1.1一、核苷逆转录酶抑制剂(NRTIs)
-
1.5.1.1.1齐多夫定(Zidovudine,ZDV)
-
1.5.1.1.2拉米夫定(Lamivudine,3TC)
-
1.5.1.1.3阿巴卡韦(Abacavir,ABC)
-
1.5.1.1.4富马酸替诺福韦二吡呋酯(Tenofovir Disoproxil Fumarate,TDF)
-
1.5.1.1.5丙酚替诺福韦(Tenofovir alafenamide,TAF)
-
1.5.1.1.6恩曲他滨(Emtricitabine,FTC)
-
1.5.1.1.7齐多夫定/拉米夫定(Combivir,AZT+3TC,齐多拉米双夫定、双汰芝、贝拉齐、可比韦)
-
1.5.1.1.8拉米夫定/替诺福韦(3TC+TDF,太斗)
-
1.5.1.1.9齐多夫定/拉米夫定/阿巴卡韦(Trizivir,AZT+3TC+ABC,三协唯)
-
1.5.1.1.10恩曲他滨替诺福韦片(Truvada,FTC+TDF,舒发泰)
-
1.5.1.2二、非核苷逆转录酶抑制剂(NNRTIs)
-
1.5.1.2.1奈韦拉平(Nevirapine,NVP)
-
1.5.1.2.2依非韦伦(Efavirenz,EFV)
-
1.5.1.2.3依曲韦林(Etravirine,ETV)
-
1.5.1.2.4利匹韦林(Rilppivrine,RPV)
-
1.5.1.3三、蛋白酶抑制剂(PIs)
-
1.5.1.3.1阿扎那韦(Atazanavir,ATV)
-
1.5.1.3.2达芦那韦(Darunavir)
-
1.5.1.3.3洛匹那韦/利托那韦片(Lopinavir and Ritonavir,LPV/r,克力芝)
-
1.5.1.4四、整合酶抑制剂(INSTIs)
-
1.5.1.4.1拉替拉韦钾(Raltegravir,RAL)
-
1.5.1.4.2多替拉韦钠(Dolutegravir,DTG)
-
1.5.1.4.3多替阿巴拉米片(多替拉韦50 mg+阿巴卡韦600 mg+拉米夫定300 mg,绥美凯)
-
1.5.1.4.4艾考恩丙替片(艾维雷韦150 mg+考比司他150 mg+恩曲他滨200 mg+丙酚替诺福韦10 m...
-
1.5.1.5五、融合抑制剂(FIs)
-
1.5.1.5.1恩夫韦肽(Enfuvirtide,ENF)
-
1.5.1.5.2艾博韦泰(Albuvirtide,ABT,艾可宁)
-
1.5.1.6六、CCR-5抑制剂
-
1.5.1.6.1马拉韦罗(Maraviroc,MVC)
-
1.5.1.7参考文献
-
1.5.2第二节 抗细菌药物
-
1.5.2.1一、β-内酰胺类
-
1.5.2.1.1注射用青霉素钠(Penicillin)
-
1.5.2.1.2苄星青霉素(Benzathine Benzylpenicillin)
-
1.5.2.1.3阿莫西林(Amoxicillin)
-
1.5.2.1.4哌拉西林(Piperacillin)
-
1.5.2.1.5头孢呋辛(Cefuroxim)
-
1.5.2.1.6头孢哌酮(Cefoperazone)
-
1.5.2.1.7头孢曲松(Ceftriaxone)
-
1.5.2.1.8头孢噻肟(Cefotaxime)
-
1.5.2.1.9头孢他啶(Ceftazidime)
-
1.5.2.1.10头孢吡肟(Cefepime)
-
1.5.2.1.11头孢西丁(Cefoxitin)
-
1.5.2.1.12头孢美唑(Cefmetazole)
-
1.5.2.1.13头孢米诺(Cefminox)
-
1.5.2.1.14亚胺培南西司他丁钠(Imipenem and Cilastatin Sodium)
-
1.5.2.1.15美罗培南(Meropenem)
-
1.5.2.1.16帕尼培南倍他米隆(Panipenem/Betamipron)
-
1.5.2.1.17厄他培南(Ertapenem)
-
1.5.2.1.18氨曲南(Aztreonam)
-
1.5.2.1.19哌拉西林他唑巴坦(Piperacillin/Tazobactam)
-
1.5.2.1.20头孢哌酮舒巴坦(Cefoperazone/sulbactam)
-
1.5.2.1.21氨苄西林舒巴坦(Ampicillin/sulbactam)
-
1.5.2.1.22阿莫西林克拉维酸(Amoxicillin clavulanic acid)
-
1.5.2.2二、喹诺酮类
-
1.5.2.2.1左氧氟沙星(Levofloxacin)
-
1.5.2.2.2莫西沙星(Moxifloxacin,拜复乐)
-
1.5.2.2.3环丙沙星(Ciprofloxacin)
-
1.5.2.2.4诺氟沙星(Norfloxacin)
-
1.5.2.3三、氨基糖苷类
-
1.5.2.3.1庆大霉素(Gentamicin)
-
1.5.2.3.2阿米卡星(Amikacin)
-
1.5.2.3.3异帕米星(Isepamicin)
-
1.5.2.4四、大环内酯类
-
1.5.2.4.1红霉素(Erythromycin)
-
1.5.2.4.2克拉霉素(Clarithromycin)
-
1.5.2.4.3阿奇霉素(Clarithromycin)
-
1.5.2.5五、四环素类
-
1.5.2.5.1多西环素(Doxycycline)
-
1.5.2.5.2米诺环素(Minocycline)
-
1.5.2.6六、林可酰胺类
-
1.5.2.6.1林可霉素(Lincomycin)
-
1.5.2.6.2克林霉素(Clindamycin)
-
1.5.2.7七、糖肽类
-
1.5.2.7.1万古霉素(Vancomycin)
-
1.5.2.7.2去甲万古霉素(Norvancomycin)
-
1.5.2.7.3替考拉宁(Teicoplanin)
-
1.5.2.8八、多黏菌素类
-
1.5.2.8.1多黏菌素E(Polymyxin E)
-
1.5.2.9九、唑烷酮类
-
1.5.2.9.1利奈唑胺(Linezolid)
-
1.5.2.10十、甘氨酰环素类
-
1.5.2.10.1替加环素(Tigecycline)
-
1.5.2.11十一、磺胺类
-
1.5.2.11.1磺胺嘧啶(Sulfadiazine)
-
1.5.2.11.2复方磺胺甲唑(SMZco,Compound Sulfamethoxazole,又作SMZ-TMP)
-
1.5.2.12十二、硝基咪唑类
-
1.5.2.12.1甲硝唑(Metronidazole)
-
1.5.2.12.2奥硝唑(Ornidazole)
-
1.5.2.12.3替硝唑(Tinidazole)
-
1.5.2.13十三、磷霉素类
-
1.5.2.13.1磷霉素(Phosphonomycin)
-
1.5.3第三节 抗真菌药物
-
1.5.3.1一、多烯类
-
1.5.3.1.1两性霉素B(Amphotericin B)
-
1.5.3.1.2两性霉素B脂质体(Amphotericin B Liposome)
-
1.5.3.2二、吡咯类(三唑类)
-
1.5.3.2.1氟康唑(Fluconazole)
-
1.5.3.2.2伊曲康唑(Itraconazole)
-
1.5.3.2.3伏立康唑(Voriconazole)
-
1.5.3.2.4泊沙康唑(Posaconazole)
-
1.5.3.3三、棘白菌素类
-
1.5.3.3.1卡泊芬净(Caspofungin)
-
1.5.3.3.2米卡芬净(Micafungin)
-
1.5.3.4四、5-氟胞嘧啶类
-
1.5.3.4.15-氟胞嘧啶(5-fluorocytosine)
-
1.5.4第四节 抗分枝杆菌药物
-
1.5.4.1一、利福霉素类
-
1.5.4.1.1利福平(Rifampin)
-
1.5.4.1.2利福布汀(Rifabutin)
-
1.5.4.2二、其他类
-
1.5.4.2.1异烟肼(Isoniazid)
-
1.5.4.2.2乙胺丁醇(Ethambutol)
-
1.5.4.2.3吡嗪酰胺(Pyrazinamide)
-
1.5.4.2.4贝达喹啉(Bedaquiline)
-
1.5.4.2.5利奈唑胺(Linezolid)
-
1.5.5第五节 抗丙型肝炎病毒药物
-
1.5.5.1索磷布韦/维帕他韦(Epclusa,丙通沙)
-
1.5.5.2艾尔巴韦/格拉瑞韦(Elbasvir/Grazoprevir,Zepatier,择必达)
-
1.5.5.3达塞布韦(Dasabuvir,Exviera,易奇瑞)
-
1.5.5.4阿舒瑞韦(Asunaprevir,速维普)
-
1.5.5.5奥比帕利(Ombitasvir,Paritaprevir and Ritonavir Tables,...
-
1.5.5.6达拉他韦(Daclatasvir,百立泽)
-
1.5.6第六节 抗寄生虫药物
-
1.5.6.1乙胺嘧啶(Pyrimethamine)
-
1.6第三章 药物代谢动力学
-
1.6.1第一节 特殊人群药代动力学
-
1.6.1.1一、妊娠期女性
-
1.6.1.2二、老年人
-
1.6.1.3三、新生儿
-
1.6.1.4四、肾功能不全患者
-
1.6.1.5五、肝功能不全患者
-
1.6.2第二节 药物基因组学
-
1.6.2.1一、药物基因组学概述
-
1.6.2.2二、药物基因组学的应用
-
1.6.2.2.1个体化给药与严重不良反应发生风险评估
-
1.6.2.2.2新药开发与临床试验
-
1.6.3第三节 药物代谢动力学与治疗药物浓度监测
-
1.6.3.1一、药物代谢动力学
-
1.6.3.2二、治疗药物浓度监测
-
1.7第四章 药物相互作用
-
1.7.1第一节 药物相互作用机制
-
1.7.1.1一、基本概念
-
1.7.1.2二、药物相互作用分类
-
1.7.1.3三、药代动力学相互作用
-
1.7.1.3.1药代动力学影响药物吸收
-
1.7.1.3.2药代动力学影响肝脏代谢
-
1.7.1.3.3药代动力学增强剂
-
1.7.1.3.4其他药代动力学相互作用机制
-
1.7.2第二节 艾滋病及其相关疾病常用治疗药物相互作用
-
1.7.2.1一、抗逆转录病毒药物
-
1.7.2.1.1(一)核苷逆转录酶抑制剂(NRTIs)
-
1.7.2.1.2(二)非核苷逆转录酶抑制剂(NNRTIs)
-
1.7.2.1.3(三)蛋白酶抑制剂(PIs)
-
1.7.2.1.4(四)整合酶抑制剂
-
1.7.2.1.5(五)CCR-5抑制剂
-
1.7.2.2二、抗分枝杆菌药物
-
1.7.2.2.1利福平(Rifampin)
-
1.7.2.2.2利福布汀(Rifabutin)
-
1.7.2.2.3异烟肼(Isoniazid)
-
1.7.2.2.4乙胺丁醇(Ethambutol)
-
1.7.2.2.5吡嗪酰胺(Pyrazinamide)
-
1.7.2.2.6对氨基水杨酸钠(Aminosalicylate sodium)
-
1.7.2.2.7贝达喹啉(Bedaquiling)
-
1.7.2.3三、抗真菌药物
-
1.7.2.3.1氟康唑(Fluconazole)
-
1.7.2.3.2伊曲康唑(Itraconazole)
-
1.7.2.3.3伏立康唑(Voriconazole)
-
1.7.2.3.4卡泊芬净(Caspofungin)
-
1.7.2.3.5两性霉素B(Amphotericin B)
-
1.7.2.3.65-氟胞嘧啶(5-fluorocytosine)
-
1.7.2.4四、抗细菌药物
-
1.7.2.4.1林可霉素(Lincomycin)
-
1.7.2.4.2克拉霉素(Clarithromycin)
-
1.7.2.4.3万古霉素(Vancomycin)
-
1.7.2.5五、抗丙型肝炎病毒药物
-
1.7.2.5.1索磷布韦/维帕他韦(Epclusa,丙通沙)
-
1.7.2.5.2艾尔巴韦/格拉瑞韦(Elbasvir/Grazoprevir,Zepatier,择必达)
-
1.7.2.5.3达塞布韦(Dasabuvir,Exviera,易奇瑞)
-
1.7.2.5.4阿舒瑞韦(Asunaprevir,速维普)
-
1.7.2.5.5奥比帕利(Ombitasvir,Paritaprevir and Ritonavir Tables,...
-
1.7.2.5.6达拉他韦(Daclatasvir,百立泽)
-
1.8附录 抗逆转录病毒药物与其他药物相互作用速查表
-
1.8.1药物相互作用分级
-
1.8.2抗逆转录病毒药物缩写
-
1.8.2.1一、抗逆转录病毒药物与心血管药物之间的相互作用
-
1.8.2.2二、抗逆转录病毒药物与中枢神经系统药物之间的相互作用
-
1.8.2.3三、抗逆转录病毒药物与抗感染药物之间的相互作用
-
1.8.2.4四、抗逆转录病毒药物与其他药物之间的相互作用
-
1.8.2.5五、抗逆转录病毒药物与抗抑郁药之间的相互作用
-
1.8.2.6六、抗逆转录病毒药物与抗高血压药之间的相互作用
-
1.8.2.7七、抗逆转录病毒药物与镇痛药之间的相互作用
-
1.8.2.8八、抗逆转录病毒药物与抗凝/抗血小板药物之间的相互作用
-
1.8.2.9九、抗逆转录病毒药物与支气管扩张药物(治疗慢性阻塞性肺病)之间的相互作用
-
1.8.2.10十、抗逆转录病毒药物与避孕药/激素替代疗法之间的相互作用
-
1.8.2.11十一、抗逆转录病毒药物与类固醇皮质激素之间的相互作用
-
1.8.2.12十二、抗逆转录病毒药物与抗疟药之间的相互作用
-
1.8.2.13十三、抗逆转录病毒药物与抗肺动脉高压药之间的相互作用
-
1.8.2.14十四、抗逆转录病毒药物与免疫抑制剂之间的相互作用
-
1.8.2.15十五、抗逆转录病毒药物与抗丙型肝炎病毒药物之间的相互作用
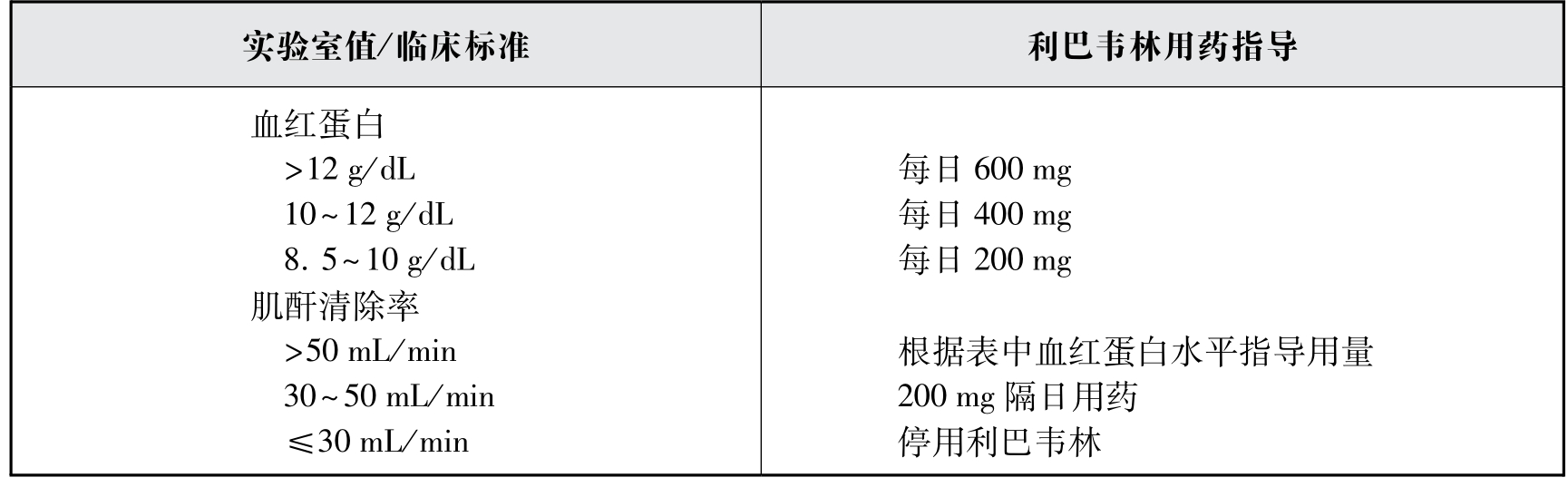
1
艾滋病及其相关疾病常用药物与相互作用