-
1.1扉页
-
1.2目录
-
1.3编 委 会
-
1.4再版前言
-
1.5再版说明
-
1.6绪 论
-
1.6.1一、药用植物学的研究内容及任务
-
1.6.2二、药用植物学的发展
-
1.6.3三、药用植物学的学习方法
-
1.7第 一 章 植物的细胞
-
1.7.1一、植物细胞的形态和基本结构
-
1.7.2二、原生质体
-
1.7.3三、植物细胞的后含物
-
1.7.4四、细胞壁
-
1.8第二章 物的组织
-
1.8.1第一节 植物组织的种类
-
1.8.1.1一、分生组织
-
1.8.1.2二、基本组织
-
1.8.1.3三、保护组织
-
1.8.1.4四、分泌组织
-
1.8.1.5五、机械组织
-
1.8.1.6六、输导组织
-
1.8.2第二节 维管束及其类型
-
1.9第三章 物的器官
-
1.9.1第一节 根
-
1.9.1.1一、正常根的形态与类型
-
1.9.1.2二、变态根的形态与类型
-
1.9.1.3三、根的显微构造
-
1.9.2第二节 茎
-
1.9.2.1一、茎的基本形态
-
1.9.2.2二、茎的类型
-
1.9.2.3三、茎的变态
-
1.9.2.4四、茎的显微构造
-
1.9.3第三节 叶
-
1.9.3.1一、叶的组成
-
1.9.3.2二、叶的各部形态
-
1.9.3.3三、单叶与复叶
-
1.9.3.4四、叶序
-
1.9.3.5五、叶的变态
-
1.9.3.6六、叶的显微构造
-
1.9.4第四节 花
-
1.9.4.1一、花的组成部分及其形态结构
-
1.9.4.2二、花的类型
-
1.9.4.3三、花程式与花图式
-
1.9.4.4四、花序
-
1.9.4.5五、花的生理功能
-
1.9.5第五节 果 实
-
1.9.5.1一、果实的形成和结构
-
1.9.5.2二、果实的类型
-
1.9.5.3三、果实的生理功能
-
1.9.6第六节 种 子
-
1.9.6.1一、种子的形态和结构
-
1.9.6.2二、种子的类型
-
1.9.6.3三、种子的生理功能
-
1.10第四章 物分类概述
-
1.10.1第一节 植物分类的目的和意义
-
1.10.2第二节 植物分类简史
-
1.10.3第三节 植物分类等级
-
1.10.4第四节 植物的学名
-
1.10.4.1一、植物的物种命名法
-
1.10.4.2二、植物学名的组成
-
1.10.5第五节 植物界的分门别类
-
1.10.6第六节 植物分类检索表
-
1.10.6.1一、定距式检索表
-
1.10.6.2二、平行式检索表
-
1.10.6.3三、连续平行式检索表
-
1.11第五章 类植物 Algae
-
1.11.1第一节 藻类植物概述
-
1.11.2第二节 藻类植物的分类
-
1.11.2.1一、蓝藻门 Cyanophyta
-
1.11.2.2二、绿藻门 Chlorophyta
-
1.11.2.3三、红藻门 Rhodophyta
-
1.11.2.4四、褐藻门 Phaeophyta
-
1.12第六章 菌类植物 Fungi
-
1.12.1第一节 菌类植物概述
-
1.12.2第二节 真菌门 Eumycota
-
1.12.2.1一、真菌的特征
-
1.12.2.2二、真菌的分类
-
1.13第七章 衣植物门 Lichenes
-
1.13.1第一节 地衣植物概述
-
1.13.2第二节 地衣的形态结构及主要药用种类
-
1.13.2.1一、壳状地衣(crustose lichens)
-
1.13.2.2二、叶状地衣(foliose lichens)
-
1.13.2.3三、枝状地衣(fruticose lichens)
-
1.14第八章 藓植物门 Bryophyta
-
1.14.1第一节 苔藓植物的特征
-
1.14.2第二节 苔藓植物的分类
-
1.14.2.1一、苔纲 Hepaticae
-
1.14.2.2二、藓纲 Musci
-
1.15第九章 类植物门 Pteridophyta
-
1.15.1第一节 蕨类植物的主要特征
-
1.15.1.1一、蕨类植物的孢子体
-
1.15.1.2二、蕨类植物的配子体
-
1.15.1.3三、蕨类植物的生活史
-
1.15.1.4四、蕨类植物的化学成分
-
1.15.2第二节 蕨类植物的分类
-
1.16第十章 子植物门 Gymnospermae
-
1.16.1第一节 裸子植物的主要特征
-
1.16.1.1一、植物体特征
-
1.16.1.2二、裸子植物的化学成分
-
1.16.2第二节 裸子植物的分类
-
1.17第十一章 子植物门 Angiospermae
-
1.17.1第一节 被子植物的主要特征
-
1.17.2第二节 被子植物分类的一般原则
-
1.17.3第三节 被子植物分类系统简介
-
1.17.3.1一、恩格勒系统
-
1.17.3.2二、哈钦松系统
-
1.17.3.3三、塔赫他间系统
-
1.17.3.4四、克朗奎斯特系统
-
1.17.4第四节 被子植物的分类及重要药用植物
-
1.17.4.1一、双子叶植物纲 Dicotyledoneae
-
1.17.4.2二、单子叶植物纲 Monocotyledoneae
-
1.18第十二章 物分类的主要研究方法
-
1.18.1第一节 形态分类学
-
1.18.2第二节 超微结构分类学
-
1.18.2.1一、孢粉微结构研究
-
1.18.2.2二、表皮微结构研究
-
1.18.3第三节 实验分类学
-
1.18.4第四节 细胞分类学
-
1.18.4.1一、染色体的数目
-
1.18.4.2二、染色体的结构
-
1.18.4.3三、染色体行为
-
1.18.5第五节 化学分类学
-
1.18.5.1一、低分子量化合物
-
1.18.5.2二、高分子量化合物
-
1.18.6第六节 分子系统学
-
1.18.6.1一、分子数据的来源
-
1.18.6.2二、分子系统学研究的常用技术
-
1.18.7第七节 数量分类学
-
1.18.7.1一、现代数量分类学原理
-
1.18.7.2二、数量分类学研究步骤
-
1.18.7.3三、数量分类法的应用
-
1.18.7.4四、分支分类学
-
1.19第十三章 用植物组织、细胞培养和基因工程
-
1.19.1第一节 植物组织和细胞培养
-
1.19.1.1一、植物组织培养
-
1.19.1.2二、植物细胞培养
-
1.19.1.3三、单倍体培养
-
1.19.1.4四、原生质体培养与体细胞杂交
-
1.19.1.5五、毛状根培养
-
1.19.2第二节 植物快速无性繁殖技术
-
1.19.2.1一、快速无性繁殖体系的建立
-
1.19.2.2二、快速无菌繁殖体系的应用
-
1.19.3第三节 植物基因工程
-
1.19.3.1一、植物基因克隆
-
1.19.3.2二、植物转化载体的构建与目的基因的转化
-
1.19.3.3三、外源基因整合及表达的检测
-
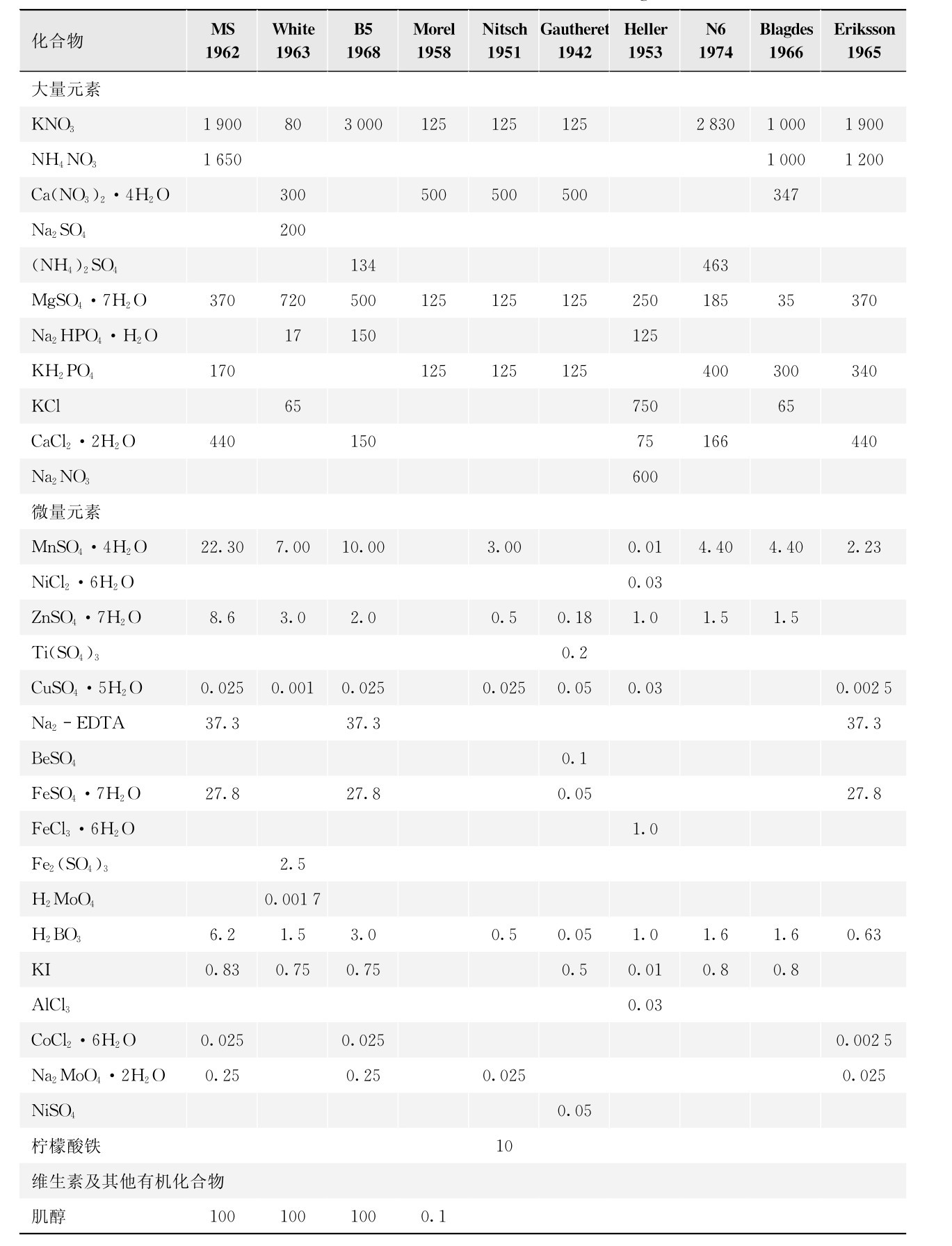
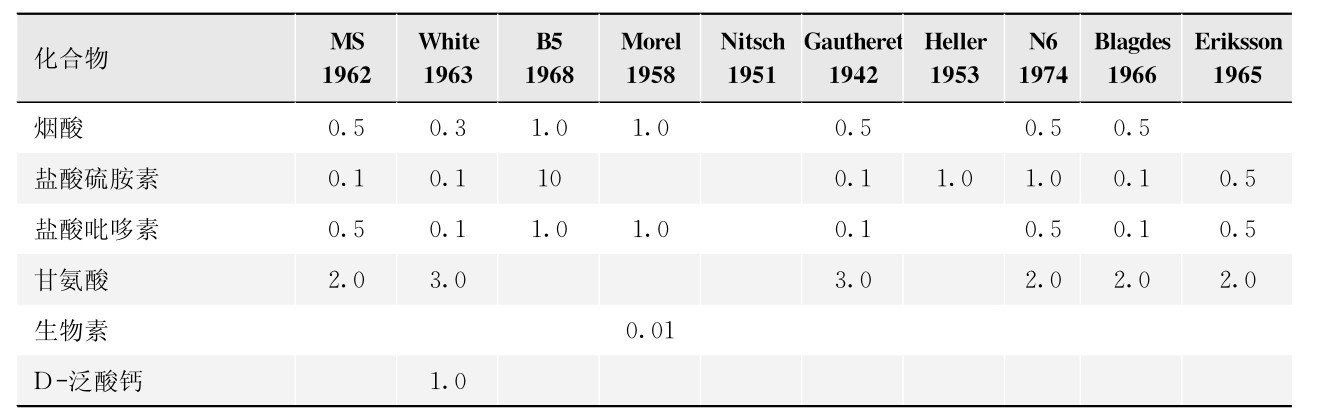
1.19.4第四节 应用植物组织、细胞培养和基因工程研究和生产药用成分
-
1.19.4.1一、药用有效成分的生物合成研究
-
1.19.4.2二、药用次生代谢产物的生产
-
1.20附录一 子植物门分科检索表
-
1.21附录二 用植物拉丁文学名索引
-
1.22参 考 答 案
-
1.23参 考 文 献
1
药用植物学