-
1.1《社区卫生工作实用丛书》编委会
-
1.2序
-
1.3前 言
-
1.4第一章 基础知识
-
1.4.1第一节 电离辐射的医学应用及发展
-
1.4.2第二节 原子结构X线核素与原子核的衰变
-
1.4.3第三节 辐射剂量学基础
-
1.4.4第四节 电离辐射与物质的相互作用
-
1.4.5第五节 电离辐射的生物学效应
-
1.4.6第六节 影响辐射生物效应的因素
-
1.5第二章 医用放射防护相关标准
-
1.5.1第一节 防护标准演变的历史回顾
-
1.5.2第二节 电离辐射防护与核安全基本标准
-
1.5.3第三节 我国现行的医用辐射防护标准体系
-
1.6第三章 医用X线放射诊断的放射防护
-
1.6.1第一节 医用X线放射诊断发展历史
-
1.6.2第二节 医用X线放射诊断工作场所与设备的防护措施
-
1.6.3第三节 医用X线放射诊断的患者防护
-
1.6.4第四节 医用X线放射诊断工作场所与设备质量控制检测
-
1.7第四章 介入放射学的放射防护
-
1.7.1第一节 介入放射学防护概述
-
1.7.2第二节 介入放射学工作场所与设备的防护措施
-
1.7.3第三节 介入放射工作者与患者的防护措施
-
1.7.4第四节 介入放射学工作场所与设备的检测
-
1.8第五章 核医学诊断和治疗中的防护
-
1.8.1第一节 核医学诊断和治疗防护概述
-
1.8.2第二节 核医学诊断和治疗场所的防护措施
-
1.8.3第三节 核医学诊断和治疗的质量控制与质量保证措施
-
1.8.4第四节 操作非密封源的防护措施
-
1.8.5第五节 核医学诊断和治疗的患者防护
-
1.9第六章 肿瘤放射治疗中的放射防护
-
1.9.1第一节 肿瘤放射治疗防护的特殊性
-
1.9.2第二节 肿瘤放射治疗工作场所的防护措施
-
1.9.3第三节 肿瘤放射治疗的质量保证与质量控制
-
1.9.4第四节 肿瘤放射治疗中的患者防护
-
1.9.5第五节 肿瘤放射治疗中的事故预防
-
1.10第七章 医用辐射防护管理
-
1.10.1第一节 放射诊疗许可
-
1.10.2第二节 放射诊疗项目辐射安全许可
-
1.10.3第三节 职业病危害放射防护管理
-
1.10.4第四节 医用辐射事故卫生应急
-
1.11第八章 放射工作人员的职业健康管理
-
1.11.1第一节 放射工作人员职业健康管理的法律依据
-
1.11.2第二节 放射工作人员的从业条件
-
1.11.3第三节 放射工作人员的防护知识培训
-
1.11.4第四节 个人剂量监测与管理
-
1.11.5第五节 职业健康监护管理
-
1.11.6第六节 职业性放射性疾病的诊断与鉴定
-
1.12第九章 辐射监测
-
1.12.1第一节 工作场所监测
-
1.12.2第二节 个人剂量监测
-
1.12.3第三节 实验室监测
-
1.12.4第四节 常用监测仪器及原理
-
1.12.5第五节 测量方法实例
-
1.13附 录
-
1.14参考文献
1
社区医用辐射防护手册

 X来表示。左下标Z表示质子数或正电荷数,左上标A(A=N+Z)为核内的核子数,又称质量数。核素符号X与质子数Z具有唯一、确定的关系,如
X来表示。左下标Z表示质子数或正电荷数,左上标A(A=N+Z)为核内的核子数,又称质量数。核素符号X与质子数Z具有唯一、确定的关系,如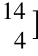 He
He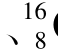 O
O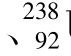 U等。Z在原子核中为质子数,在原子中则为原子序数。只要元素符号X相同,不同质量数的元素在周期表中的位置相同,就具有基本相同的化学性质。例如
U等。Z在原子核中为质子数,在原子中则为原子序数。只要元素符号X相同,不同质量数的元素在周期表中的位置相同,就具有基本相同的化学性质。例如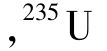 和
和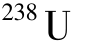 都是铀元素,两者只相差3个中子,它们的化学性质及一般物理性质几乎完全相同;但是,它们是两个完全不同的核素,它们的核性质完全不同。
都是铀元素,两者只相差3个中子,它们的化学性质及一般物理性质几乎完全相同;但是,它们是两个完全不同的核素,它们的核性质完全不同。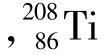 i
i Pb是独立的两种核素,它们有相同的质量数而原子核内含有不同的质子数
Pb是独立的两种核素,它们有相同的质量数而原子核内含有不同的质子数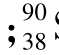 Sr
Sr Y是原子核内含有不同的质子数和相同的中子数的独立的两种核素
Y是原子核内含有不同的质子数和相同的中子数的独立的两种核素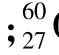 Co和
Co和 Co是独立的两种核素,它们的原子核内含有相同的质子数和中子数,而核所处的能态是不同的。
Co是独立的两种核素,它们的原子核内含有相同的质子数和中子数,而核所处的能态是不同的。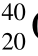 Ca、
Ca、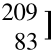 Bi等,自然存在的稳定核素约有270个;另一类是不稳定的核素。不稳定核素是指其原子核会自发地转变成另一种原子核或另一种状态并伴随一些粒子或碎片的发射,它又称为放射性原子核,如
Bi等,自然存在的稳定核素约有270个;另一类是不稳定的核素。不稳定核素是指其原子核会自发地转变成另一种原子核或另一种状态并伴随一些粒子或碎片的发射,它又称为放射性原子核,如 Po(发射α粒子)
Po(发射α粒子)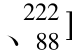 Ra(发射α粒子、β粒子)、
Ra(发射α粒子、β粒子)、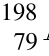 Au(发射β粒子)。
Au(发射β粒子)。