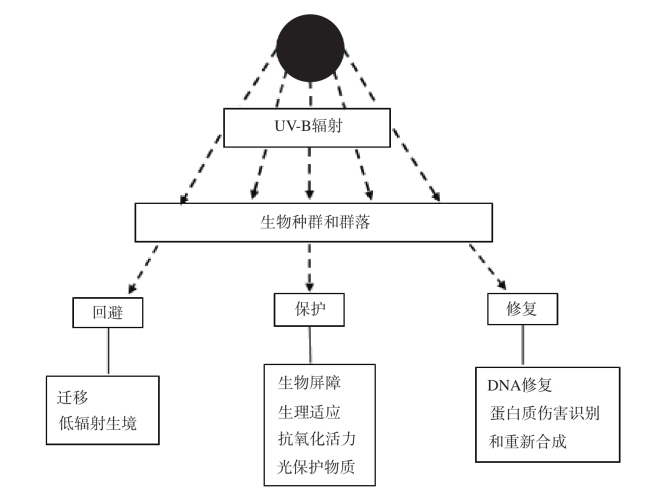
-
1.1内容简介
-
1.2前 言
-
1.3第一篇 概论篇
-
1.3.1第一章 海洋恢复生态学的内涵和定义
-
1.3.1.1第一节 应用生态学
-
1.3.1.1.1一、定义
-
1.3.1.1.2二、应用生态学与经典生态学的区别
-
1.3.1.1.3三、 恢复生态学是应用生态学的一个分支学科
-
1.3.1.2第二节 与恢复生态学相关的术语
-
1.3.1.2.1一、恢复与修复
-
1.3.1.2.2二、相关的术语
-
1.3.1.3第三节 生物修复
-
1.3.1.3.1一、 生物修复的定义
-
1.3.1.3.2二、 生物修复的类别
-
1.3.1.4第四节 生态恢复
-
1.3.1.4.1一、 侧重于目标的定义
-
1.3.1.4.2二、 侧重于过程的定义
-
1.3.1.4.3三、 较为完整的定义
-
1.3.1.5第五节 恢复生态学与海洋恢复生态学的概念
-
1.3.1.5.1一、 生态恢复与恢复生态学
-
1.3.1.5.2二、 恢复生态学的定义
-
1.3.1.5.3三、 海洋恢复生态学的内涵
-
1.3.1.5.4小结
-
1.3.1.5.5思考题
-
1.3.1.5.6拓展阅读资料
-
1.3.2第二章 海洋恢复生态学的背景
-
1.3.2.1第一节 全球生态系统在退化
-
1.3.2.1.1一、千年生态系统评估再次敲响了警钟
-
1.3.2.1.2二、全球处于环境与发展的转折点
-
1.3.2.1.3三、 地球生态系统已严重超载
-
1.3.2.1.4四、脆弱的土地、森林、草原和淡水生态系统
-
1.3.2.2第二节 海洋生态系统受损严重
-
1.3.2.2.1一、 生境受到严重损害
-
1.3.2.2.2二、 典型海洋生态系统退化
-
1.3.2.2.3三、 海洋生态灾害频发
-
1.3.2.2.4四、 过度捕捞和近海养殖对海洋生态系统产生威胁
-
1.3.2.2.5小结
-
1.3.2.2.6思考题
-
1.3.2.2.7拓展阅读资料
-
1.3.3第三章 海洋恢复生态学发展简史
-
1.3.3.1第一节 恢复生态学的发展简史
-
1.3.3.1.1一、恢复生态学的起源
-
1.3.3.1.2二、恢复生态学的诞生与成长
-
1.3.3.1.3三、 我国恢复生态学的发展简史
-
1.3.3.2第二节 海洋恢复生态学的发展简史
-
1.3.3.2.1一、 生境恢复和景观恢复
-
1.3.3.2.2二、 渔业资源的恢复
-
1.3.3.2.3三、 典型海洋生态系统恢复
-
1.3.3.2.4小结
-
1.3.3.2.5思考题
-
1.3.3.2.6拓展阅读资料
-
1.3.4第四章 海洋恢复生态学的研究内容
-
1.3.4.1第一节 海洋恢复生态学是一门合成的应用学科
-
1.3.4.2第二节 促进学科发展的一些认知问题
-
1.3.4.3第三节 海洋恢复生态学的主要研究内容
-
1.3.4.3.1一、 构建海洋恢复生态学的理论体系
-
1.3.4.3.2二、 构建海洋恢复生态学的方法和技术体系
-
1.3.4.3.3三、 构建海洋生态恢复的管理体系
-
1.3.4.3.4小结
-
1.3.4.3.5思考题
-
1.3.4.3.6拓展阅读资料
-
1.4第二篇 基础理论篇
-
1.4.1第五章 海洋生态系统
-
1.4.1.1第一节 生态系统概述
-
1.4.1.1.1一、 生态系统的定义
-
1.4.1.1.2二、 生态系统的组成
-
1.4.1.1.3三、 生态系统的结构
-
1.4.1.1.4四、 生态系统的功能
-
1.4.1.1.5五、生态平衡
-
1.4.1.2第二节 海洋生态系统的特点
-
1.4.1.2.1一、 海洋环境
-
1.4.1.2.2二、 海洋生物生态类群
-
1.4.1.2.3三、 能量流动和物质循环
-
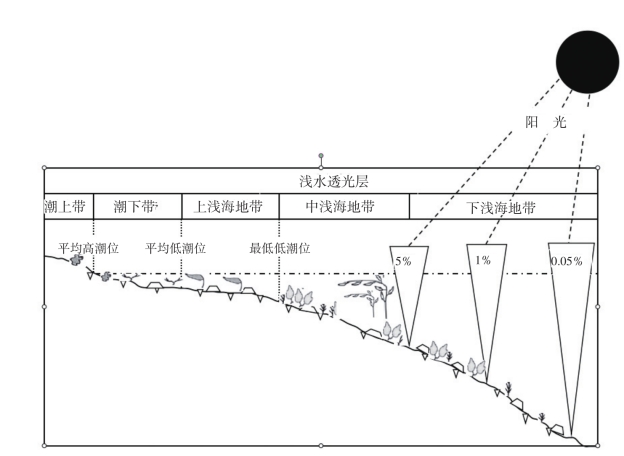
1.4.1.2.4四、海洋初级生产力
-
1.4.1.2.5五、海洋生态系统与其他生态系统的对比
-
1.4.1.3第三节 典型海洋生态系统
-
1.4.1.3.1一、红树林生态系统
-
1.4.1.3.2二、 珊瑚礁生态系统
-
1.4.1.3.3三、 海藻场和海草床生态系统
-
1.4.1.3.4四、 河口生态系统
-
1.4.1.3.5五、 滨海湿地生态系统
-
1.4.1.3.6六、 海湾生态系统
-
1.4.1.3.7七、 海岛生态系统
-
1.4.1.3.8小结
-
1.4.1.3.9思考题
-
1.4.1.3.10拓展阅读资料
-
1.4.2第六章 海洋生态系统退化
-
1.4.2.1第一节 海洋退化生态系统定义
-
1.4.2.2第二节 海洋退化生态系统的类型和特征
-
1.4.2.2.1一、 海洋退化生态系统的类型
-
1.4.2.2.2二、 海洋退化生态系统的特征
-
1.4.2.3第三节 海洋退化生态系统的成因
-
1.4.2.3.1一、过度捕捞
-
1.4.2.3.2二、全球变化
-
1.4.2.3.3三、 海洋污染
-
1.4.2.3.4四、 海水养殖
-
1.4.2.3.5五、外来物种入侵
-
1.4.2.3.6六、 围填海
-
1.4.2.4第四节 海洋退化生态系统的诊断
-
1.4.2.4.1一、 生物层面
-
1.4.2.4.2二、 生境层面
-
1.4.2.4.3三、 生态系统层面
-
1.4.2.4.4四、 生态景观层面
-
1.4.2.4.5小结
-
1.4.2.4.6思考题
-
1.4.2.4.7拓展阅读资料
-
1.4.3第七章 海洋恢复生态学的理论基础
-
1.4.3.1第一节 海洋恢复生态学自身的理论
-
1.4.3.1.1一、自我设计理论
-
1.4.3.1.2二、人为设计理论
-
1.4.3.2第二节 限制因子原理
-
1.4.3.2.1一、 利比希最小因子定律
-
1.4.3.2.2二、 谢尔福德耐受定律
-
1.4.3.3第三节 种群生态学理论
-
1.4.3.3.1一、 阿利氏规律
-
1.4.3.3.2二、 种间关系原理
-
1.4.3.4第四节 群落生态学理论
-
1.4.3.4.1一、 生态位理论
-
1.4.3.4.2二、 生态演替理论
-
1.4.3.4.3三、 边缘效应理论
-
1.4.3.4.4四、 生物多样性原理
-
1.4.3.5第五节 生态系统生态学理论
-
1.4.3.5.1一、 干扰-稳定性理论
-
1.4.3.5.2二、 阈值理论
-
1.4.3.5.3小结
-
1.4.3.5.4思考题
-
1.4.3.5.5拓展阅读资料
-
1.4.4第八章 海洋恢复生态学的学科基础
-
1.4.4.1第一节 景观生态学
-
1.4.4.1.1一、 基本概念
-
1.4.4.1.2二、 基本理论
-
1.4.4.2第二节 海洋生态系统服务
-
1.4.4.2.1一、 海洋生态系统服务的概念
-
1.4.4.2.2二、 海洋生态系统服务的内容
-
1.4.4.2.3三、 海洋生态系统服务的产生过程与实现途径
-
1.4.4.2.4四、 海洋生态系统服务的经济价值评估
-
1.4.4.3第三节 海洋生态系统管理
-
1.4.4.3.1一、 生态系统管理的概念
-
1.4.4.3.2二、 生态系统管理的特性
-
1.4.4.3.3三、 海洋生态系统管理的特殊性
-
1.4.4.4第四节 海洋生态系统健康
-
1.4.4.4.1一、海洋生态系统健康的概念
-
1.4.4.4.2二、海洋生态系统健康的影响因素
-
1.4.4.4.3三、海洋生态系统健康评价
-
1.4.4.4.4小结
-
1.4.4.4.5思考题
-
1.4.4.4.6拓展阅读资料
-
1.5第三篇 技术方法篇
-
1.5.1第九章 海洋生态恢复的程序与原则
-
1.5.1.1第一节 海洋生态恢复的程序
-
1.5.1.1.1一、一般生态恢复程序
-
1.5.1.1.2二、 海洋生态恢复的立项阶段
-
1.5.1.1.3三、生态恢复计划的编制
-
1.5.1.1.4四、 生态恢复计划的实施
-
1.5.1.1.5五、 恢复成效评估及后续管理
-
1.5.1.2第二节 景观生态规划方法
-
1.5.1.2.1一、 景观生态学与景观生态规划
-
1.5.1.2.2二、 景观生态恢复技术
-
1.5.1.2.3三、 景观生态规划设计的原则与步骤
-
1.5.1.3第三节 海洋生态恢复监测的技术与方法
-
1.5.1.3.1一、 海洋生态恢复与监测的关系
-
1.5.1.3.2二、 海洋生态恢复监测的流程及需要考虑的问题
-
1.5.1.3.3小结
-
1.5.1.3.4思考题
-
1.5.1.3.5拓展阅读资料
-
1.5.2第十章 生物资源恢复技术
-
1.5.2.1第一节 鱼类资源恢复方法与技术
-
1.5.2.1.1一、 建立休渔区和休渔期
-
1.5.2.1.2二、 增殖放流
-
1.5.2.1.3三、 人工鱼礁
-
1.5.2.2第二节 海参资源恢复方法与技术
-
1.5.2.2.1一、 底播增殖技术
-
1.5.2.2.2二、 海珍礁技术
-
1.5.2.3第三节 虾类资源恢复方法与技术
-
1.5.2.3.1一、 对虾放流种苗的获得
-
1.5.2.3.2二、 对虾放流地点的选择
-
1.5.2.3.3三、 放流时间选择
-
1.5.2.3.4四、放流对虾种苗规格
-
1.5.2.3.5五、 对虾种苗运输与放流
-
1.5.2.3.6六、 放流区域管理
-
1.5.2.3.7七、 效果监测与评估
-
1.5.2.4第四节 贝类资源恢复方法与技术
-
1.5.2.4.1一、 魁蚶底播增殖方法与技术
-
1.5.2.4.2二、 文蛤资源管护方法与技术
-
1.5.2.5第五节 乌贼资源恢复方法与技术
-
1.5.2.5.1一、曼氏无针乌贼增殖放流
-
1.5.2.5.2二、 曼氏无针乌贼产卵场的修复
-
1.5.2.6第六节 海洋大型藻类资源恢复方法与技术
-
1.5.2.6.1一、 人工藻礁
-
1.5.2.6.2二、 种源补充
-
1.5.2.6.3三、贝藻间养
-
1.5.2.6.4小结
-
1.5.2.6.5思考题
-
1.5.2.6.6拓展阅读资料
-
1.5.3第十一章 生态种群恢复技术
-
1.5.3.1第一节 海草种群恢复技术与方法
-
1.5.3.1.1一、生境修复法
-
1.5.3.1.2二、 种子法
-
1.5.3.1.3三、 移植法
-
1.5.3.1.4四、大叶藻的恢复方法和程序
-
1.5.3.1.5五、 监测、保护和管理
-
1.5.3.2第二节 珊瑚种群恢复技术与方法
-
1.5.3.2.1一、 移植法
-
1.5.3.2.2二、 园艺
-
1.5.3.2.3三、 人工繁育
-
1.5.3.2.4四、人工渔礁
-
1.5.3.2.5五、稳固底质
-
1.5.3.2.6六、 珊瑚幼体附着研究
-
1.5.3.2.7七、代表种类珊瑚的繁殖
-
1.5.3.2.8八、评估、监测、保护与管理
-
1.5.3.3第三节 红树植物的恢复方法与技术
-
1.5.3.3.1一、 造林地的选择
-
1.5.3.3.2二、 胚轴插植法
-
1.5.3.3.3三、人工育苗法
-
1.5.3.3.4四、直接移植法
-
1.5.3.3.5五、不同红树植物种群的恢复方法与技术
-
1.5.3.3.6六、监管与评估
-
1.5.3.4第四节 盐碱湿地植物的恢复方法与技术
-
1.5.3.4.1一、 盐碱湿地植物的快速繁殖和栽培技术方法
-
1.5.3.4.2二、 盐碱湿地植物的造林技术
-
1.5.3.4.3三、不同盐碱湿地植物种群的恢复方法和技术
-
1.5.3.4.4四、 盐碱地植物种群恢复的评估
-
1.5.3.4.5小结
-
1.5.3.4.6思考题
-
1.5.3.4.7拓展阅读资料
-
1.5.4第十二章 生境修复方法与技术
-
1.5.4.1第一节 近岸海域重金属污染修复方法与技术
-
1.5.4.1.1一、 物理修复
-
1.5.4.1.2二、 化学修复
-
1.5.4.1.3三、 生物修复
-
1.5.4.2第二节 海洋石油污染区修复
-
1.5.4.2.1一、 海洋石油污染原因及其危害
-
1.5.4.2.2二、 海洋石油污染的修复方法
-
1.5.4.2.3三、不同海况海洋石油污染处理方法优化配置
-
1.5.4.2.4四、海洋溢油生态修复监测与评估
-
1.5.4.3第三节 水体及底泥富营养化修复方法与技术
-
1.5.4.3.1一、 富营养化污染现状及评价方法
-
1.5.4.3.2二、 水体富营养化修复技术
-
1.5.4.3.3三、 底泥富营养化修复技术
-
1.5.4.4第四节 海岸工程生态恢复
-
1.5.4.4.1一、 海岸环境现状概述
-
1.5.4.4.2二、 海岸工程生态恢复方法
-
1.5.4.4.3三、 海岸工程生态恢复效果评估
-
1.5.4.5第五节 沙滩修复技术与方法
-
1.5.4.5.1一、 沙滩修复方式
-
1.5.4.5.2二、 沙滩修复规划
-
1.5.4.5.3三、 沙滩修复的监测评估技术方法
-
1.5.4.5.4小结
-
1.5.4.5.5思考题
-
1.5.4.5.6拓展阅读资料
-
1.5.5第十三章 生态系统恢复技术与方法
-
1.5.5.1第一节 海藻场生态系统恢复技术与方法
-
1.5.5.1.1一、 恢复方案
-
1.5.5.1.2二、技术方法
-
1.5.5.2第二节 红树林生态系统恢复技术方法
-
1.5.5.2.1一、 红树林生态系统恢复方案
-
1.5.5.2.2二、 红树林生态系统恢复技术方法
-
1.5.5.3第三节 珊瑚礁生态系统恢复技术方法
-
1.5.5.3.1一、 珊瑚礁恢复方案
-
1.5.5.3.2二、 技术方法
-
1.5.5.4第四节 河口生态系统恢复
-
1.5.5.4.1一、 河口生态系统恢复方案
-
1.5.5.4.2二、 技术方法
-
1.5.5.5第五节 滨海湿地生态系统恢复
-
1.5.5.5.1一、 滨海湿地恢复方案
-
1.5.5.5.2二、 湿地生态系统恢复的技术方法
-
1.5.5.6第六节 海岛生态系统修复
-
1.5.5.6.1一、 海岛生态系统恢复方案
-
1.5.5.6.2二、 技术方法
-
1.5.5.6.3小结
-
1.5.5.6.4思考题
-
1.5.5.6.5拓展阅读资料
-
1.6第四篇 应用案例篇
-
1.6.1第十四章 典型海洋生态受损区的恢复
-
1.6.1.1第一节 海藻场的恢复
-
1.6.1.1.1一、 背景
-
1.6.1.1.2二、 恢复目标
-
1.6.1.1.3三、 恢复过程
-
1.6.1.1.4(二)褚岛海藻场的恢复
-
1.6.1.1.5(三)潮里岛礁海藻场的恢复
-
1.6.1.1.6一、 背景
-
1.6.1.1.7二、 恢复过程
-
1.6.1.1.8三、 恢复效果
-
1.6.1.1.9案例分析
-
1.6.1.1.10思考题
-
1.6.1.1.11拓展阅读资料
-
1.6.1.2第二节 湿地的恢复
-
1.6.1.2.1一、 背景
-
1.6.1.2.2二、 恢复区域
-
1.6.1.2.3三、 恢复目标
-
1.6.1.2.4四、 恢复过程
-
1.6.1.2.5案例分析
-
1.6.1.2.6思考题
-
1.6.1.2.7拓展阅读资料
-
1.6.1.3第三节 海湾的恢复
-
1.6.1.3.1一、 背景
-
1.6.1.3.2二、 恢复目标
-
1.6.1.3.3三、 恢复过程
-
1.6.1.3.4案例分析
-
1.6.1.3.5思考题
-
1.6.1.3.6拓展阅读资料
-
1.6.1.4第四节 海岛的恢复
-
1.6.1.4.1一、 定义
-
1.6.1.4.2二、 恢复目标
-
1.6.1.4.3三、 恢复技术及案例
-
1.6.1.4.4四、 海岛生态恢复研究趋势
-
1.6.1.4.5思考题
-
1.6.1.4.6拓展阅读资料
-
1.6.1.5第五节 潟湖的恢复
-
1.6.1.5.1一、 背景
-
1.6.1.5.2二、 恢复目标
-
1.6.1.5.3三、 恢复过程
-
1.6.1.5.4案例分析
-
1.6.1.5.5思考题
-
1.6.1.5.6拓展阅读资料
-
1.6.1.6第六节 红树林的恢复
-
1.6.1.6.1一、 背景
-
1.6.1.6.2二、 恢复目标
-
1.6.1.6.3三、 保护策略
-
1.6.1.6.4四、工程保障措施与展望
-
1.6.1.6.5思考题
-
1.6.1.6.6拓展阅读资料
-
1.6.1.7第七节 柽柳林的恢复
-
1.6.1.7.1一、 背景
-
1.6.1.7.2二、 恢复目标
-
1.6.1.7.3三、恢复过程
-
1.6.1.7.4案例分析
-
1.6.1.7.5思考题
-
1.6.1.7.6拓展阅读资料
-
1.6.1.8第八节 索饵场、越冬场、产卵场和洄游通道的恢复
-
1.6.1.8.1一、 洄游通道的恢复
-
1.6.1.8.2二、 产卵场的恢复
-
1.6.1.8.3三、 我国长江口的恢复
-
1.6.1.8.4案例分析
-
1.6.1.8.5思考题
-
1.6.1.8.6拓展阅读资料
-
1.6.1.9第九节 珊瑚礁的恢复
-
1.6.1.9.1一、 背景
-
1.6.1.9.2二、 恢复目标
-
1.6.1.9.3三、 恢复措施
-
1.6.1.9.4四、珊瑚礁保护与管理的两个实例
-
1.6.1.9.5案例分析
-
1.6.1.9.6思考题
-
1.6.1.9.7拓展阅读资料
-
1.6.2第十五章 典型海洋环境污染区的恢复
-
1.6.2.1第一节 油污区的恢复
-
1.6.2.1.1一、 背景
-
1.6.2.1.2二、 美国墨西哥湾溢油事故
-
1.6.2.1.3案例分析
-
1.6.2.1.4思考题
-
1.6.2.1.5拓展阅读资料
-
1.6.2.2第二节 重金属污染区的恢复
-
1.6.2.2.1一、水俣湾汞污染事故
-
1.6.2.2.2二、水俣湾汞污染区的恢复
-
1.6.2.2.3案例分析
-
1.6.2.2.4思考题
-
1.6.2.2.5拓展阅读资料
-
1.6.3第十六章 典型海洋生态灾害发生区的恢复
-
1.6.3.1第一节 赤 潮
-
1.6.3.1.1一、 赤潮的定义
-
1.6.3.1.2二、 赤潮的危害
-
1.6.3.1.3三、赤潮发生海区恢复的目标
-
1.6.3.1.4四、赤潮发生海区恢复的策略
-
1.6.3.1.5思考题
-
1.6.3.2第二节 绿 潮
-
1.6.3.2.1一、绿潮的定义
-
1.6.3.2.2二、 世界范围的绿潮
-
1.6.3.2.3三、绿潮的危害
-
1.6.3.2.4四、绿潮暴发的机制
-
1.6.3.2.5五、绿潮的治理
-
1.6.3.2.6思考题
-
1.6.3.3第三节 褐 潮
-
1.6.3.3.1一、 褐潮暴发的概况
-
1.6.3.3.2二、褐潮的危害
-
1.6.3.3.3三、褐潮的防治
-
1.6.3.3.4思考题
-
1.6.3.4第四节 大型海藻对海水富营养区的治理
-
1.6.3.4.1一、 背景
-
1.6.3.4.2二、 恢复目标
-
1.6.3.4.3三、恢复过程
-
1.6.3.4.4案例分析
-
1.6.3.4.5拓展阅读资料
-
1.6.4参考文献
1
海洋恢复生态学