-
1.1前 言
-
1.2脑的结构
-
1.2.1端 脑
-
1.2.2间 脑
-
1.2.3海 马
-
1.2.4脑 干
-
1.2.5小 脑
-
1.2.6白质和灰质
-
1.2.7脑脊液
-
1.2.8硬膜、蛛网膜和软膜
-
1.2.9脑垂体
-
1.3脑的功能
-
1.3.1脑的四大功能
-
1.3.2脑的神经传导经
-
1.4脑的发育
-
1.4.1出生前的大脑发育
-
1.4.2出生后的大脑发育
-
1.5神经系统的结构与功能
-
1.5.1神经元
-
1.5.2胞 体
-
1.5.3突 起
-
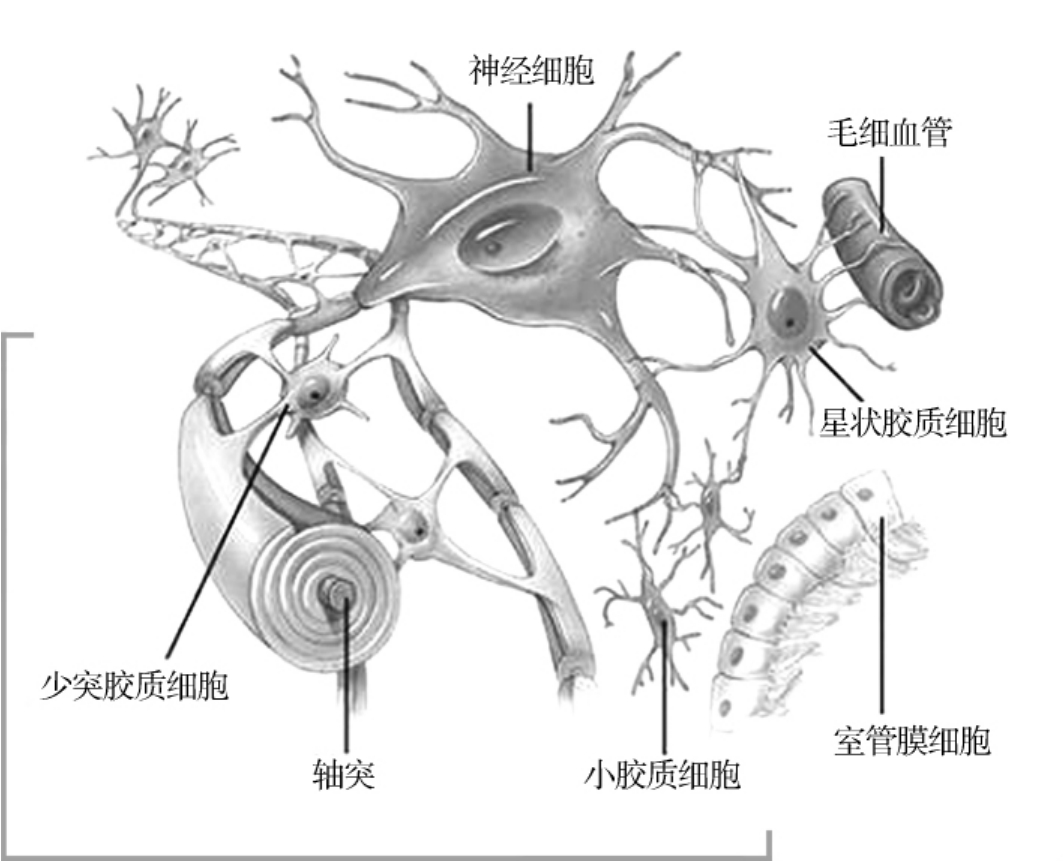
1.5.4神经胶质细胞
-
1.5.5脊 髓
-
1.5.6神经核团
-
1.5.7髓 鞘
-
1.5.8神经节
-
1.5.9神经递质
-
1.6神经回路的构建
-
1.6.1生长轴突的运动
-
1.6.2神经元的作用
-
1.7神经细胞与兴奋的传播
-
1.7.1细胞学说与神经元学说
-
1.7.2兴奋的传导
-
1.8大脑左右半球的差异
-
1.8.1解剖方面的差别
-
1.8.2左右利手大脑皮层的差别
-
1.9大脑左右半球功能性别差异
-
1.9.1胎儿期性激素的作用
-
1.9.2出生后性激素的作用
-
1.9.3大脑皮层组织作用
-
1.10脑的习性
-
1.10.1避免脑疾病
-
1.10.2避免用脑过度
-
1.10.3科学用脑
-
1.11脑的营养需求
-
1.11.1有助增强记忆的食物
-
1.11.2健脑食物
-
1.12脑的感觉功能
-
1.12.1躯体感觉
-
1.12.2痛 觉
-
1.12.3视 觉
-
1.12.4听 觉
-
1.12.5嗅 觉
-
1.12.6味 觉
-
1.13脑的认知功能
-
1.13.1联络皮层
-
1.13.2顶叶与注意
-
1.13.3颞叶与辨认
-
1.13.4额叶与设计
-
1.14躯体运动功能
-
1.14.1人体躯干感觉的传导通路
-
1.14.2视觉和听觉的传导通路
-
1.14.3大脑皮层对躯体运动的调节
-
1.15脑是怎样指挥运动的
-
1.15.1大脑皮层的运动管理区
-
1.15.2脊髓的运动反射
-
1.16脑是怎样思维的
-
1.16.1大脑皮层——大脑的思维器官
-
1.16.2神经递质的活动
-
1.16.3脑体积与智力的关系
-
1.16.4脑体积与智力的关系
-
1.17语言与左右大脑功能的关系
-
1.17.1语言的左脑倾向化
-
1.17.2用手左利、右利与语言的侧向化
-
1.18大脑记忆之谜
-
1.18.1记忆机理
-
1.18.2记忆分类
-
1.18.3记忆之谜
-
1.18.4记忆功能区——海马区
-
1.19睡眠的秘密
-
1.19.1睡眠是脑和身体的休息
-
1.19.2REM睡眠和非REM睡眠
-
1.19.3睡姿问题
-
1.19.4失眠的原因
-
1.20梦的奥秘
-
1.20.1睡眠脑电
-
1.20.2REM睡眠
-
1.20.3弗洛伊德的“潜意识”
-
1.21音乐对脑的调整作用
-
1.21.1重视音乐对脑的开发作用
-
1.21.2开发“音乐脑”
-
1.22情绪与脑的关系
-
1.22.1情绪反应与脑
-
1.22.2杏仁与恐惧
-
1.22.3中脑边缘投射与愉快
-
1.22.4狂躁症与中脑—边缘投射
-
1.22.5新皮层与情绪
-
1.23左脑型智慧
-
1.23.1左脑优势型
-
1.23.2左脑、双前脑优势型
-
1.23.3左脑、双后脑优势型
-
1.23.4左脑、左前右后脑优势型
-
1.23.5左脑、右前左后脑优势型
-
1.23.6左脑、双前脑、右前左后脑优势型
-
1.23.7左脑、双后脑、左前右后脑优势型
-
1.24右脑型智慧
-
1.24.1右脑优势型
-
1.24.2右脑、双前脑优势型
-
1.24.3右脑、双后脑优势型
-
1.24.4右脑、左前右后脑优势型
-
1.24.5右脑、右前左后脑优势型
-
1.24.6右脑、双前脑、左前右后脑优势型
-
1.24.7右脑、双后脑、右前左后脑优势型
-
1.25全脑型智慧
-
1.25.1全脑优势型
-
1.25.2全脑、双前脑优势型
-
1.25.3全脑、双后脑优势型
-
1.25.4全脑、左前右后脑优势型
-
1.25.5全脑、双前脑、左前右后脑优势型
-
1.25.6全脑、双前脑、右前左后脑优势型
-
1.25.7全脑、双后脑、左前右后脑优势型
-
1.25.8全脑、双后脑、右前左后脑优势型
-
1.26移植智慧
-
1.26.1“拷贝”知识
-
1.26.2“移植”记忆
-
1.27大脑潜能开发
-
1.27.1大脑潜能开发的意义
-
1.27.2大脑的九大潜能
-
1.27.3积极激发大脑的潜能
-
1.28大脑的后天开发
-
1.28.1智力的后天可塑性
-
1.28.2情感支配智力
-
1.29大脑病变
-
1.29.1老年痴呆
-
1.29.2舞蹈病
-
1.29.3帕金森病
-
1.29.4截 瘫
-
1.29.5脑卒中、脑血管硬化
1
人类大脑探秘