-
1.1前 言
-
1.2神奇有趣的气体
-
1.2.1可以“分割”的空气
-
1.2.2地球的“棉被”——大气中的二氧化碳
-
1.2.3让人爱恨交加的臭氧
-
1.2.4世界上最轻的气体——氢
-
1.2.5世界上最重的气体——氡
-
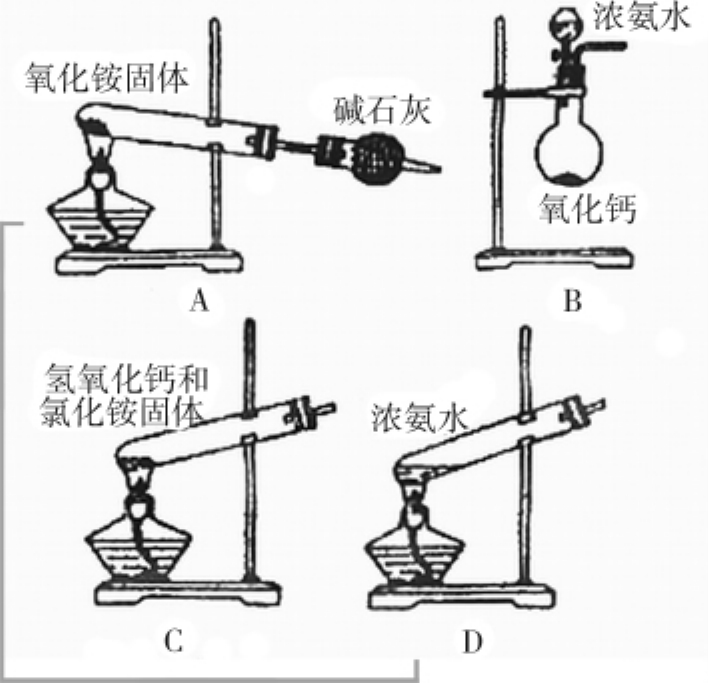
1.2.6在水中溶解度最大的气体——氨
-
1.2.7令人发笑的气体
-
1.3奇妙的地球血液
-
1.3.1揭开水的神秘面纱
-
1.3.2最受青睐的饮用水——人造纯水
-
1.3.3死海的故事
-
1.3.4美丽的“水中花园”
-
1.3.5黑兽口湖之谜
-
1.3.6地球最迷人的七大温泉
-
1.3.7神奇的泉水
-
1.3.8海洋探宝——化学家的新天地
-
1.3.9河口化学——从三角洲想到的一门新兴学科
-
1.3.10晶体世界寻宝
-
1.3.11宝石为什么绚丽多彩
-
1.3.12石英中的皇后——水晶
-
1.3.13金刚石与它的“孪生兄弟”石墨
-
1.3.14石墨粉里“飞”出金刚石
-
1.3.15人们眼中的“晶体”——玻璃
-
1.3.16晶洞奇观
-
1.3.17是谁造出的“仙境”
-
1.3.18奇特的显示材料——液晶
-
1.3.19金属王国猎奇
-
1.3.20古老而又年轻的金属——铁
-
1.3.21古剑不锈之谜
-
1.3.22锅中奇才——不锈钢
-
1.3.23战略金属“铝”建奇功
-
1.3.2421世纪的金属——钛
-
1.3.25液态金属
-
1.3.26奇妙的银器
-
1.3.27有记忆能力的金属——记忆合金
-
1.3.28“烈火金刚”与“抗蚀冠军”——铌与钽
-
1.3.29稀散三元素——镓、铟、铊
-
1.3.30稀土“十七姊妹”——稀土金属
-
1.4化学元素奇观
-
1.4.1化学元素之最
-
1.4.2化学元素与生命
-
1.4.3人工合成化学元素历史
-
1.4.4铀不是最后的元素
-
1.4.5化学元素知多少——元素周期表展望
-
1.4.6化学材料奇观
-
1.4.7塑料之王世界上最滑的材料——聚四氟乙烯
-
1.4.8塑料金花——功能塑料
-
1.4.9吸水大王——高分子吸水剂
-
1.4.10弹性之王——橡胶
-
1.4.11现代魔术师——黏合剂
-
1.4.12建材奇葩
-
1.4.13羊毛并不出在羊身上
-
1.4.14合成纤维的先驱——尼龙
-
1.5化学应用奇观
-
1.5.1空战中的“不速之客”
-
1.5.2“凯芙拉”从军记
-
1.5.3遨游大海,梦想成真——人工鳃的产生
-
1.5.4永不生病的内脏——人工肾、肝、肺
-
1.5.5开创医学的新纪元——分子病的医治
-
1.5.6真正的“万能血”——人造血
-
1.5.71000亿个神经细胞——大脑的化学世界
-
1.5.8蓝色维他命——空气负离子
-
1.5.9再造“太阳”——受控热核反应
-
1.5.10土卫六极可能孕育生命
-
1.6化学武器种种
-
1.6.1恐怖的化学武器
-
1.6.2“毒气之王”芥子气与它的弟兄们
-
1.6.3“催泪大王”——苯氯乙酮
-
1.6.4“速效喷嚏粉”——亚当氏剂
-
1.6.5“带水果香味的闪电杀手”——沙林
-
1.6.6令人头疼的“梭曼”
-
1.6.7新毒王“青出于蓝”,老毒物“青春焕发”
-
1.6.8新概念化学武器
-
1.6.9二元化学武器
1
化学世界奇观