1.9 Composition, Structure and Performance of Materials材料的组成、结构与性能
1.9.1 Composition of materials材料的组成
材料通常都是由原子或分子结合而成的,也可以说是由各种元素组成的。
按原子或分子的结合与结构分布状态的不同,材料的组成可分成固溶体(Solidsolution)、聚集体(Congeriesor Agglomerate)和复合体(Composites)三大类。
材料组元的结合形式: 组元(constituent)、相(phase)和组织(tissue)。
Constituentis the basic, independent substance, or component. The component may be pureelement, is also stable compound.
组元(Constituent):是组成材料最基本、独立的物质,或者叫组分(component)。组分可以是纯元素,也可以是稳定的化合物。金属材料的组分多为纯元素(如普通碳钢的组分是Fe与 C),陶瓷材料的组分多为化合物(如Y2O3-ZrO2陶瓷的组分是Y2O3和ZrO2)。
相(Phase):材料中具有同一化学成分并且结构相同,物理性质和化学性质完全均一稳定的部分。相与相之间有明显的界面,可以用机械的方法把他们分离开。在界面上,从宏观的角度来看,性质的改变是突变的。从晶体几何学的观点看,界面是三维晶格周期性排列从一种规律转变为另一种规律的几何分界面。从物理化学角度看,界面是指任意两相之间的接触面或交界区。根据相的不同,可以有固—固、固—液、固—气、液—液、液—气五种界面。一个相必须在物理性质和化学性质上都是完全均匀的,但不一定只含有一种物质。例如:纯金属是单相材料,钢在室温下由铁素体(含碳的-Fe)和渗碳体(化合物,Fe3C)组成,普通陶瓷由晶相和玻璃相组成。--Interface & Surface
组织(Tissue):材料内部的微观形貌。组织是与相有密切联系的概念,它实际上是指由各个晶粒或各种相所形成的图案。材料的组织分为微观组织和宏观组织。微观组织也叫微细组织、显微组织。微观组织又分为晶体结构与非晶态(无定形Amorphous)结构。具体分类与实例见表1.1。
材料的组织结构(Tissue structure):是指材料的组成单元(原子、分子或离子)之间相互吸引和排斥作用达到平衡时的空间排布。从宏观到微观可分成不同的层次,即宏观组织结构、显微组织结构及微观结构。
宏观组织结构(Macroscopic tissue structure):是用肉眼、放大镜可以观测到的粗大组织,如晶粒、相的集合状态。有时是指用放大倍数为20-100倍以下的放大镜可以观察到的组织,可以分为单一组织和复合组织,这些组织又可进一步细分。
显微组织结构(Submicroscopic structure):也叫亚微观结构,是借助于光学显微镜、电子显微镜可观察到的晶粒、相的集合状态。10-7~10-4m
微观结构(Microscopic structure):包括原子、分子的结构及它们之间的排列结构。

固溶体 (Solid solution)
溶体:两种以上的原子或分子溶合在一起时的状态。溶体一般是原子或分子的均匀混合物,不是化合物。
固溶体:液体溶体称为溶液(Solution),而固态的溶体(呈现固体状态的溶体),即溶质(Solute)组元溶入溶剂组元的晶格(Lattice)中所形成的单相固体称为固溶体。Alloy(合金) and Pottery(陶瓷)中有不少是固溶体。固溶体的结构保持溶剂组元(Solvent constituent)的晶格类型。例如:C溶入α-Fe为基体的固溶体,该固溶体的晶格与α-Fe相同,仍为体心立方结构(Body-centered cubicstructure)。
按照溶质原子在溶剂晶格中的位置不同,固溶体可分成两种:
¡置换型固溶体(或称取代型固溶体)(Substitutional solid-solution):溶剂A晶格中的原子被溶质B的原子取代所形成的固溶体。这时,原子B的大小要与原子A的大小大致相同。例如普碳钢中,Mn原子在 α-Fe中是取代固溶。
¡填隙型固溶体(也称间隙型固溶体)(Interstitial solid-solution):在溶剂A的晶格间隙内有溶质B的溶入所形成的固溶体。这时,填入的B原子必须是足够小的。如C和N是典型的溶质原子。
对一种晶体,可同时存在这两种形式的固溶体,还以普碳钢为例,Mn原子在α-Fe中是取代固溶,而C原子是填隙固溶。
固溶体的性能变化:与纯金属相比,合金固溶体的物理、化学性能都发生了不同程度的变化。首先,一个重要的现象是固溶强化,即由于溶质原子的溶入,固溶体的强度和硬度都要比纯合金时高。其次,不少固溶元素可以明显地改变基体的物理和化学性能,如Si溶入α-Fe中可以提高磁导率,增大比电阻,故含2%-4%Si的硅钢片是一种应用广泛的软磁材料。
聚集体(Aggregate , Congeries or Agglomerate)
是由无数的原子或晶粒聚集而成的固体,一般金属材料或无机非金属材料都是聚集体。它的范围要比固溶体大。石棉(Asbestos)和云母(Mica)是聚集体,纯金属一般可把它看成是微细晶体的聚集体;而合金可看作是母相金属原子的晶体与加入的合金晶体聚合而成的聚集体。晶粒间的结合力要比晶粒内部的结合力小。
复合体(Composites)
复合体(复合材料)是指由两种或两种以上的不同材料通过一定方式复合而成的新型材料,各相之间存在着明显的界面。
复合材料的结构通常是一个相为连续相,称为基体材料(Matrix);而另一相是不连续的,以独立的形态分布于整个连续相中,称为分散相。与连续相相比,这种分散相的性能优越,会使材料的性能显著增强,故常称为增强材料();而另一相是不连续的,以独立的形态分布于整个连续相中,称为分散相。与连续相相比,这种分散相的性能优越,会使材料的性能显著增强,故常称为增强材料(Reinforcement)。材料增强的种类有颗粒增强、晶须和纤维增强、层板复合等。
目前复合材料已成为材料大家族中发展最为迅猛、应用更为广泛的后起之秀。
1.9.2 Chemical Composition of Materials材料的化学组成
1.9.2.1Chemical composition of metallic materials
金属材料的化学组成
金属材料包括纯金属和以金属为基础所构成的合金。金属材料的特点是具有其它材料无法取代的强度(Strength)、塑性(Plasticity)、韧性(Toughness)、导热性(Heat conductivity)、导电性(Conductivity)以及良好的可加工性(better processing)。
(1)单质金属(Pure metal) 金属是指元素周期表中的金属元素,存
在于自然界的94种元素中,有72种是金属元素。大多数是以过渡金
属为中心的纯金属状态使用。一般是从含金属元素的天然矿物中冶
炼出来,然后再用电冶、电解等方法提纯后使用。工业上习惯分为
黑色金属(Black metal)和有色金属(Colored metal)两大类。铁
(Iron)、铬(Chromium)、锰(Manganese)属于黑色金属。其余的所有
金属都属于有色金属。有色金属又分为重金属(Heavy metal)、轻金
属(Light metal)、贵金属(Noble/Precious metal)和稀有金属(Rare
metal)4类。
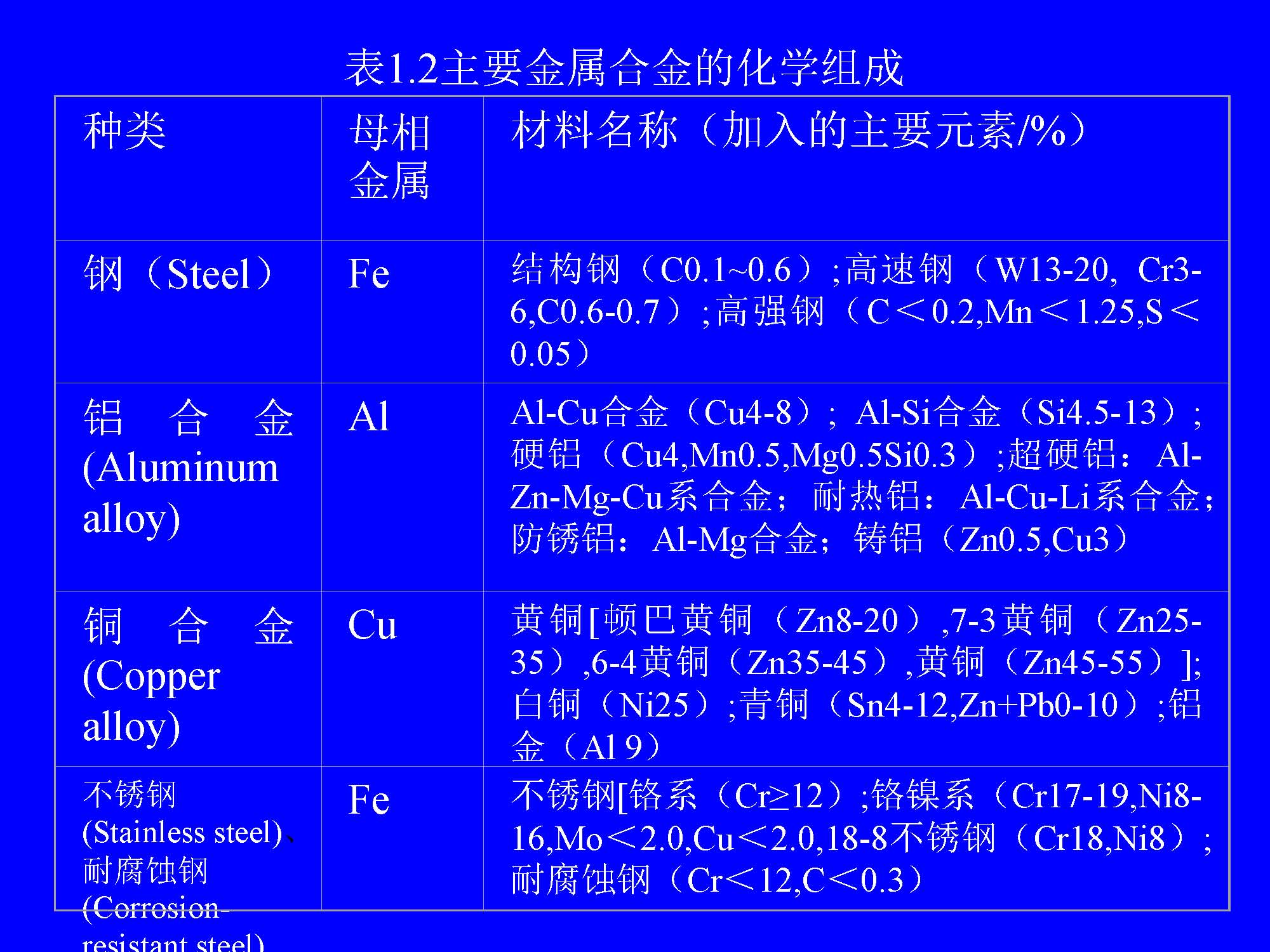
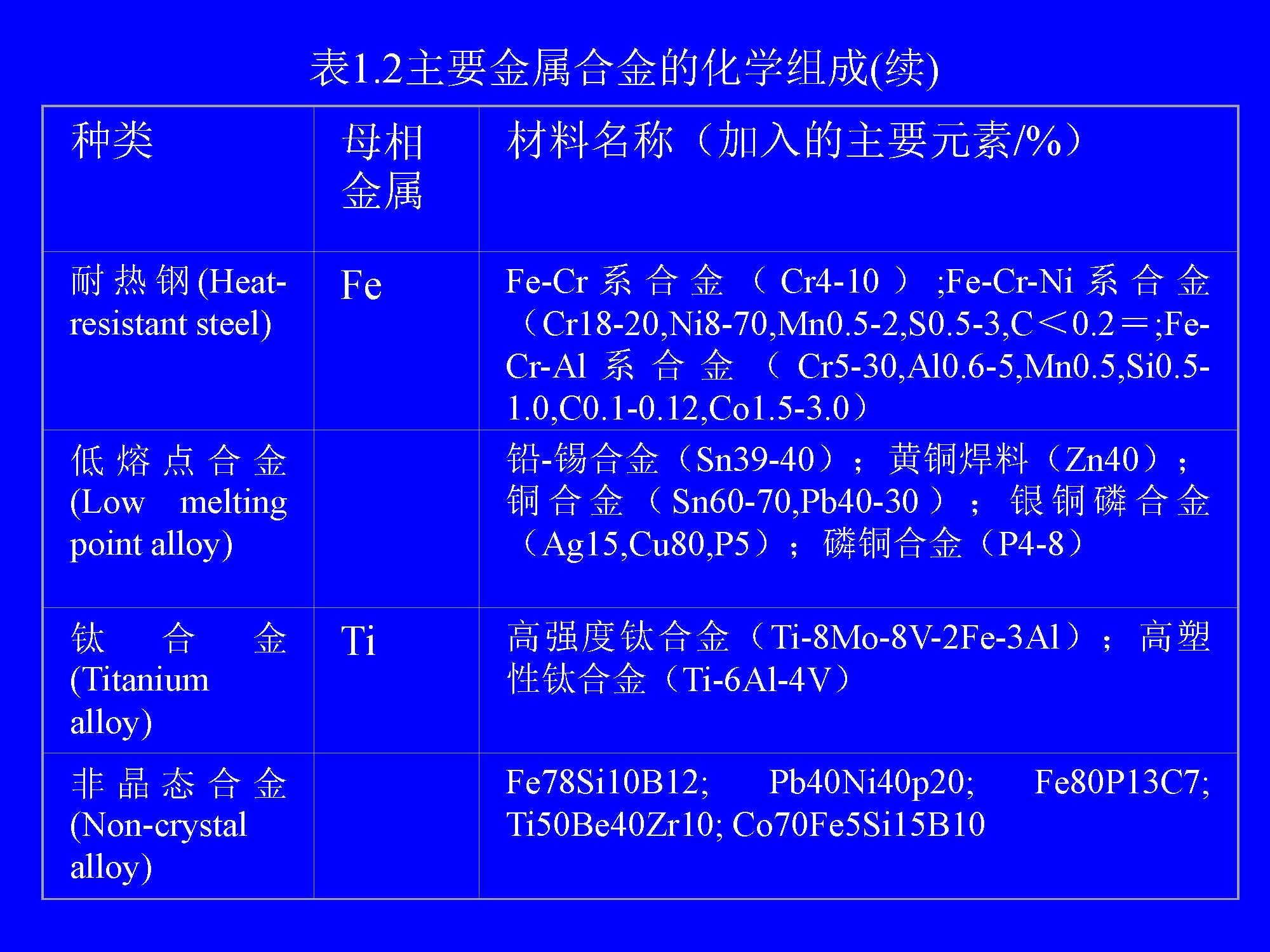
(2)金属合金(Alloy) 金属合金是指由两种或两种以上的金属元素或金属元素与非金属元素构成的具有金属性质的物质。由两种元素构成的合金叫二元合金,由三种元素构成的合金叫三元合金。表1.2列出了主要金属合金的化学组成。他们一般都是多晶体。合金有时可以形成固溶体、共溶晶、金属间化合物以及它们的聚集体。非晶态合金具有许多优异性能,如强韧性、抗侵蚀、高磁导率、超导性等。
1.9.2.2 Chemical composition of Inorganic non-metallicmaterials
无机非金属材料的化学组成
无机非金属材料包括陶器(pottery)、瓷器(china)、耐火材料(refractories)、粘土制品(clay)、搪瓷(porcelain)、玻璃和水泥(cement)等材料。陶瓷是无机非金属材料的主体,现在不少西方国家,陶瓷已是各种无机非金属材料的通称,同金属材料和高分子材料一起成为现代工程材料的三大支柱。
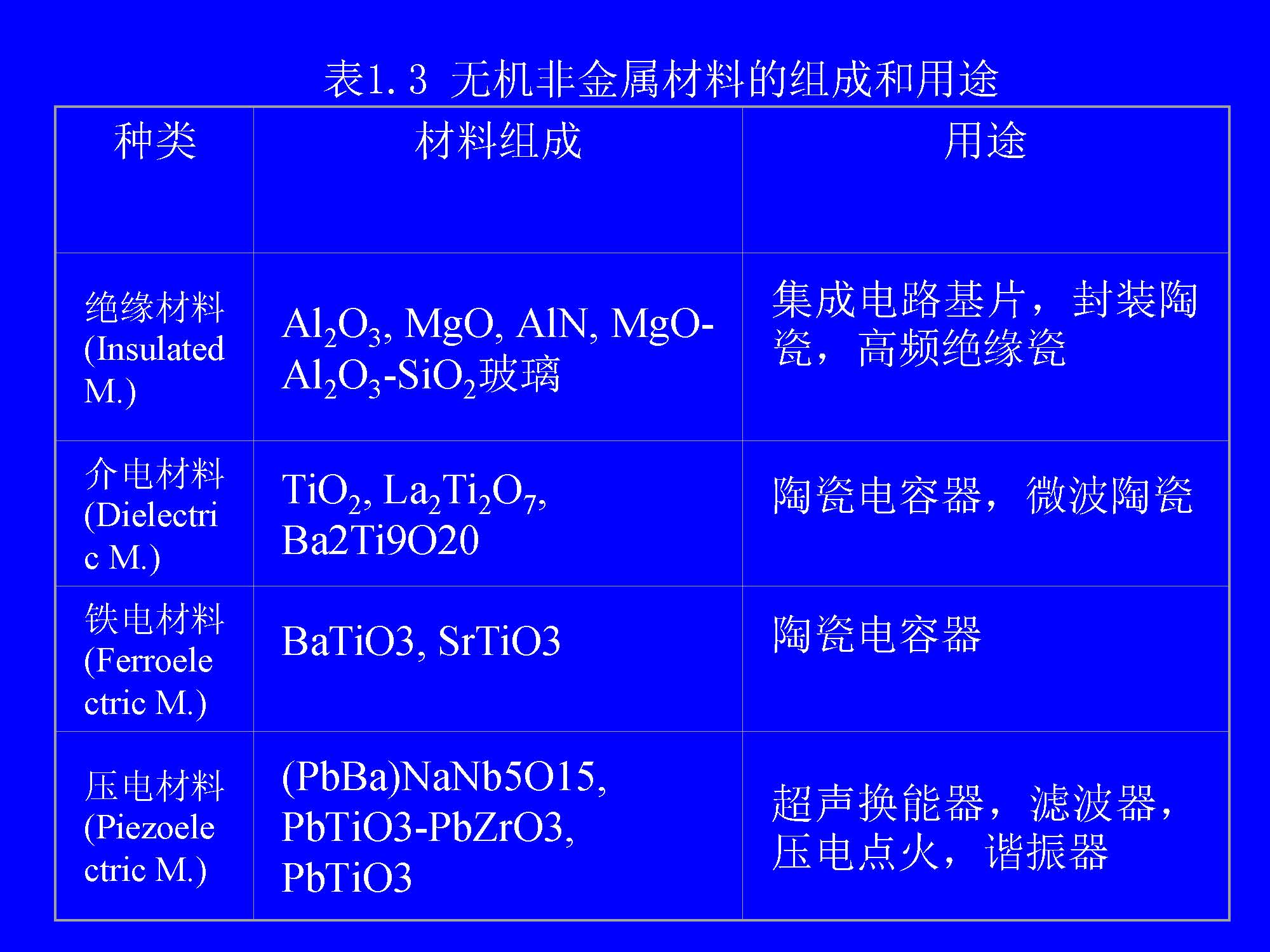
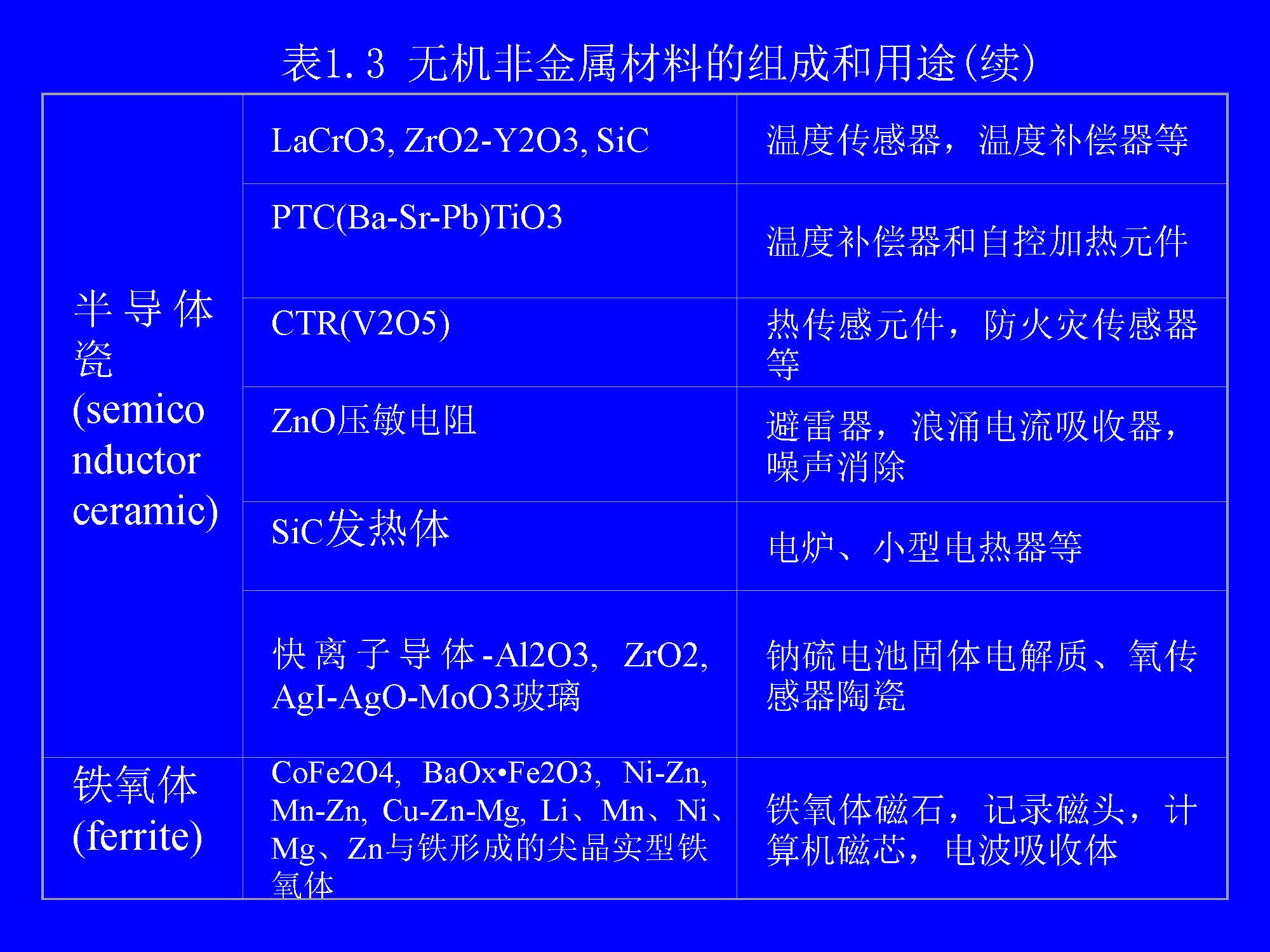
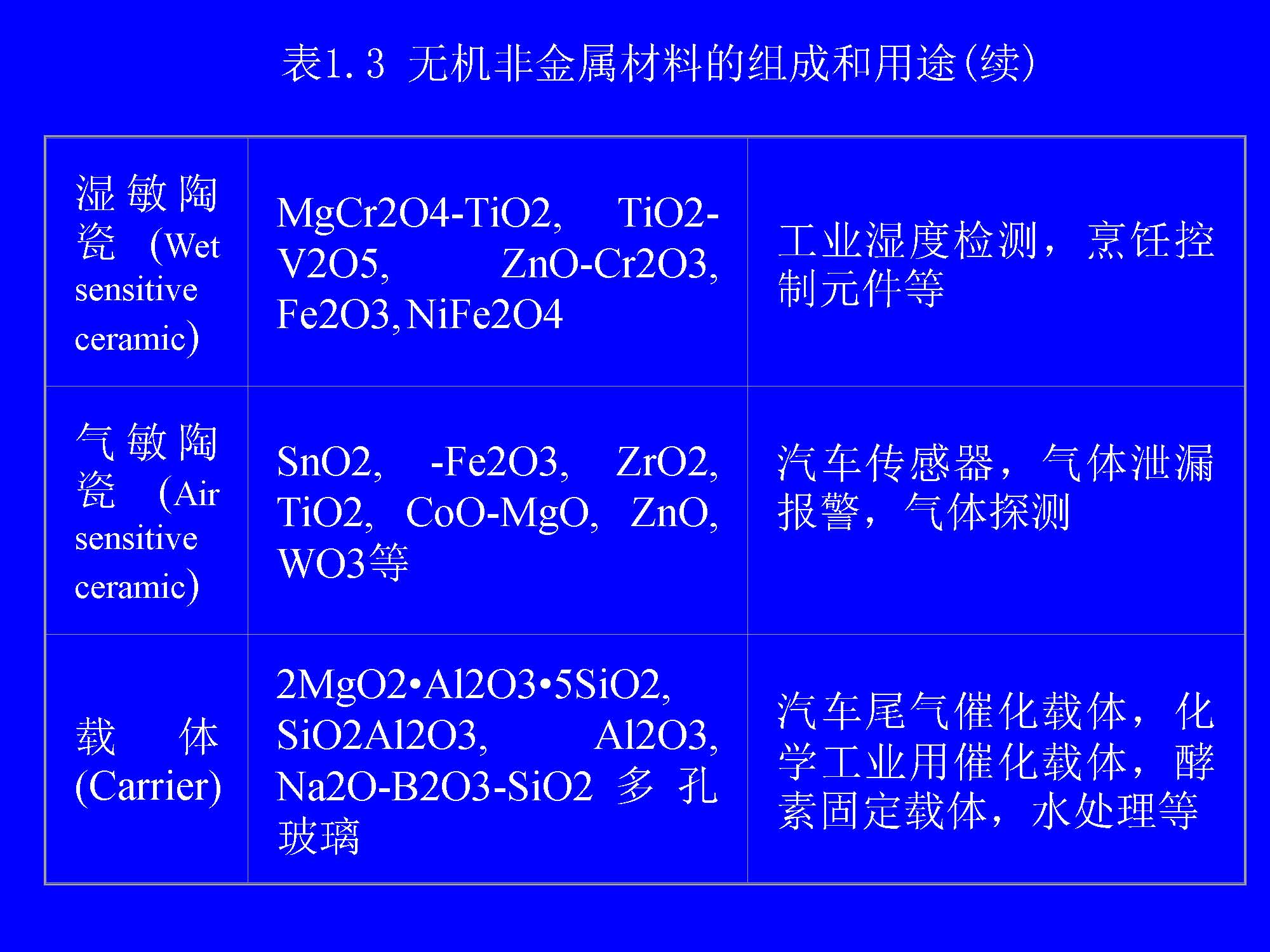
从化学的角度来看,无机非金属材料都是由金属元素和非金属元素的化合物经一定工艺过程制得的。表1.3列出了一些具有代表性的无机非金属材料的组成和用途。


1.9.2.3 高分子材料的化学组成
有机化合物简单地称为碳氢化合物,是以碳元素(C)为主,大多数是同氢元素(H)、氧元素中的任意一种或两种以上结合而成的,此外,也有同氮(N)、硫(S)、磷(P)、氯(Cl)、氟(F)、硅(Si)等结合构成。尽管构成有机化合物的成分元素种类为数不多,但由它们组合起来可以形成组成、结构不同的数量庞大的各种化合物,其数量与日俱增。
高分子化合物主要是指相对分子量特别大的有机化合物,其特点是:①相对分子量通常在10000以上,而低分子化合物的相对分子量一般小于500,具有多分散性(分子量的不均一性);②高分子化合物的另一个特点是完全链中不含离子键和金属键。
高分子材料根据其来源不同,可分为天然高分子材料(如木材,皮革,天然纤维,天然橡胶)与合成高分子材料(如各种塑料,合成橡胶,合成纤维等)。
基本概念:
单体(Monomer):可以聚合成高分子化合物的低分子化合物称为单体。单体是合成聚合物的原料。
聚合度(Degree of Polymerization,DP):高分子化合物中重复单元数。
∴聚合物的分子量M=DP·M0
M0是重复单元的分子量
1.9.3 材料中的化学键合 (ChemicalBonding)
几乎所有的元素都能以一定的结合方式构成物质。同一种或不同种类的原子通过化学键(金属键、共价键、离子键)结合在一起构成物质的分子。实际上,许多材料可同时兼有几种键。
(1)金属键(Metallic bond):金属原子形成金属晶体时,每个原子都提供少数价电子作为自由电子共用,这种自由电子构成金属键。其结构特点是无饱和性和方向性,配位数(Coordination number)很高,高密度。金属导电、传热都是金属中自由电子运动的结果。

(3)离子键(Ionic bond):阳离子与阴离子之间的相互吸引力(库仑引力)所形成的一种键合,它本质上完全归结于静电引力(electrostaticeffect) 。
典型:NaCl、MgO——AB型,构成固体无机化合物。
CaF2(莹石),TiO2(Titaniumdioxide金红石)——AB2、BiF3(Bismuth Fluoride)——AB3
α—Al2O3(Aluminumoxide刚玉)——A2B3
FeTiO3 (IronTitanate)、CaTiO3 ——ABO3型
石膏(CaSO4)、BaSO4(Barium sulfate)——ABO4
尖晶石(Spinel, Al2MgO4)——A2BO4
以上都是离子键化合物
(4)氢键(Hydrogen Bond):
H…A(N、O、F)
是H原子与原子A结合时,还能形成与另一个原子B的附加键。
常见的:H2O、HF (Hydrogen fluoride)、NH3 (Hydrogennitride)和许多高分子化合物(纤维素)
(5)范德华键(Van der Waals Bond):分子之间的作用力,是分子与分子之间一种相互吸引力。
例子:固态惰性气体。


