一、细胞凋亡的概述
细胞凋亡是体内外因素触发细胞内预存的死亡程序而导致的细胞死亡过程,为程序性细胞死亡(programmed cell death, PCD)的形式之一。
细胞凋亡与细胞坏死在许多方面存在显著差异:
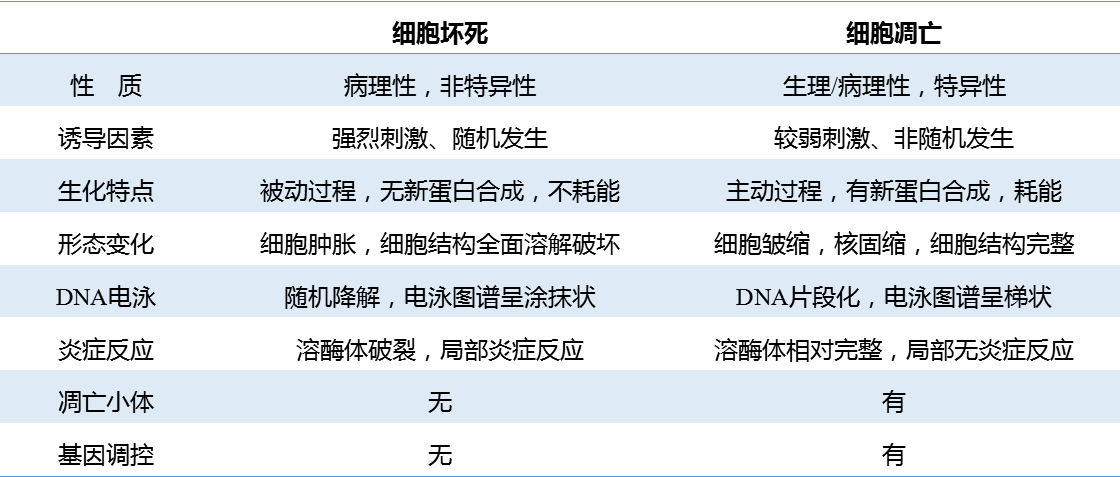
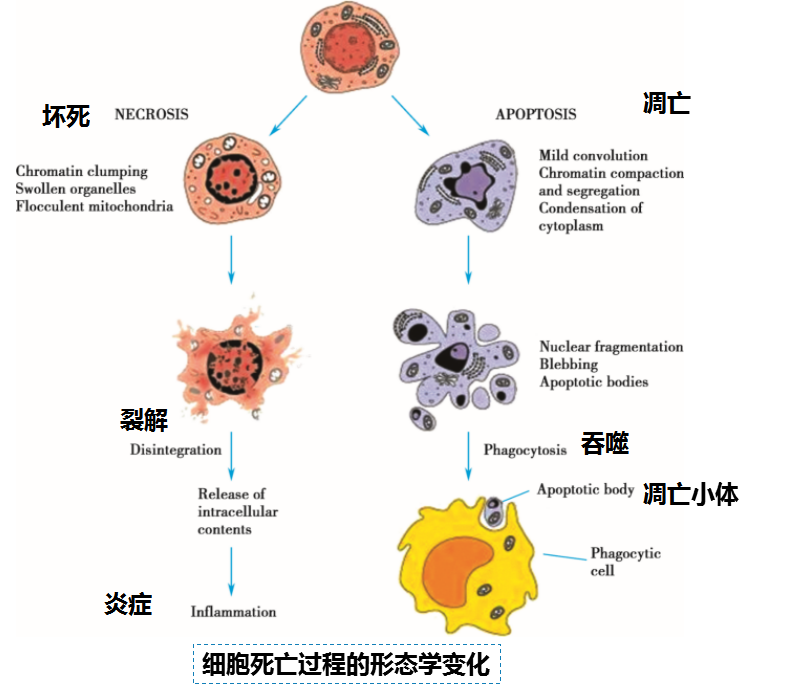
凋亡是多因素、多阶段和多基因严格控制的过程:
如在诱导凋亡相关因素(射线、高温、TNF、细菌和病毒等)作用下启动信号转导,凋亡相关基因接受死亡信号后按预定程序启动合成执行凋亡所需的多种酶,这些酶如核酸内切酶( endogenous nuclease)和半胱天冬酶( caspase)家族通过级联反应等降解底物,导致细胞呈现凋亡特征性的形态(如凋亡小体)和生化(如“梯”状条带)改变。
二、细胞凋亡的调控
细胞凋亡调控涉及调亡相关信号及其转导通路、基因和酶的调控。
1. 细胞凋亡调控相关的信号
(1)生理性凋亡相关信号
某些激素和细胞因子的直接作用:
糖皮质激素 → 淋巴细胞凋亡
甲状腺素→蝌蚪尾巴凋亡性退化
TNF → 多种细胞凋亡
某些激素和细胞因子的间接作用:
睾丸组织发育不良→睾酮不足→前列腺上皮细胞凋亡
(2)病理性凋亡相关信号
生物及射线、化学毒素、病毒感染、应激、化疗药等,甚至营养元素缺乏和过度功能负荷都可诱导凋亡;
化学促癌物、某些病毒(EB病毒)等抑制凋亡。
能否诱导细胞凋亡与有害因素的种类、强度和持续时间等相关。
2. 细胞凋亡调控相关的信号转导通路
细胞凋亡过程受细胞内外多种信号的调控。
死亡受体和线粒体介导的信号转导通路为细胞凋亡调控的两条经典信号转导通路,在细胞凋亡中发挥重要作用。
此外,内质网应激及颗粒酶B途径也可介导细胞凋亡。
越来越多的研究证明线粒体在细胞凋亡的过程中发挥着不可替代的作用,是调控细胞凋亡的重要细胞器。
(1)死亡受体介导的凋亡通路
死亡受体属于肿瘤坏死因子受体( tumor necrosis factor receptor,TNFR)超家族,在传递特异性的死亡配体如Fas配体(Fas ligand,FasL)和TNF-α等启动的信号中占有重要地位。
目前在哺乳类细胞上至少已发现8种死亡受体,包括TNFR1、Fas、DR3-6、EDA-R和NGF-R。死亡受体的胞质区内含有一个同源结 构“死亡结构域”( death domain,DD) 。
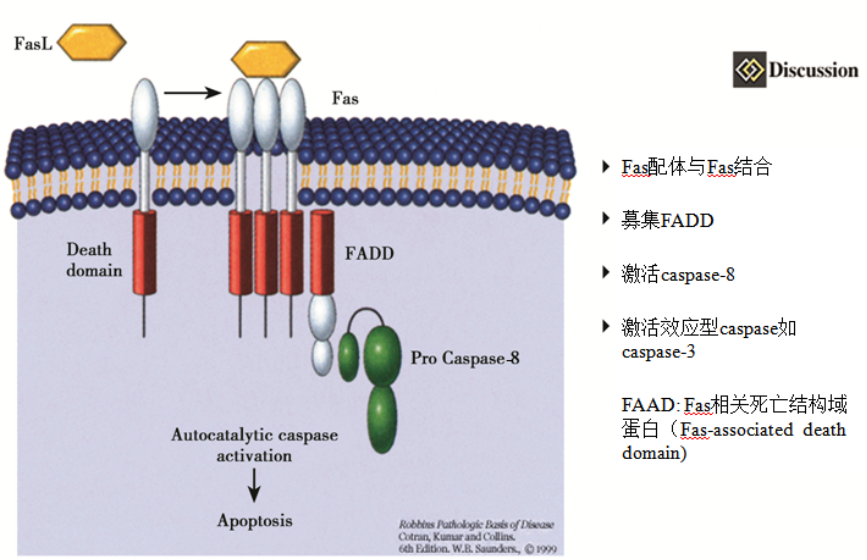
死亡受体介导的凋亡通路
(2)线粒体介导的凋亡通路
即死亡受体非依赖的凋亡通路,是细胞凋亡信号转导途径中较重要的途径之一。
该通路主要涉及位于线粒体内促凋亡蛋白的异位,也有实验结果提及涉及CED-4/CED-3样“凋亡体"的参与。
许多凋亡诱导信号如射线、化疗药和氧化应激及钙稳态失衡等可作用于线粒体膜,使其跨膜电位(Δψm)明显下降和膜转换孔开放,导致线粒体膜通透性增高,促使线粒体内凋亡启动因子(如Cyto-C、AIF和Apaf-1等)释放至胞质;
Cyto-C与Apaf-1 及caspase-9前体( pro-caspase-9)结合形成凋亡复合体→caspase-9前体激活→激活下游caspase-3、6和7前体→细胞DNA修复功能丧失、核酸内切酶激活和DNA片段化等细胞凋亡改变。
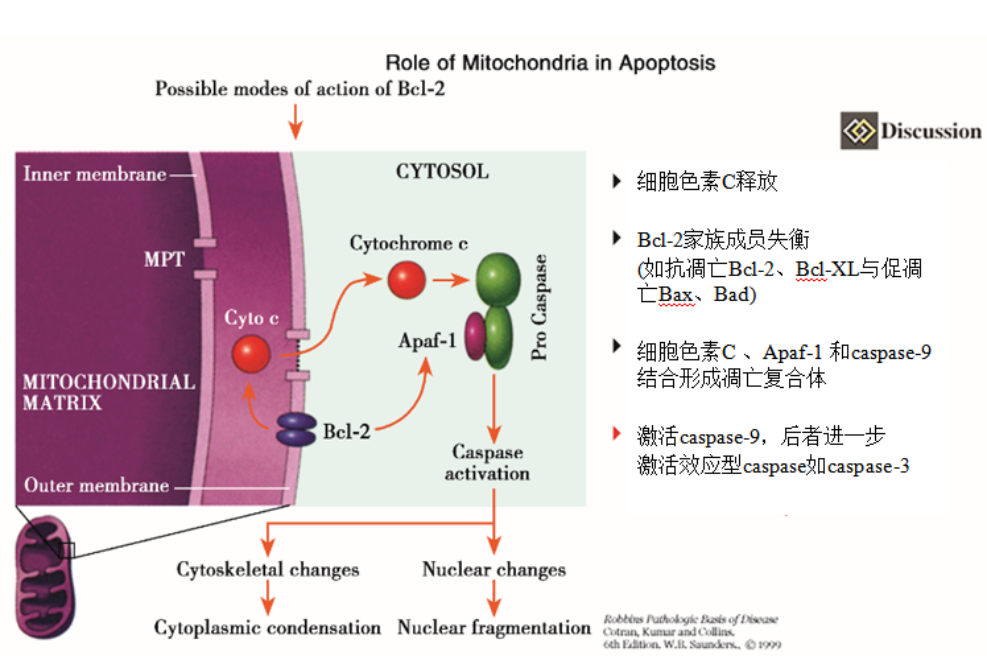
线粒体介导的凋亡通路
(3)内质网应激介导的凋亡通路
在氧化应激或钙失衡等特定生理病理情况下,可引起内质网腔内未折叠蛋白或者错误折叠蛋白蓄积,称为未折叠蛋白反应( UPR)。
适度或者短暂的内质网应激在未折叠蛋白反应作用下,可以下调并维持内质网功能稳定;
如果细胞处于长期持续的内质网应激状态时,可以通过内质网跨膜蛋白肌醇需求酶( IRE1a)介导的信号通路的激活,或通过蛋白激酶样内质网激酶(PERK)依赖的信号传导引起细胞凋亡。
因此内质网应激与很多因素所致疾病的发生、发展密切相关,如神经系统退行性疾病、病毒感染性疾病和糖尿病等。
3. 细胞凋亡调控相关的基因
(1)Bcl-2家族
根据Bcl-2家族成员在细胞调亡中的作用可分为两类:
一类是抗凋亡成员(如Bcl-2和Bcl-XL);
另-类是促凋亡成员(如Bax和Bak),包括BH3 -only蛋白(表11-4)
它们相互作用决定了细胞死亡的阈值。

Bcl-2是B淋巴细胞瘤白血病-2基因的缩写形式,是第一个被确认为有抑制凋亡作用的基因。
经研究证实Bcl-2蛋白广泛存在于造血细胞、上皮细胞、淋巴细胞神经细胞和多种肿瘤细胞,主要分布在线粒体内膜、细胞膜内表面、内质网和核膜等处。
人Bcl-2蛋白可阻抑多种因素(如射线和化学药物等)诱导的细胞凋亡。
(2)p53
野生型p53蛋白具有诱导细胞凋亡及抑制细胞增殖的作用。
野生型p53蛋白是一种负调控因子,主要在G1/S期交界处发挥检查点的功能:
当其检查发现染色体DNA损伤时,通过刺激CKI表达引起C1期阻滞,并启动DNA修复;
如修复失败则启动细胞凋亡,把可能演变为癌的细胞消灭在萌芽状态。
因此p53有“分子警察”之美誉。
(3)其他
癌基因c-myc编码的蛋白具有双向调节作用。
作为重要的转录调节因子,c-myc既可激活介导细胞增殖的基因诱导细胞增殖,也可激活介导细胞凋亡的基因而诱导凋亡。
细胞在其影响下增殖或凋亡主要取决于细胞接受何种信号以及细胞所处的生长环境。
4.细胞凋亡调控相关的酶
(1)半胱天冬酶(caspase)
Caspase是一组对底物天冬氨酸部位有特异水解作用的蛋白酶,其活性中心富含半胱氨酸。
Caspase是细胞凋亡的执行者,以酶原形式存在
细胞凋亡启动型:caspase 8~10
细胞凋亡效应型:caspase 3、6、7
Caspase在细胞凋亡过程中的功能:
灭活凋亡抑制蛋白
细胞结构解体
分解细胞骨架蛋白
瓦解核结构成核碎片
形成凋亡小体
(2)内源性核苷酸内切酶
以酶原形式存在、Ca2+/Mg2+依赖
(3)其他
组织型转谷氨酰胺酶(tissue-type transglutaminase)亦与凋亡小体的形成有关。
三、细胞凋亡调控异常与疾病
适度的凋亡具有重要的生理意义:
①确保正常生长发育:如人胚胎肢芽发育过程中指(趾)间组织,通过凋亡而被逐渐消除,形成指(趾)间隙;
②维持内环境稳定:如清除针对自身抗原的T淋巴细胞,以维持免疫系统功能的稳定;
③发挥积极的防御功能:受病毒感染细胞(如HIV感染的CD4+细胞)发生凋亡,阻止病毒的复制。
由此可见适时适度凋亡是维持细胞群体数量稳态的重要手段,否则将影响正常生长、发育、促进衰老,甚至导致各种疾病,包括调亡不足或(和)过度相关性疾病。
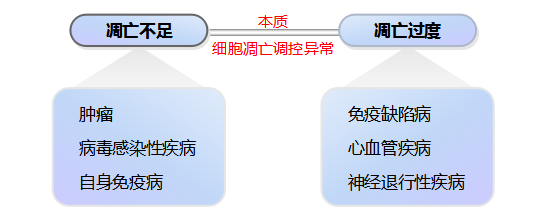
1. 细胞凋亡不足与疾病
细胞凋亡不足与多种疾病密切相关,包括肿瘤、自身免疫病和病毒感染性疾病等。
其共同特点是细胞凋亡不足,细胞群体稳态被破坏,导致病变细胞异常增多,病变组织器官体积增大,功能异常。
其中最常见为肿瘤:
如p53基因突变导致细胞凋亡减弱,显著增加肺非小细胞肺癌发生率;
Bcl-2的高表达与B细胞淋巴瘤、神经母细胞瘤、白血病、前列腺癌和结肠癌等预后不良相关;
高度恶性的皮肤基底细胞癌和Bowen瘤组织细胞凋亡减少与肿瘤的浸润和转移相关。
肿瘤细胞凋亡不足的相关机制
(1)凋亡调控相关信号的异常
促凋亡信号TNF/Fas L↓, 抑凋亡信号EGF↑
(2)凋亡诱导相关信号转导通路的障碍
Fas信号转导通路异常
乳腺癌组织中Fas受体低表达
(3)凋亡实施相关基因表达的异常
Bcl-2, p53
乳腺癌、肝癌、膀胱癌等多种癌组织Bcl-2高水平表达、p53突变或缺失
(4)凋亡执行相关酶活性的异常
Caspase 活性↓
2. 细胞凋亡过度与疾病
细胞凋亡过度与多种疾病密切相关,,包括免疫缺陷疾病、心血管疾病和神经元退行性疾病等。
其共同特点是细胞凋亡过度,细胞死亡大于新生,细胞群体的稳态被破坏,导致细胞异常减少,组织器官体积变小,功能异常。
其中获得性免疫缺陷综合征( acquired immunodeficiency syndrome , AIDS)尤为典型。
AIDS( 也称艾滋病)是由人类免疫缺陷病毒( human immunodeficiency virus , HIV)感染而引发的一种传染性疾病,其关键的发病机制是CD4+淋巴细胞被选择性的过度破坏,以致CD4+淋巴细胞数显著减少而导致相关免疫功能缺陷。
既往研究认为,CD4+淋巴细胞减少与凋亡密切相关,HIV感染的CD4+淋巴细胞凋亡过度的相关机制涉及以下多方面:
(1)Gp120糖蛋白表达,与CD4+表面的受体结合触发CD4+淋巴细胞凋亡
(2)合胞体形成中、后均可发生调亡而解体
(3)Fas基因表达的上调
(4)T细胞激活后不会增殖而是凋亡
(5)细胞因子TNF分泌增多,易启动死亡程序
(6)Tat蛋白产生并进入CD4+淋巴细胞,自由基产生
研究表明,受感染的CD4+淋巴细胞可作为效应细胞诱导未受感染CD4+淋巴细胞凋亡,这是HIV慢性感染时CD4+细胞数量极度减少的主要原因。有报道提及效应细胞可能通过Tat蛋白诱导未被HIV感染的CD4+淋巴细胞凋亡。
此外,有些疾病过程中还存在细胞凋亡不足和过度共存的现象。
如血管动脉粥样硬化时,可见其内皮细胞呈现凋亡过度,而平滑肌细胞则是凋亡不足。
四、细胞凋亡调控与疾病的防治
合理利用细胞凋亡相关信号
干预细胞凋亡相关的信号转导通路
调节细胞凋亡相关的基因
控制细胞凋亡相关的酶
防止线粒体跨膜电位的下降


