基本概念
原子半径(Atomic Radius)是描述原子大小的参数之一。
原子半径通常指原子的尺寸,并不是一个精确的物理量,并且在不同的环境下数值也不同。一个特定的原子的半径值和所选用的原子半径的定义相关,而在不同的环境下给原子半径不同定义比统一的定义更合适。
根据不同的标度和测量方法,原子半径的定义不同,常见的有轨道半径,范德华半径(也称范式半径),共价半径,金属半径等。同一原子依不同定义得到的原子半径差别可能很大,所以比较不同原子的相对大小时,取用的数据来源必须一致。
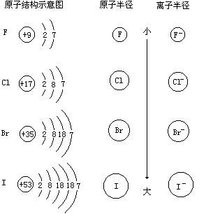
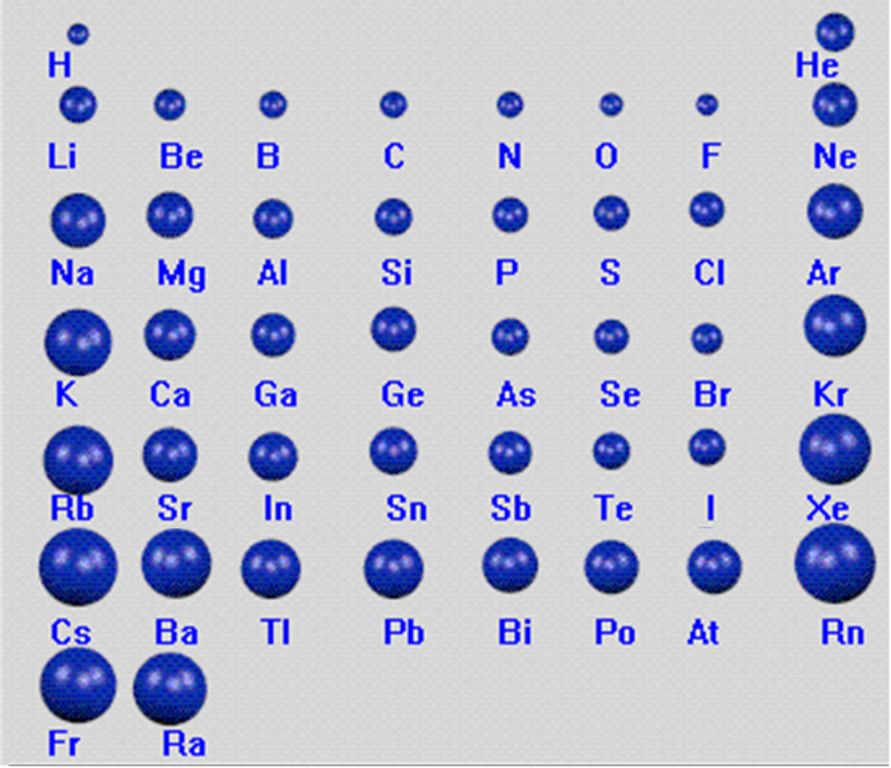
原子半径主要受电子层数,核电荷数和最外层电子数三个因素影响。一般来说,电子层数越多,核电荷数越小,最外层电子数越少,原子半径越大。这也使得原子半径在元素周期表上有明显的周期递变性规律。
原子半径对元素的化学性质有较大影响,所以对原子半径的研究在化学的发展中有着极其重要的意义和价值。
基本种类
共价半径:两原子之间(原子可以相同也可以不相同)以共价键结合时,两核间距离的一半。实际上核间距离即是共价键的键长。
金属半径:金属晶体中相邻两金属原子间距离的一半。
范式半径:靠范德华力相互吸引的相邻不同分子中的两个相同原子核间距离的一半。
影响因素
1. 是核电荷数,核电荷数越多其核对核外电子的引力越大(使电子向核收缩)则原子半径越小;
2. 是核外电子数,因电子运动要占据一定的空间则电子数越多原子半径越大;
随着原子序数的增加,原子核电荷增加。原子核的电荷是正的,吸引负电子。在一个元素周期内,原子核的电荷增加,而新增加的电子在同一层里,导致电子层的半径减小,从而影响到原子半径的减小。遮蔽效应也是重要因素。内层电荷对外层电荷的排斥力,将外层电荷“向外推”。
周期性
原子半径在同一元素周期内从左到右递减,在同一族内从上到下递增。造成这种现在的部分原因是电子的分布不是完全自由的。原子内部的电子按照电子层排列,每个电子层只能容纳固定数量的电子。元素周期表的每个一新的周期和一个新的电子层对应,离原子核也越来越远。