一、回顾1-3章主要知识点
(一)理想气体
1、定义:分子本身没有体积,分子间没有作用力
2、理想气体状态方程:

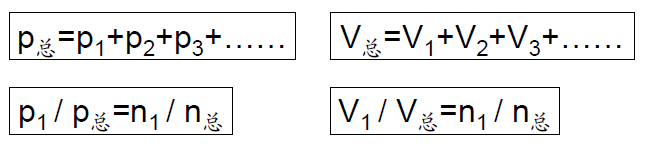
3、理想气体分压、分体积定律
(二)化学反应速率与化学平衡
1、元反应和经验速率方程
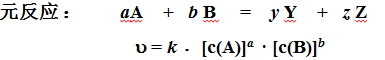
2、可逆反应与标准平衡常数
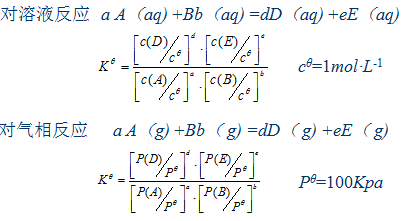
3、转化率

4、化学平衡的移动
吕·查德里原理:如果改变平衡系统中某个条件(如浓度、温度、压力),平衡总是向着减弱这个改变的方向移动。
(三)电解质溶液和离子平衡
1、电解质溶液的概念
2、水的解离平衡与溶液的pH值
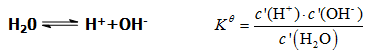
![]()
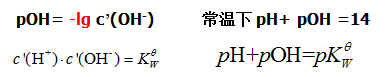
3、弱酸、弱碱的解离平衡

4、同离子效应和缓冲溶液
向弱电解质溶液中加入具有相同离子(阳离子或阴离子)的强电解质后,弱电解质离解度降低的现象
常见缓冲离子对
5、盐类的水解
谁解方程式的书写,水解规则的理解
6、沉淀-溶解平衡
Kspθ称为溶度积常数
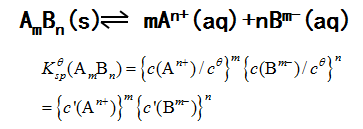
溶解度与溶度积的换算,影响沉淀溶解平衡的因素,溶度积规则

(四)氧化还原反应:有电子得失或电子转移的反应,被称为氧化还原反应
氧化:物质失去电子(或电子偏离)的过程
还原:物质获得电子(或电子偏向)的过程
2、氧化还原反应方程式的配平
①氧化数法:还原剂的氧化数升高总数等于氧化剂的氧化数降低总数。
②离子电子法:还原剂失去电子总数等于氧化剂得到电子总数。
3、原电池
原电池:利用氧化还原反应把化学能转变为电能的装置.
Cu-Zn原电池
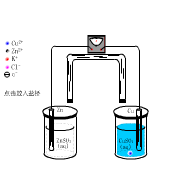

电极与电池符号
![]()
4、标准电极电势
把各种电极做成标准电极,与标准氢电极组成原电池,再测出这些标准电池的电动势,即可得标准电极电势。
Nernst方程式:

(五)原子结构和元素周期律
1、四个量子数
主量子数n(电子层)
角量子数l :能级(电子亚层)
磁量子数m:轨道(电子云的伸展方向)
自旋量子数ms
2、、原子中电子的排布
(1) 能量最低原理
(2) 泡利不相容原理
(3) 洪德规则
3、、元素周期律
周期律:元素以及由其形成的单质与化合物的性质,随着原子序数(核电荷数)的递增,呈周期性的变化。
元素周期表:周期律的图表形式
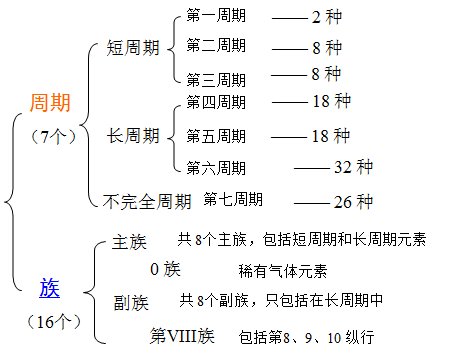
4、、元素性质的周期性
(1) 有效核电荷
(2) 原子半径
(3) 电离能
(4) 电子亲和能
(5) 电负性
(6) 元素的金属性和非金属性
(7) 元素的氧化值
5、、离子键
本质:静电力
键的离子性与元素的电负性有关
离子键没有方向性和饱和性
6、、共价键
(1) 共价键结合力的本质是电性的
(2) 共用电子对绕着两个原子核运动,而在两核之间出现的概率较大。
(3) 共价键具有饱和性
(4) 共价键具有方向性
共价键的键型:σ键和π键、配位共价键
7、、分子间作用力(范德华力)、氢键
(六)配位化合物
1、概念、命名
2、稳定常数


