滴定分析法
又称容量分析法,将一种已知准确浓度的滴定剂(标准溶液),逐滴地连续地滴加到被测物质的溶液中(滴定),直到所滴加的标准溶液与被测物质按化学计量关系定量反应完全(化学计量点)为止,然后根据标准溶液的浓度和消耗的体积,通过定量关系计算被测物质含量的方法。
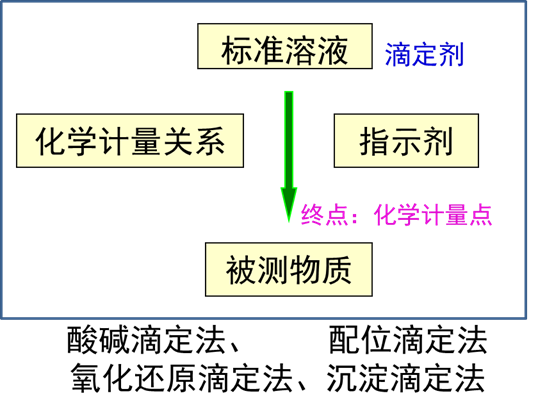
基本术语
Ø滴定:将滴定剂通过滴管滴入待测溶液中的过程
Ø滴定剂:浓度准确已知的试样溶液
Ø指示剂:滴定分析中能发生颜色改变而指示终点的试剂
Ø滴定终点:滴定分析中指示剂发生颜色改变的那一点(实际,ep)
Ø化学计量点:滴定剂与待测溶液按化学计量关系反应完全的那一点(理论,sp)
Ø滴定误差:滴定终点和化学计量点之间的差异
滴定反应的条件
1、滴定反应的被测物与标准溶液间具有确定的计量关系
2、滴定反应必须定量地进行完全。反应定量完成的程度要>99.9% (为定量计算的基础)
3、反应迅速
4、有灵敏、简便确定滴定终点的方法
5、有较好的选择性,不干扰或可以消除干扰
主要方式
1、直接滴定法(direct titration) :(最常用、最基本的滴定方式)
——用标准溶液直接滴定被测物质溶液。
2、返滴定法(back titration) (剩余滴定法)
——先准确加入过量标准溶液,使与试液中的待测物质或固体试样进行反应,待反应完成以后,再用另一种标准溶液滴定剩余的标准溶液的方法。
ü适用:反应较慢或难溶于水的固体试样。
3、置换滴定法(replacement titration)
先用适当试剂与待测物质反应,定量置换出另一种物质,再用标准溶液去滴定该物质的方法。
ü适用:无明确定量关系的反应。
4、间接滴定法(indirect titration):
通过另外的化学反应,以滴定法定量进行。
ü适用:不能与滴定剂起化学反应的物质。
本小节微课
本节自测题


