吸光光度分析及误差控制
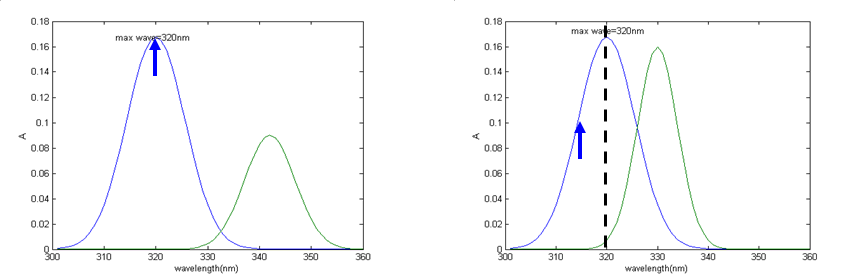
一、测定波长选择
选择原则:“吸收最大,干扰最小”。
二、参比溶液选择
参比溶液:用于仪器调零,消除吸收池壁和溶液对入射光的反射或吸收带来的误差,扣除干扰。
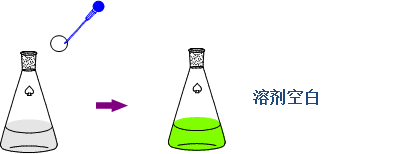
1、溶剂参比
——试样简单、共存其它成分对测定波长吸收弱,只考虑消除溶剂与吸收池等因素;
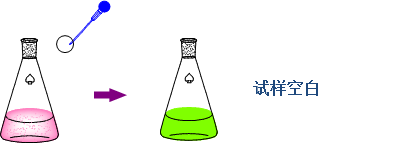
2、试样参比
——如果试样基体溶液在测定波长有吸收,而显色剂不与试样基体显色时,可按与显色反应相同的条件处理试样,只是不加入显色剂。
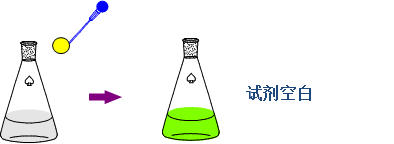
3、试剂参比
——若显色剂或其它试剂在测定波长有吸收,按显色反应相同的条件,不加入试样,同样加入试剂和溶剂做参比。
4、平行操作参比
——用不含被测组分的试样,在相同条件下与被测试样同时进行处理。
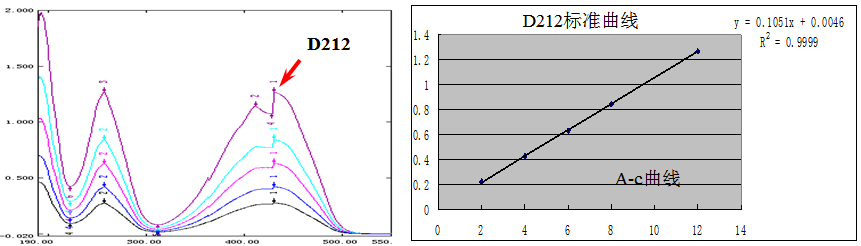
三、标准曲线的制作
标准曲线:用于定量分析。基于朗伯-比尔定律,A~c 成正比。测定一系列不同含量的标准溶液的吸光度,以吸光度 vs 待测组分含量作图,得到一条通过原点的直线。在同样条件下测得待测溶液吸光度,可通过标准曲线查到相应的含量值。
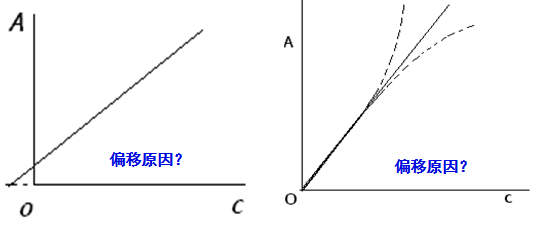
四、对朗伯-比尔定律的偏移
在实际测量中发现,A与b总是成正比,但A与c并不总是成正比,导致朗伯-比尔定律的偏离。比如:
1、光学因素——非单色光、非平行光引起的偏移
① 非单色光
单色器提供的单色光λ0 是具有一定的通带宽度,△λ(即带宽)。
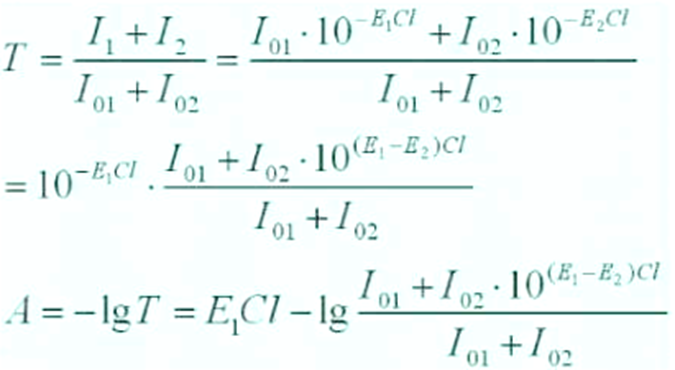
非单色光的吸收,导致标准曲线不经过{0.0}点。
② 杂散光
杂散光,不在谱带宽度范围内或与所需波长相隔较远的光。
一台高质量的紫外可见光光度计,杂散光应很小;在仪器光谱感应区的极端,杂散光引起的误差较大;高吸光度时,杂散光引起的相对误差大。
③ 散射光和反射光
④ 非平行光

非平行光,导致标准曲线不经过{0.0}点。
2、溶液物理化学因素——非均匀介质及化学反应(浓溶液)
① 化学反应
② 非均匀介质
③ 干扰物质
3、消除干扰因素
控制酸度,加入掩蔽剂,调整干扰离子价态,合适的参比溶液,优化显色条件,分离
五、吸光度测量的误差
在分光光度计上,吸光度读数的标尺刻度不均匀

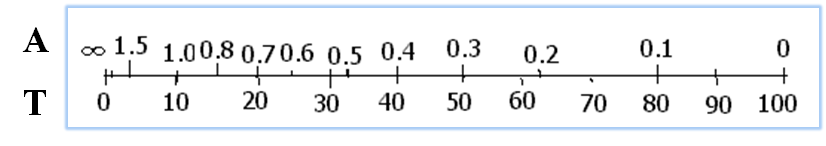
测量吸光度,导致的相对误差计算如下:
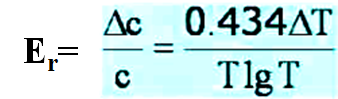
相对误差Er vs 透过率T曲线:
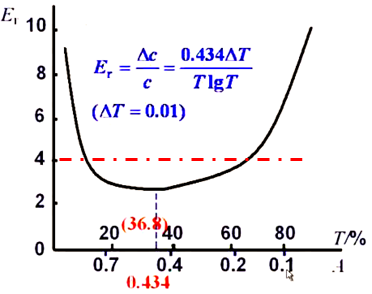
图上:A=0.434,T=36. 8%时,测量的相对误差最小。
![]()
本小节微课
本节自测题


