物质对光的选择性吸收
一、光的基本性质
光:是一种电磁波,具有波粒二象性。

◆ 一定波长的光具有一定的能量,波长越长(频率越低),光量子的能量越低。
◆ 可见光的波长范围为400-750 nm,相当于光子具有3.1-1.7 eV的能量。
◆ 单色光:具有相同能量(相同波长)的光。
◆ 混合光:具有不同能量(不同波长)的光复合在一起。
◆ 互补光:按一定比例混合可以得到白光的两种特定颜色的光。

二、物质对光的选择性吸收
1、物质显色
物质的颜色是因其吸收了某一颜色的光,呈现出了互补光的颜色。
【思考:高锰酸钾和硫酸铜分别吸收什么颜色的光?】
2、选择性吸收
(1) 同一种物质对不同波长的光表现出不同的吸收能力,称之谓选择吸收现象。
(2) 不同的物质对光的选择吸收性质是不同的。
(3) 物质并不是对单一波长的光进行吸收,而是吸收一个波长带的光。
三、量子解释


电子能级E电——电子相对于原子核的运动
振动能级E振——原子核在其平衡位置附近的相对振动
转动能级E转——分子本身绕其重心的转动
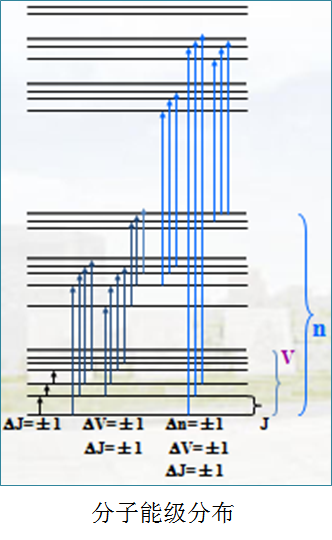
分子内部运动过程中,电子可以获得能量,从低能级跃迁到高能级,吸收与能级间能量差DE相等能量的光,符合普朗克条件DE = hn。各类能级能量差的数量级如下图:

如图所示:可见光3.1-1.7 eV的光子能量可以满足分子的电子跃迁、振动、转动等运动形式所需的能量。
◆ 物质对光呈现选择吸收的原因:
单一吸光物质的分子或离子只有有限数量的量子化能级,这些能级间的能量差值是限定的,因此吸收的光是选择性的,必须符合普朗克条件。
◆ 选择性吸收的意义:
各物质分子能级千差万别,内部各能级间的间隔也不相同,选择性吸收反映了分子内部结构的差异。
◆ 选择性吸收的特点:
因为电子跃迁时不可避免的伴随着发生振动能级和转动能级的跃迁,选择性吸收形成的是吸收带。
本小节微课


