酸碱滴定法的应用示例
一、常用酸碱标准溶液的配制与标定
1、酸标准溶液:HCl(HNO3,H2SO4)
配制方法:间接法(HCl易挥发,H2SO4易吸湿)
配制浓度:0.01~1 mol/L
标定方法:
基准物:Na2CO3易吸湿,300度干燥1小时,干燥器中冷却;
化学计量关系:1:2;
sp点pH:3.9
硼砂(Na2B4O7·10H2O) 易风化失水,湿度为60%的密闭容器保存;
化学计量关系:1:2;
sp点pH:5.1
指示剂:甲基红,甲基橙
2、碱标准溶液:NaOH
配制方法:间接法——浓碱法(NaOH易吸水和CO2,NaOH较贵)
配制浓度:0.01~1 mol/L
标定方法:
基准物:邻苯二甲酸氢钾(KHC8H4O4),纯净,易保存,质量大;
化学计量关系:1:1;
pKa= 5.4
草酸(H2C2O4•2H2O),稳定;
化学计量关系:1:2;
pKa1= 1.25,pKa2= 4.29
指示剂:酚酞
二、常用酸碱滴定应用示例
1、直接法测定药用NaOH溶液
目的:NaOH与Na2CO3混合碱的测定
(1)双指示剂法
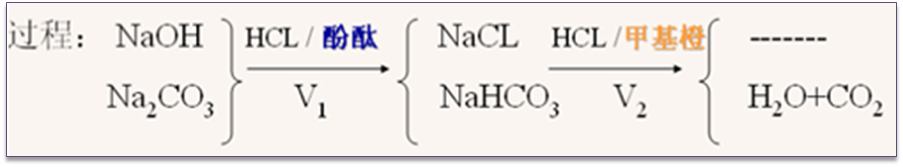
(2)BaCl2法——繁琐,准确度更高
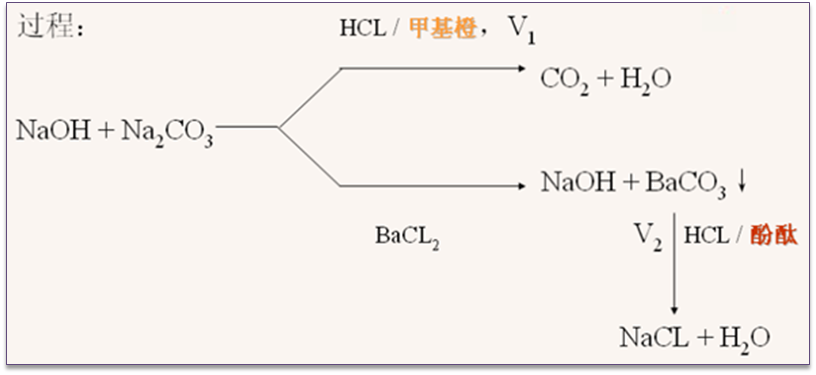
2、有机含氮化合物中氮的测定
(1)蒸馏法(凯氏定氮法)

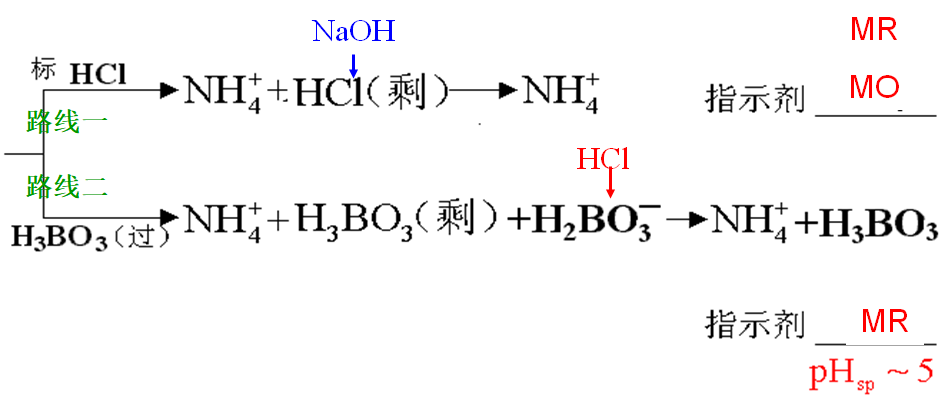
(2)甲醛法(自学)
3、磷的分离与测定
4、硅的测定
5、醛和酮 的测定
6、极弱酸的测定:硼酸(H3BO3)的测定
小结
酸碱滴定法一章需要掌握和了解:
u 酸碱反应的定义,平衡常数;
u 分布系数d的计算;
u 各类溶液的pH值的计算:
•会写质子条件式;了解精确式如何得来;会用近似式和最简式;
u 酸碱滴定法原理
•滴定突跃,指示剂,滴定曲线
•酸碱指示剂:了解作用原理,影响因素,掌握常用指示剂(MO,MR, PP)的变色区间和变色点;
u 酸碱滴定的应用和计算
本小节微课
本节自测题


